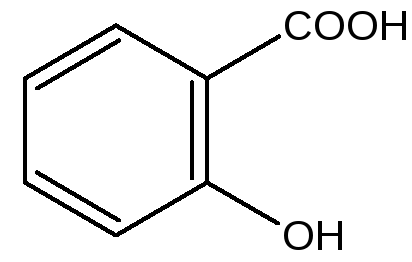
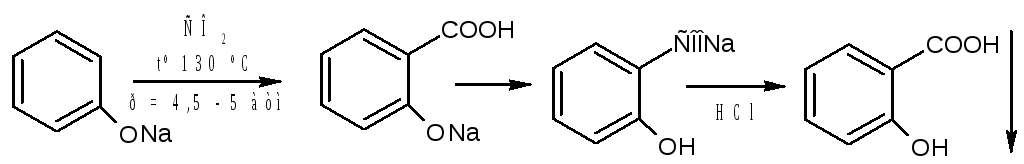
Получение кислоты салициловой проводят по методу Кольбе-Шмидта. Исходным веществом является фенол, который выпаривают досуха с эквивалентным количеством натрия гидроксида. Сухой натрия фенолят нагревают в автоклаве с диоксидом углерода при температуре 130 0 С, при этом образуется натрия салицилат. Продукт реакции подкисляют кислотой хлористоводородной и получают кислоту салициловую, которую затем очищают путём перекристаллизации из воды
Кислота салициловая – это игольчатые кристаллы или белый кристаллический порошок, мало растворимый в воде, легко растворимый в спирте и эфире. При медленном нагревании возгоняется, при быстром происходит разложение кислоты салициловой до фенола и углекислоты
Кислота салициловая является довольно сильной. По кислотным свойствам (рКа=2,975) она сильнее уксусной (рКа=4, 75) и бензойной (рКа=4,2).
Подлинность кислоты салициловой устанавливают по совпадению ИК-спектра образца с ИК-спектром, прилагаемым к НД.
С раствором железа(III) хлорида кислота салициловая даёт фиолетовое окрашивание, которое при повышении значения рН может переходить в красное (рН 3-8) и жёлтое (рН выше 8).
Реакция нейтрализации. Урок 26. Химия 7 класс.
При добавлении к кислоте салициловой раствора фенола в кислоте серной концентрированной появляется красное окрашивание
Можно использовать реакцию образования метилсалицилата, который имеет характерный запах
Кислота салициловая реагирует с бромной водой, при этом образуется осадок трибромфенола
Иногда эту реакцию используют для количественного броматометрического определения кислоты салициловой.
Количественное определение кислоты салициловой проводят алкалиметрическим методом в спиртовом растворе
Кислота салициловая обладает бактерицидными, болеутоляющими и жаропонижающими свойствами. Однако при перроральном применении кислота салициловая вызывает сильное раздражение слизистой оболочки желудка, поэтому применяется она только наружно в виде спиртового раствора или линимента «Камфоцина», который назначают при ревматизме. Кислота салициловая проявляет также кератолитическое действие и применяется в виде мазей и пластырей.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Кислота салициловая
Точную навеску препарата растворяют в воде в колбе с притертой пробкой, прибавляют эфир (для выделения бензойной кислоты), несколько капель смешанного индикатора (1 мл раствора метилового оранжевого и 1 мл раствора метиленового синего) и титруют 0,5М раствором соляной кислоты до появления сиреневой окраски в водном слое.
Хранение. В хорошо укупоренной таре.
Применение. Отхаркивающее средство (порошки, растворы); дезинфицирующее в виде ингаляций 5% раствора при кашле.
См. Учебно-методическое пособие по внутриаптечному контролю: заготовка и фасовка — раствор натрия бензоата (микстура).
Лабораторная работа №2. Классы неорганических веществ: оксидов, оснований, кислот.
Фенолокислоты – производные ароматических кислот, имеют фенольный гидроксил.
Простейший представитель — салициловая кислота.
Химические свойства обусловлены:
1) свойствами бензольного кольца;
2) свойствами — COOH группы;
3) свойствами фенольного гидроксила.
| С7Н6О3 | М. в. 138,12 |
Салициловая кислота содержится в свободном состоянии (цветки ромашки) в эфирных маслах (гвоздичное).
Получение. В 1839 году выделена из ивы (salix).
Синтез по методу Кольбе из фенолята натрия.

Описание. Белые мелкие игольчатые кристаллы или легкий кристаллический порошок, без запаха. Летуч с водяным паром. При осторожном нагревании возгоняется.
Растворимость. Мало растворим в воде, растворим в кипящей воде, легко растворим в спирте, эфире, трудно растворим в хлороформе.
Подлинность.
1) С раствором хлорида окисного железа; появляется сине-фиолетовое окрашивание, исчезающее от прибавления нескольких капель разведенной соляной кислоты и неисчезающее от прибавления нескольких капель разведенной уксусной кислоты.
2) Препарат нагревают с цитратом натрия; ощущается запах фенола.
3) Препарат нагревают с концентрированной серной кислотой и выделяющийся газ пропускают через известковую воду; появляется муть (реакция декарбоксилирования).
4) Водный раствор имеет кислую реакцию.
5) С реактивом Марки (концентрированная серная кислота + формальдегид) образуется малиновое окрашивание при слабом нагревании (образование ауринового красителя).
Количественное определение.
Точную навеску препарата растворяют в нейтрализованном по фенолфталеину спирте и титруют с тем же индикатором 0,1М раствором едкого натра до розового окрашивания.

УЧ=1, формула прямого титрования
Хранение. В хорошо укупоренной таре, предохраняющей от действия света.
Применение. Антиceптическое, кератолитическое средство. Применяют наружно в виде спиртовых растворов, мазей как бактерицидное; специфическое средство при суставном ревматизме, разрушающее ороговевшую ткань.
Сама салициловая кислота применяется как антисептическое средство только наружно, т.к. обладает ярко выраженным раздражающим действием. Внутрь применяются только ее производные:

1. Соли, образованные за счет – COOH группы (натрия салицилат).
2. Амид салициловой кислоты (салициламид).
3. Эфиры, образованные за счет фенольного гидроксила (ацетилсалициловая кислота).
4. Эфиры, образованные за счет – COOH группы (фенилсалицилат).
Источник: studopedia.su
Кислота салициловая Натрия салицилат
Салициловую кислоту карбоксилированием фенолята натрия по реакции Кольбе-Шмидта:
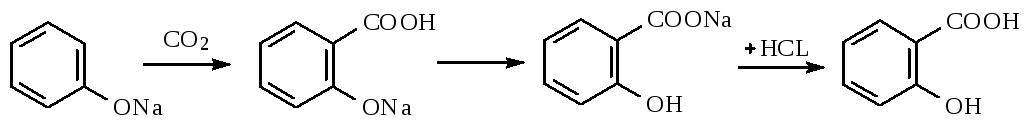
Механизм реакции Кольбе-Шмидта заключается в электрофильной атаке диоксидом углерода бензольного ядра. Фенольный гидроксил ориентирует заместитель в орто- и пара- положение. Но присутствие катиона натрия Na + позволяет получать преимущественно орто- оксибензойную (салициловую) кислоту, с ионом К + получается смесь о- и п- оксибензойных кислот. Внутримолекулярная перегруппировка основана на том, что СООН – вытесняет фенолы из их солей, как более сильная кислота. Образовавшийся салицилат натрия подкисляют НCl и выделившуюся салициловую кислоту перекристаллизовывают.
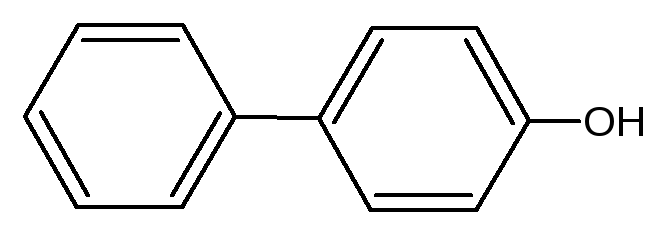
Как побочный продукт может образовываться оксидифенил – примесь способа получения
Натрия салицилат получают, нейтрализуя салициловую кислоту натрия гидрокарбонатом:
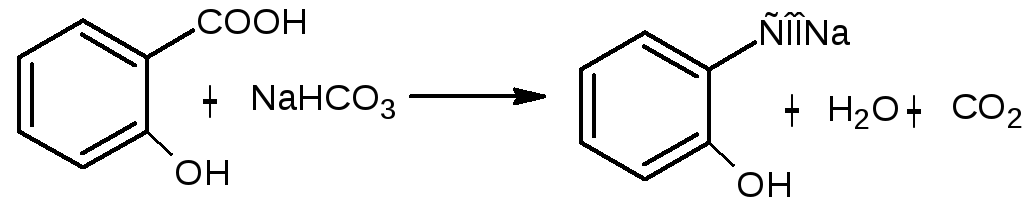
Описанне
Кислота салициловая – белые мелкие игольчатые кристаллы или легкий кристаллический порошок без запаха. При осторожном нагревании возгоняется, летуч с водяным паром.
Натрия салицилат – белый кристаллический или аморфный порошок без запаха.
Растворимость
Кислота мало растворима в воде, растворима в кипящей воде, легко растворяется в этаноле, эфире.
Натриевая соль очень легко растворима в воде, растворима в спирте, не растворима в эфире.
Подлинность
1. ИК-спектр поглощения натрия салицилата в области 4000-400 см-1 . (спреcсованный в таблетках с калия бромидом) должен полностью совпадать с прилагаемым к ФС рисункам спектра.
2. УФ-спектр раствора кислоты салициловой в растворе кислоты серной имеет два максимума поглощения при 235±2 и 300±2 нм.
3.Реакция солеобразования с хлоридом железа (III) на салицилат-ион. (общая ФС реакция)
Эффект реакции — образование сине-фиолетового(салициловая кислота) или красно-фиолетового (салицилат натрия) окрашивания. Окрашивание исчезает при добавлении минеральной кислоты и выпадает осадок кислоты. При добавлении СН3СООН окраска сохраняется.
Реакция обусловлена кислотными свойствами карбоксильной группы и фенольного гидроксила. Состав и цвет комплекса зависят от соотношения реактива и препарата, и от рН среды:
А) при рН=2,0-3,0 образуется моносалицилат, окрашенный в сине-фиолетовый цвет. Этот комплекс разрушается при рН=1,0 и ниже (минеральная кислота) и выпадает осадок белого цвета.
ГФ кислоты салициловой
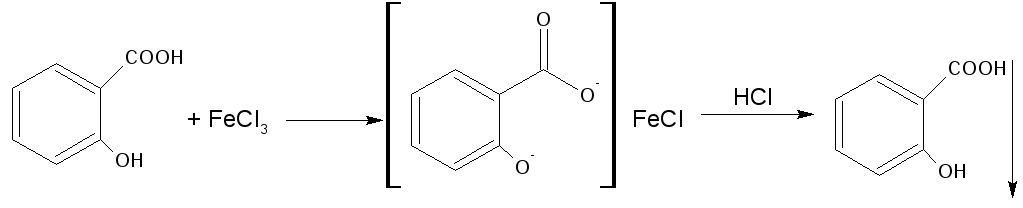
Сине -фиолетовое окраш. белый

или
Б) при рН=3,0-8,0 образуется дисалицилат красно-фиолетового цвета. Реакция идет между натрия салицилатом и FeCl3, т.е. кислоту предварительно переводят в натриевую соль.
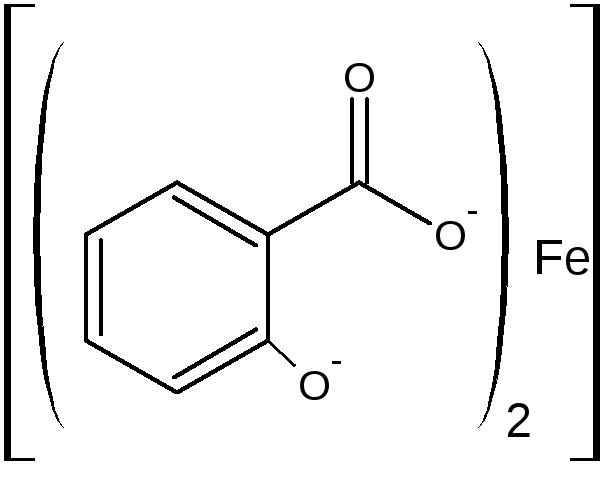 или
или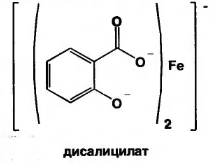
красно-фиолетовый
В) при рН=8,0-10,0 (одна капля раствора аммиака) образуется трисалицилат желтого цвета.
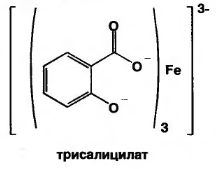 или
или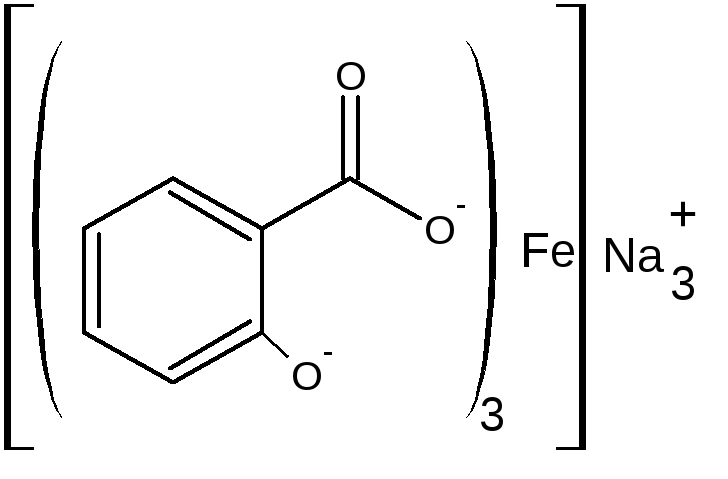
Источник: studfile.net