Альдегиды окисляются значительно легче, чем кетоны. При окислении альдегидов образуются соответствующие карбоновые кислоты, а окисление кетонов обычными окислителями чаще всего проходит деструктивно, с разрывом связей в углеродной цепи и дает смесь продуктов, принадлежащих к разным классам.
Из общей закономерности выбивается муравьиный альдегид, который при окислении как правило превращается не в карбоновую кислоту, а в оксид углерода (IV).
$HCOH = CO_2 + H_2O$.
Для окисления альдегидов используют щелочной или нейтральный раствор $KMnO_4$, сернокислый раствор $K_2Cr_2O_7$ или $CrO_3$, а для окисления кетонов — пероксидные соединения, содержащие перекисные мостиковые группы $-O-O-$, например, пероксиуксусную кислоту $CH_3-C(O)-OOH$, мононадсерную кислоту $H_2SO_5$ и особенно трифторпероксиуксусную кислоту $CF_2-C(O)-OOH$.
Альдегиды окисляются значительно легче, чем первичные и вторичные спирты. Альдегиды окисляются до карбоновых кислот при действии многих окислителей: азотной кислоты, соединений хрома (VI), щелочного раствора йода, перекиси водорода, оксида серебра, перманаганата калия, гидроксида меди.
Альдегиды значительно менее доступны, чем соответствующие кислоты. Исключение составляют альдегиды, которые добывают из природных соединений. В связи с этим препаративное значение имеет в первую очередь окисление именно этих альдегидов.
Окисление перманганатом калия и оксидом серебра
Очень широко используют окисление перманганатом калия в щелочной среде. Но этот метод можно использовать только для альдегидов, которые в силу своего строения, не могут вступать в конденсации типа альдольной или кротоновой, то есть тех, которые не содержат атомов водорода в $alpha$-положении к альдегидной группе. Например, из анисового альдегида синтезируют анисовую кислоту с выходом 85%:
«Окисление альдегидов и кетонов»
Готовые курсовые работы и рефераты
Решение учебных вопросов в 2 клика
Помощь в написании учебной работы
Ароматические альдегиды, содержащие чувствительные к действию других окислителей группы, хорошо превращаются в соответствующие кислоты при действии оксида серебра в щелочной среде. Так, например, ванилин окисляется до ванилиновой кислоты:
Окисление азотной кислотой
Окисление альдегидов азотной кислотой различной концентрации можно использовать для получения карбоновых кислот как алифатического, так и ароматического рядов. Например, окисление $beta$-хлоропропионового альдегида дымящейся азотной кислотой приводит к образованию $beta$-хлоропропионовой кислоты с выходом 70%:
Аналогично с хлоральгидрату получают трихлоруксусную кислоту с выходом 55%.
Применяя менее концентрированную 25%-ную азотную кислоту можно окислять альдегидную группу в присутствии вторичной спиртовой группы. Этим методом из молочного альдегида получают молочную кислоту:
Стоит отметить, что первичные спиртовые группы в этих условиях окисляются до альдегидных.
Окисление другими окислителями
Особенностью альдегидов является их способность окисляться кислородом воздуха — т.н. аутоокисление альдегидов, которое будет рассмотрено в отдельном разделе. Эта реакция происходит свободнорадикальным механизмом. Например, окисление бензальдегида приводит к бензойной кислоте из-за образования промежуточного соединения — надбензойной кислоты.
Принципиально иным путем происходит окисление альдегидов, содержащие алкильные фрагменты, диоксидом селена ($SeO_2$). В этом случае происходит окисление метильной или метиленовой группы, которая находится рядом с альдегидной, а альдегидная группа не затрагивается. Например, уксусный альдегид при действии диоксида селена в уксусной кислоте образует глиоксаль:
Качественные реакции на альдегидную оксогруппу основанные на ее окислении
Альдегиды легко окисляются в присутствии многих окислителей в соответствующие кислот. Так, широко используют для идентификации альдегидов реакции их окисления под действием гидроксида меди $Cu(OH)_2$ и других окислителей.
Качественные реакции на альдегидную оксогруппу базируются на восстановительной способности альдегидов. Кетоны в такие реакции не вступают. Существует несколько известных качественных реакций, в которых применяются различные качественные реагенты:
-
Реактив Толленса — оксид одновалентного серебра в виде аммиачного комплекса $[Ag(NH_3)_2]ОН$ дает наглядную реакцию «серебряного зеркала»:
Рисунок 7. При действии реактивом Фелинга на альдегиды образуется красный осадок $Cu_2O$ — реакция «медного зеркала».
Рисунок 8. Для упрощения записи схему реакции «медного зеркала» при взаимодействии альдегидов с реактивом Фелинга записывают так:
Источник: spravochnick.ru
Физические и химические свойства альдегидов и кетонов

В молекулах альдегидов и кетонов отсутствуют атомы водорода, способные к образованию водородных связей. Поэтому их температуры кипения ниже, чем у соответствующих спиртов. Метаналь (формальдегид) — газ, альдегиды С2–C5 и кетоны С3–С4 — жидкости, высшие — твердые вещества.
Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает.
Химические свойства
Для карбонильных соединений характерны реакции различных типов:
· присоединение по карбонильной группе;
· восстановление и окисление.
Большинство реакций альдегидов и кетонов протекает по механизму нуклеофильного присоединения (AN) по связи С=О.
Реакционная способность в таких реакциях уменьшается от альдегидов к кетонам:
Это объясняется, главным образом, двумя факторами:
· углеводородные радикалы у группы С=О увеличивают пространственные препятствия присоединению к карбонильному атому углерода новых атомов или атомных групп;
· углеводородные радикалы за счет +I-эффекта уменьшают положительный заряд на карбонильном атоме углерода, что затрудняет присоединение нуклеофильного реагента.
1. Присоединение водорода (восстановление):
R-CH=O + H2 t,Ni → R-CH2-OH (первичный спирт)
2. Присоединение циановодородной кислоты (синильной):
Эта реакция используется для удлинения углеродной цепи, а также для получения α-гидроксикислот R-CH(COOH)OH по схеме:
CH 3— CH ( CN )- OH циангидрин –яд! в ядрах косточек вишен, слив
3. Со спиртами – получают полуацетали и ацетали:
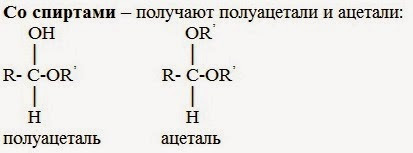
Полуацетали — соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами.
Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии кислоты) приводит к замещению полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:
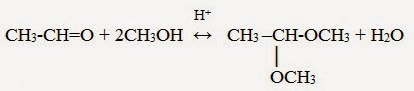
Ацетали — соединения, в которых атом углерода связан с двумя алкоксильными
4. Присоединение воды:

5. Присоединение реактива Гриньяра (используется для получения первичных спиртов, кроме метанола):
R-X ( р — р в диэтиловом эфире ) + Mg стружка → R-Mg-X ( реактив Гриньяра ) + Q
Здесь R – алкильный или арильный радикал; Х – это галоген.
HCH = O + CH 3— Mg — Cl → CH 3— CH 2— O — Mg — Cl (присоединение)
CH 3— CH 2— O — Mg — Cl + H 2 O → CH 3— CH 2— OH + Mg ( OH ) Cl (гидролиз)
6. Взаимодействие с аммиаком
1. Реакция серебряного зеркала – качественная реакция на альдегидную группу:
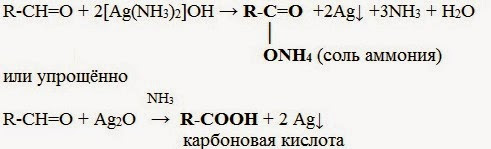
Кетоны не вступают в реакцию «серебряного зеркала». Они окисляются с трудом лишь при действии более сильных окислителей и повышенной температуре. При этом происходит разрыв С–С-связей (соседних с карбонилом) и образование смеси карбоновых кислот меньшей молекулярной массы.
2. Окисление гидроксидом меди( II ):
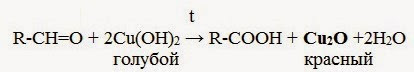
3. Альдегиды могут быть окислены до кислот бромной водой
С галогенами:
здесь , ClCH2-CH=O — хлоруксусный альдегид
n CH2=O t,kat → ( -CH2-O-)n полиформальдегид
n H — CH = O + ( n +1) C 6 H 5— OH t , kat → nH 2 O + [- C 6 H 3( OH )- CH 2— C 6 H 3( OH )-] n фенолформальдегидная смола
Источник: www.yoursystemeducation.com
Окислительно–восстановительные реакции альдегидов и кетонов.
И альдегиды, и кетоны горят с образованием углекислого газа и воды:
Аутоокисление альдегидов.
Альдегиды могут самопроизвольно окисляться кислородом воздуха. Такой процесс называется аутоокислением:
Окисление сильными окислителями в жидкой фазе в кислой среде.
Альдегиды можно окислить с помощью хромовой кислоты, например:
пропаналь пропановая кислота
Или перманганатом калия в кислой среде, например:
Или с помощью азотной кислоты:
1,4-бутандиаль 1,4-бутандиовая (янтарная)кислота
Окисление альдегидов в нейтральной среде.
Альдегиды легко окисляются гипохлоридами натрия и кальция до кислот:
Гидроксид меди (II) при комнатной температуре медленно окисляет альдегиды до карбоновых кислот, сам восстанвливаясь при этом до жёлтого гидроксида меди (I). Последний при нагревании до ≈ 70 О С разлагается на кирпично-красный оксид меди (I) и воду:
Окисление альдегидов реактивом Толленса — реакция серебряного зеркала.
Гидроксид диамминсеребра – реактив Толленса легко при комнатной температуре окисляет альдегиды до аммонийных солей карбоновых кислот:
Если стенки стеклянного сосуда, в котором проводилась эта реакция обезжирена, например, действием щелочного раствора перманганата калия, то на стенке образуется зеркальный слой серебра. Поэтому реакция носит название «реакции серебряного зеркала».
Реакция Канниццаро.
Ароматические и гетероциклические альдегиды в щелочной среде диспропорционируют на соответствующие спирты и кислоты:
бензальдегид бензиловый спирт бензойная кислота
фурфурол фурфуриловый спирт 2-фуранкарбоновая (2-формилфуран) (2-фурилкарбинол) кислота
Алифатические альдегиды так же вступают в эту реакцию, но альдольные конденсации в щелочной среде проходят быстрее и исходный альдегид обычно осмоляется. Однако, если в α-положении нет атомов водорода, то реакция с хорошим выходом проходит и для алифатических альдегидов. Эта реакция называется реакцией Канниццаро-Тищенко:
пивалевый альдегид неопентиловый спирт пивалевая кислота
Формальдегид в щелочной среде так же легко диспропорционирует:
метаналь метанол формиат натрия
Если к смеси ароматического альдегида с избытком формальдегида добавить щелочи, то идет перекрестная реакция Канниццаро, в которой ароматический альдегид восстанавливается, а алифатический окисляется:
Если к безводному альдегиду добавить каталитическое количество алкоголята алюминия, то получается сложный эфир:
Эта реакция носит название реакции Кляйзена – Тищенко.
Реакция Меервейна – Понндорфа – Верлея.
Альдегиды и кетоны можно восстановить с помощью первичного или вторичного спирта в присутствии соответствующих алкоголятов алюминия. Реакция обратима, и равновесие в ней сдвигается в сторону восстановления исходного альдегида большим избытком спирта:
Восстановление альдегидов и кетонов водорода на гетерогенных катализаторах.
Альдегиды и кетоны можно восстанавливать до первичных и вторичных спиртов соответственно на палладии, платине, хуже на никеле:
2-метилпропаналь 2-метилпропанол (первичный)
3-метилбутанон-2 3-метилбутанол-2 (вторичный)
Восстановление альдегидов и кетонов амальгамированным цинком в соляной кислоте.
По Клемменсену альдегиды и кетоны можно восстановить до алканов:
Источник: studfile.net