Дисахариды – это сахароподобные сложные углеводы, молекулы которых при гидролизе распадаются на две молекулы моносахаридов. Молекулярная формула С12Н22О11. Дисахариды содержатся в продуктах природного происхождения: сахароза (свекловичный сахар) в большом количестве, до 28%, – в сахарной свёкле; лактоза (молочный сахар) – в молоке; трегалоза (грибной сахар) – в грибах; мальтоза (солодовый сахар) образуется при частичном гидролизе крахмала и др.
По своему строению дисахариды представляют собой гликозиды. В зависимости от того, какой гидроксил второго моносахарида участвует в образовании связи с первым моносахаридом, различают дисахариды двух типов: восстанавливающие (редуцирующие); невосстанавливающие.
Восстанавливающие дисахариды называют гликозил-гликозами; связь между моносахаридными молекулами у этих дисахаридов образована за счёт полуацетального гидроксила одной молекулы и спиртового гидроксила (чаще всего при четвёртом атоме углерода) второй молекулы. Важнейшие представители: мальтоза, лактоза, целлобиоза. В растворе они находятся в таутомерных формах: циклической (полуацетальной) и гидроксикарбонильной (альдегидной).
При гидролизе мальтозы получили глюкозу, масса которой на 13,5 г больше массы исходного дисахарида
лактоза
(полуацетальная форма) (гидроксикарбонильная форма)
Строение. В состав дисахаридов могут входить два одинаковых или различных моносахарида в полуацетальной (циклической) форме.
Так, молекула мальтозы (солодовый сахар) состоит из двух молекул α-D-глюкозы в пиранозной форме, связанных между собой
l-4-α-гликозидной связью.
Во втором моносахаридном остатке молекулы мальтозы сохраняется свободный полуацетальный гидроксил. По этой причине в растворе мальтоза может существовать в таутомерных формах: циклической и гидроксикарбонильной, находящихся между собой в динамическом равновесии.
(полуацетальная форма) (гидроксикарбонильная форма)
По такому принципу построены все восстанавливающие дисахариды (лактоза, целлобиоза и др.).
Свойства восстанавливающих (редуцирующих) дисахаридов. Восстанавливающие дисахариды – это кристаллические вещества, хорошо растворимые в воде, имеют сладкий вкус, гигроскопичны. Растворы этих дисахаридов нейтральны, обладают оптической активностью. В химическом отношении восстанавливающие дисахариды проявляют свойства альдегидов: дают реакцию серебряного зеркала, восстанавливают жидкость Фелинга, реагируют с реактивами на карбонильную группу (с фенилгидразином, гидроксиламином). За счёт полуацетального гидроксила дисахариды образуют гликозиды, а также проявляют свойства многоатомных спиртов: вступают в реакции алкилирования, ацилирования, дают качественную реакцию на многоатомные спирты (растворяют Сu(ОН)2).
мальтоза (альдегидная форма) мальтобионовая кислота
Эта группа дисахаридов способна восстанавливать Ag + до Ag 0 в реакции серебряного зеркала, Сu 2+ до Сu + в реакции с раствором Фелинга, поэтому они и называются восстанавливающими дисахаридами. Как все сложные углеводы, дисахариды способны гидролизоваться под действием минеральных кислот или ферментов.
Укажите признаки, свойственные для сахарозы. 1) образует реакции серебряного зеркала; 2) не
Невосстанавливающие дисахариды называют гликозил-гликозидами; связь между моносахаридами у этих дисахаридов образована с участием обоих полуацетальных гидроксилов, поэтому они не могут переходить в другие таутомерные формы. Важнейшими их представителями являются сахароза и трегалоза.
трегалоза сахароза
Молекула трегалозы состоит из двух остатков α-D-глюкопи-ранозы, молекула сахарозы – из остатка α-D-глюкопиранозы и остатка β-D-фруктофуранозы. Так как у дисахаридов этой группы связь между моносахаридами осуществляется за счёт обоих полуацетальных гидроксилов, они не могут таутомерно переходить в оксикарбонильную форму, следовательно, не могут давать реакции на карбонильную группу, в том числе и на альдегидную группу (не дают реакцию серебряного зеркала, не реагируют с раствором Фелинга). Такие дисахариды не способны проявлять восстанавливающие свойства, поэтому их называют невосстанавливающими дисахаридами. Они проявляют свойства многоатомных спиртов (растворяют гидроксид меди, вступают в реакции алкилирования и ацилирования), как все сложные углеводы гидролизуются в присутствии минеральных кислот или под действием ферментов.
Строение и свойства сахарозы. Сахароза (свекловичный сахар) – один из наиболее давно известных человеку пищевых продуктов. Первоначально сахароза была выделена из сахарного тростника, а затем – из сахарной свеклы. Сахароза содержится и во многих других растениях (кукуруза, клён, пальма и др.).
Молекулярный состав сахарозы С12Н22О11.
Молекула сахарозы состоит из двух моносахаридов: глюкозы в α-D-пиранозной форме и фруктозы в β-D-фуранозной форме, связанных между собой 1-2-гликозидной связью с участием двух полуацетальных (гликозидных) гидроксилов. В молекуле сахарозы нет свободных полуацетальных гидроксилов, поэтому она не может таутомерно переходить в гидроксикарбонильную форму.
При нагревании выше 160°С сахароза частично разлагается, выделяя воду и превращаясь в бурую массу – карамель.
Водный раствор сахарозы растворяет гидроксид меди, образуя раствор сахарата меди, проявляет при этом свойства многоатомных спиртов. При нагревании раствора сахарозы в присутствии минеральных кислот сахароза гидролизуется, в результате образуется смесь глюкозы и фруктозы в равных количествах (искусственный мёд). Процесс гидролиза сахарозы называется инверсией, так как при этом наблюдается изменение правого вращения раствора на левое.
Сахароза широко используется как пищевой продукт, в производстве кондитерских, хлебобулочных изделий, варенья, компотов, джемов и др. В фармакологии используется для приготовления сиропов, микстур, порошков и т.п.
Эфиры сахарозы и высших жирных кислот обладают высокой моющей способностью и используются как промышленные детергенты. Эти продукты не имеют запаха, совершенно неядовиты и полностью разрушаются бактериями при биологической самоочистке воды.
Диэфиры высших жирных кислот и сахарозы используются как эмульгаторы при получении маргарина, лекарственных препаратов и в косметике.
Октаметилсахароза применяется в промышленности пластмасс как пластификатор.
Октаацетат сахарозы используется в качестве промежуточного слоя при получении стекла триплекс.
Отходы сахарного производства (патока) употребляются для производства этилового спирта и в кондитерской промышленности.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
3.8.3. Углеводы (моносахариды, дисахариды, полисахариды).

Углеводы — органические соединения, чаще всего природного происхождения, состоящие только из углерода, водорода и кислорода.
Углеводы играют огромную роль в жизнедеятельности всех живых организмов.
Свое название данный класс органических соединений получил за то, что первые изученные человеком углеводы имели общую формулу вида Cx(H2O)y . Т.е. их условно посчитали соединениями углерода и воды. Однако позднее оказалось, что состав некоторых углеводов отклоняется от этой формулы. Например, такой углевод как дезоксирибоза имеет формулу С5Н10О4. В то же время существуют некоторые соединения, формально соответствующие формуле Cx(H2O)y, однако к углеводам не относящиеся, как, например, формальдегид (СН2О) и уксусная кислота (С2Н4О2).
Тем не менее, термин «углеводы» исторически закрепился за данным классом соединений, в связи с чем повсеместно используется и в наше время.
Классификация углеводов
В зависимости от способности углеводов расщепляться при гидролизе на другие углеводы с меньшей молекулярной массой их делят на простые (моносахариды) и сложные (дисахариды, олигосахариды, полисахариды).
Как легко догадаться, из простых углеводов, т.е. моносахаридов, нельзя гидролизом получить углеводы с еще меньшей молекулярной массой.
При гидролизе одной молекулы дисахарида образуются две молекулы моносахарида, а при полном гидролизе одной молекулы любого полисахарида получается множество молекул моносахаридов.
Химические свойства моносахаридов на примере глюкозы и фруктозы
Самыми распространенными моносахаридами являются глюкоза и фруктоза, имеющие следующие структурные формулы:
Как можно заметить, и в молекуле глюкозы, и в молекуле фруктозы присутствует по 5 гидроксильных групп, в связи с чем их можно считать многоатомными спиртами.
В составе молекулы глюкозы имеется альдегидная группа, т.е. фактически глюкоза является многоатомным альдегидоспиртом.
В случае фруктозы можно обнаружить в ее молекуле кетонную группу, т.е. фруктоза является многоатомным кетоспиртом.
Химические свойства глюкозы и фруктозы как карбонильных соединений
Все моносахариды могут реагировать в присутствии катализаторов с водородом. При этом карбонильная группа восстанавливается до спиртовой гидроксильной. Так, в частности, гидрированием глюкозы в промышленности получают искусственный подсластитель – гексаатомный спирт сорбит:
Молекула глюкозы содержит в своем составе альдегидную группу, в связи с чем логично предположить, что ее водные растворы дают качественные реакции на альдегиды. И действительно, при нагревании водного раствора глюкозы со свежеосажденным гидроксидом меди (II) так же, как и в случае любого другого альдегида, наблюдается выпадение из раствора кирпично-красного осадка оксида меди (I). При этом альдегидная группа глюкозы окисляется до карбоксильной – образуется глюконовая кислота:
Также глюкоза вступает и в реакцию «серебряного зеркала» при действии на нее аммиачного раствора оксида серебра. Однако, в отличие от предыдущей реакции вместо глюконовой кислоты образуется ее соль – глюконат аммония, т.к. в растворе присутствует растворенный аммиак:
Фруктоза и другие моносахариды, являющиеся многоатомными кетоспиртами, в качественные реакции на альдегиды не вступают.
Химические свойства глюкозы и фруктозы как многоатомных спиртов
Поскольку моносахариды, в том числе глюкоза и фруктоза, имеют в составе молекул несколько гидроксильных групп. Все они дают качественную реакцию на многоатомные спирты. В частности, в водных растворах моносахаридов растворяется свежеосажденный гидроксид меди (II). При этом вместо голубого осадка Cu(OH)2 образуется темно-синий раствор комплексных соединений меди.
Спиртовое брожение
При действии на глюкозу некоторых ферментов глюкоза способна превращаться в этиловый спирт и углекислый газ:
Молочнокислое брожение
Помимо спиртового типа брожения существует также и немало других. Например, молочнокислое брожение, которое протекает при скисании молока, квашении капусты и огурцов:
Особенности существования моносахаридов в водных растворах
Моносахариды существуют в водном растворе в трех формах – двух циклических (альфа- и бета-) и одной нециклической (обычной). Так, например, в растворе глюкозы существует следующее равновесие:
Как можно видеть, в циклических формах отсутствует альдегидная группа, в связи с тем что она участвует в образовании цикла. На ее основе образуется новая гидроксильная группа, которую называют ацетальным гидроксилом. Аналогичные переходы между циклическими и нециклической формами наблюдаются и для всех других моносахаридов.
Дисахариды. Химические свойства.
Общее описание дисахаридов
Дисахаридами называют углеводы, молекулы которых состоят из двух остатков моносахаридов, связанных между собой за счет конденсации двух полуацетальных гидроксилов либо же одного спиртового гидроксила и одного полуацетального. Связи, образующиеся таким образом между остатками моносахаридов, называют гликозидными. Формулу большинства дисахаридов можно записать как C12H22O11.
Наиболее часто встречающимся дисахаридом является всем знакомый сахар, химиками называемый сахарозой. Молекула данного углевода образована циклическими остатками одной молекулы глюкозы и одной молекулы фруктозы. Связь между остатками дисахаридов в данном случае реализуется за счет отщепления воды от двух полуацетальных гидроксилов:
Поскольку связь между остатками моносахаридов образована при конденсации двух ацетальных гидроксилов, для молекулы сахара невозможно раскрытие ни одного из циклов, т.е. невозможен переход в карбонильную форму. В связи с этим сахароза не способна давать качественные реакции на альдегиды.
Подобного рода дисахариды, которые не дают качественные реакции на альдегиды, называют невосстанавливающими сахарами.
Тем не менее, существуют дисахариды, которые дают качественные реакции на альдегидную группу. Такая ситуация возможна, когда в молекуле дисахарида остался полуацетальный гидроксил из альдегидной группы одной из исходных молекул моносахаридов.
В частности, в реакцию с аммиачным раствором оксида серебра, а также гидроксидом меди (II) подобно альдегидам вступает мальтоза. Связано это с тем, что в её водных растворах существует следующее равновесие:
Как можно видеть, в водных растворах мальтоза существует в виде двух форм – с двумя циклами в молекуле и одним циклом в молекуле и альдегидной группой. По этой причине мальтоза, в отличие от сахарозы, дает качественную реакцию на альдегиды.
Гидролиз дисахаридов
Все дисахариды способны вступать в реакцию гидролиза, катализируемую кислотами, а также различными ферментами. В ходе такой реакции из одной молекулы исходного дисахарида образуется две молекулы моносахарида, которые могут быть как одинаковыми, так и различными в зависимости от состава исходного моносахарида.
Так, например, гидролиз сахарозы приводит к образованию глюкозы и фруктозы в равных количествах:
А при гидролизе мальтозы образуется только глюкоза:
Дисахариды как многоатомные спирты
Дисахариды, являясь многоатомными спиртами, дают соответствующую качественную реакцию с гидроксидом меди (II), т.е. при добавлении их водного раствора ко свежеосажденному гидроксиду меди (II) нерастворимый в воде голубой осадок Cu(OH)2 растворяется с образованием темно-синего раствора.
Полисахариды. Крахмал и целлюлоза
Полисахариды — сложные углеводы, молекулы которых состоят из большого числа остатков моносахаридов, связанных между собой гликозидными связями.
Есть и другое определение полисахаридов:
Полисахаридами называют сложные углеводы, молекулы которых образуют при полном гидролизе большое число молекул моносахаридов.
В общем случае формула полисахаридов может быть записана как (C6H10O5)n.
Крахмал – вещество, представляющее собой белый аморфный порошок, не растворимый в холодной воде и частично растворимый в горячей с образованием коллоидного раствора, называемого в быту крахмальным клейстером.
Крахмал образуется из углекислого газа и воды в процессе фотосинтеза в зеленых частях растений под действием энергии солнечного света. В наибольших количествах крахмал содержится в картофельных клубнях, пшеничных, рисовых и кукурузных зернах. По этой причине указанные источники крахмала и являются сырьем для его получения в промышленности.
Целлюлоза – вещество, в чистом состоянии представляющее собой белый порошок, не растворимый ни в холодной, ни в горячей воде. В отличие от крахмала целлюлоза не образует клейстер. Практически из чистой целлюлозы состоит фильтровальная бумага, хлопковая вата, тополиный пух. И крахмал, и целлюлоза являются продуктами растительного происхождения.
Однако, роли, которые они играют в жизни растений, различны. Целлюлоза является в основном строительным материалом, в частности, главным образом ей образованы оболочки растительных клеток. Крахмал же несет в основном запасающую, энергетическую функцию.
Химические свойства крахмала и целлюлозы
Горение
Все полисахариды, в том числе крахмал и целлюлоза, при полном сгорании в кислороде образуют углекислый газ и воду:
Образование глюкозы
При полном гидролизе как крахмала, так и целлюлозы образуется один и тот же моносахарид – глюкоза:
Качественная реакция на крахмал
При действии йода на что-либо, в чем содержится крахмал, появляется синее окрашивание. При нагревании синяя окраска исчезает, при охлаждении появляется вновь.
При сухой перегонке целлюлозы, в частности древесины, происходит ее частичное разложение с образованием таких низкомолекулярных продуктов как метиловый спирт, уксусная кислота, ацетон и т.д.
Поскольку и в молекулах крахмала, и в молекулах целлюлозы имеются спиртовые гидроксильные группы, данные соединения способны вступать в реакции этерификации как с органическими, так и с неорганическими кислотами:
Источник: scienceforyou.ru
Лабораторная работа № 5 Свойства углеводов
Опыт 1. Реакция серебряного зеркала – это реакция восстановления серебра из аммиачного раствора оксида серебра (реактив Толленса).
В водном растворе аммиака оксид серебра растворяется с образованием комплексного соединения — гидроксид диамминсеребра(I) [Ag(NH3)2]OH
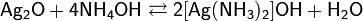
при добавлении к которому альдегида происходит окислительно-восстановительная реакция с образованием металлического серебра:
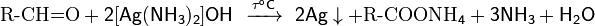
Если реакция проводится в сосуде с чистыми и гладкими стенками, то серебро выпадает в виде тонкой плёнки, образуя зеркальную поверхность.
При наличии малейших загрязнений серебро выделяется в виде серого рыхлого осадка.
Реакция «серебряного зеркала» может использоваться как качественная реакция на альдегиды. Так, реакцию «серебряного зеркала» можно использовать как отличительную между глюкозой и фруктозой. Глюкоза относится к альдозам (содержит альдегидную группу в открытой форме), а фруктоза — к кетозам (содержащие кетогруппу в открытой форме). Поэтому глюкоза дает реакцию «серебряного зеркала», а фруктоза – нет. Но если в растворе присутствует щелочная среда, то кетозы изомеризуются в альдозы и также дают положительные реакции с аммиачным раствором оксида серебра (реактив Толленса).
Качественная реакция глюкозы с аммиачным раствором оксида серебра. Доказать наличие альдегидной группы в глюкозе можно с помощью аммиачного раствора оксида серебра. К аммиачному раствору оксида серебра добавим раствор глюкозы и подогреем смесь на водяной бане. Вскоре на стенках колбы начинает осаждаться металлическое серебро.
Эта реакция называется реакцией серебряного зеркала. Ее используют как качественную для открытия альдегидов. Альдегидная группа глюкозы окисляется до карбоксильной группы. Глюкоза превращается в глюконовую кислоту.
СН2ОН – (СНОН)4 – СОН + Ag2O = СН2ОН – (СНОН)4 – СООН + 2Ag↓
Порядок выполнения работы.
В две пробирки наливают по 2 мл. аммиачного раствора оксида серебра. В одну из них добавляют 2 мл. 1%-ного раствора глюкозы, в другую – фруктозы. Обе пробирки кипятят.
Амиачный раствор гидрата окиси серебра получают при взаимодействии нитрата серебра с гидроксидом натрия и гидроксидом аммония:
AgNO3+ NaOH → AgOH↓+ NaNO3,
AgOH + 2 NH4 OH→[ Ag(NH3)2] OH + H2O,
[Ag(NH3)2] OH + 3 H2→ Ag2O + 4 NH4 OH.
Принцип метода. На стенках пробирки с глюкозой образуется зеркало в результате выделения металлического серебра.
Оформление работы: Написать вывод, а также ход и уравнения реакции в тетрадь.
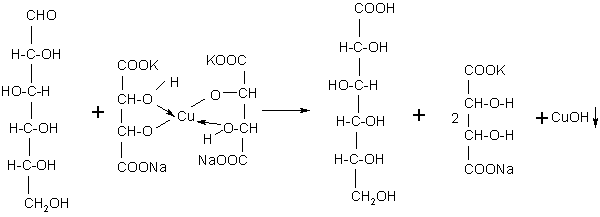
Опыт 2. Реакция Фелинга.
Принцип метода. В пробирке с глюкозой появляется кирпично-красное окрашивание от образующегося оксида меди (I).
По мере нагревания интенсивно-синий цвет реактива Фелинга изменяется. Первоначально появляется жёлтый осадок гидрата закиси меди, который постепенно переходит в закись меди и выпадает на дно пробирки в виде ярко-красного осадка. Находившаяся в растворе глюкоза полностью окисляется до глюконовой кислоты за счёт кислорода гидрата окиси меди.
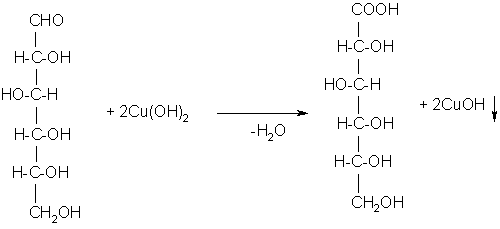
Глюкоза Глюконовая кислота
Реакция взаимодействия глюкозы с реактивом Фелинга
 2
2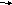 CuOHH2O+Cu2O
CuOHH2O+Cu2O
Порядок выполнения работы.
В две пробирки наливают: а) 2 мл. 1%-ного раствора глюкозы, б) 2 мл. 1%-ного раствора фруктозы. В обе пробирки добавляют по 1 мл реактива Фелинга, представляющего собой щелочной раствор комплексного соединения сульфата меди (II) с виннокислым калий-натрием в 10%-ном р-ре NaOH. Готовят непосредственно перед употреблением.
Обе пробирки нагревают до кипения.
Оформление работы: написать вывод, а также ход и уравнения реакции в тетрадь.
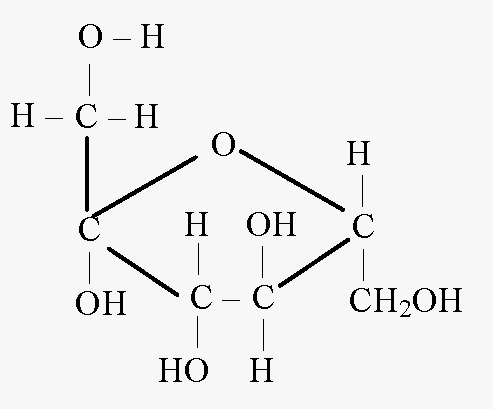
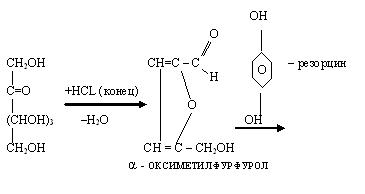
Опыт 3. Качественная реакция на фруктозу
Принцип метода. При нагревании пробы с фруктозой в присутствии резорцина и соляной кислоты до 80 о С через некоторое время в пробирке с фруктозой появляется ярко-красное окрашивание.
При нагревании пробы с фруктозой в присутствии резорцина и соляной кислоты появляется вишнево-красное окрашивание. Проба также применима для обнаружения других кетоз. Альдозы в этих же условиях взаимодействуют медленнее и дают бледно-розовую окраску или вообще не взаимодействуют. Открыта Ф. Ф. Селивановым в 1887 году.
Применяется при анализе мочи. Проба положительная при фруктозурии обменного или транспортного генеза. В 13 % случаев проба положительная при пищевой нагрузке фруктами и мёдом. Хим. формула фруктозы – C6H12O6
Циклическая формула фруктозы
R- осататок Окрашенное соединенue
Порядок выполнения работы.
В две пробирки наливают по 2 мл: в одну – 1%-ный раствор глюкозы, в другую – 1%-ный раствор фруктозы. В обе пробирки вносят по 2 мл реактива Селиванова: 0,05 г резорцина растворяют в 100 мл 20 %-ной соляной кислоты. Обе пробирки осторожно нагревают до 80 о С (до начала кипения). Появляется красное окрашивание.
Выводы: результаты опыта и уравнение реакции записывают в тетрадь.
Опыт 4. Качественная реакция на молочную кислоту
фенол хлорное железо образуется трихлоридфенолят железа
а) Взаимодействие фенола с хлоридом железа
трихлоридфенолят железа фенол
лактат лактат железа
б)Взаимодействие лактата стрихлоридфенолятом железа
Порядок выполнения работы.
В пробирку наливают 1 мл реактива Уфельмана и добавляют 0,5 мл раствора, содержащего молочную кислоту. Фиксируют изменение окраски.
Выводы: результаты опыта и уравнение реакции записывают в тетрадь.
Опыт 5. Реакция Троммера на моносахариды.
Принцип метода. В щелочной среде альдозы и некоторые дисахариды, имеющие потенциально свободную альдегидную группу или свободный гликозидный гидроксил окисляются до альдоновых кислот, одновременно восстанавливая медь(II) в медь(I). В данной реакции, образовавшийся вследствие взаимодействия NaOH и CuSO4 гидроксид меди(II) [имеет синюю окраску], восстанавливается до гидроксида меди(I) [желтая окраска], который далее распадается до Cu2 O [красная окраска закиси меди].
2NaOH + CuSO4→ Cu(OH)2↓+ Na2SO4

Глюкоза + 2Cu(OH)2глюконовая к-та + 2CuOH + 2H2O
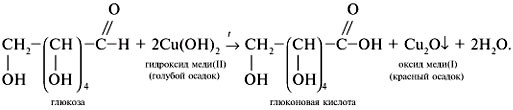
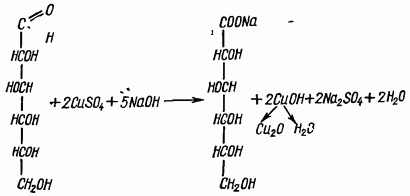
глюкоза глюконовая к-та
Порядок выполнения работы.
В пробирку наливают раствор глюкозы и 6-8 капель 2н NaOH. Затем по каплям добавляют 0,2 н раствор CuSO4 до образования нерастворимого голубого осадка. Осторожно нагревают пробирку на спиртовке. Голубой, не растворимый в воде осадок гидрата окиси меди (II) постепенно переходит в желтый, а затем в красный осадок закиси меди (I). Это указывает на положительную реакцию Троммера.
Избыток медной соли маскирует реакцию, так как гидроокись меди (II) при нагревании теряет воду и дает черный оксид меди (II).
Выводы: результаты опыта и уравнение реакции записывают в тетрадь.
Опыт 6. Реакция Барфеда
Принцип метода. Молекулы дисахаридов состоят из остатков двух молекул моносахаридов, соединенных гликозидной связью. К дисахаридам относятся: сахароза (свекловичный или тростниковый сахар), мальтоза (солодовый сахар), лактоза (молочный сахар), трегалоза (грибной сахар, микоза), целлобиоза (дисахарид, освобождающийся при гидролитическом расщеплении клетчатки) и др.
По типу связи между молекулами моноз дисахариды можно разделить на две группы: 1) построенные по типу мальтозы; 2) типа трегалозы.
Дисахариды мальтозного типа состоят из двух остатков моноз, соединенных в положении 1,4, т. е. кислородный мостик связывает первый атом углерода одной молекулы моносахарида с четвертым атомом углерода другой.
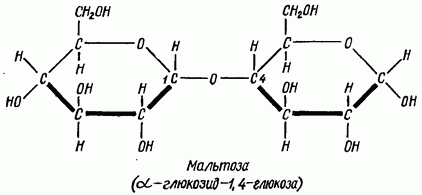
У мальтозы остается свободным один гликозидный гидроксил (карбонильная группа), поэтому дисахариды, построенные по типу мальтозы, сохраняют все реакции, свойственные карбонильной группе (Троммера, Бенедикта, Ниландера, с фелинговой жидкостью и т. д.).
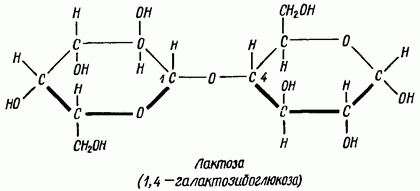
По мальтозному тйпу построены также лактоза и целлобиоза. При гидролизе лактозы освобождаются молекула а-глюкозы и молекула галактозы
Молекула целлобиозы гидролитически расщепляется на две молекулы -глюкозы. Следовательно, целлобиоза-р-глюкозид-1,4-глюкоза.
В молекулах дисахаридов, построенных по типу трегалозы, моносахариды соединены кислородным мостиком между двумя гликозидными гидроксилами (карбонильными группами). Поэтому дисахариды трегалозного типа лишены восстанавливающих свойств. К дисахаридам указанного типа относятся сахароза и трегалоза. Сахароза легко гидролизуется с образованием смеси равных количеств глюкозы и фруктозы, называемой инвертным сахаром. Инвертный сахар дает все реакции, характерные для моноз.
Реакция Барфеда позволяет быстро отличить моносахариды от дисахаридов мальтозного типа, обладающих, как известно, восстанавливающими свойствами (лактозы, мальтозы, целлобиозы). Она основана на том, что восстанавливающие свойства моносахаридов сохраняются также в кислой среде, тогда как дисахариды восстанавливают металлы только при щелочной реакции. При взаимодействии дисахаридов с реактивом Барфеда красный осадок закиси меди появляется не сразу, а лишь спустя некоторое время (15—20 мин.), когда произойдет их гидролитический распад, который катализируется кислотами.
Порядок выполнения работы.
Отличие восстанавливающих свойств дисахаридов от моносахаридов.
В три пробирки наливают по 1 мл реактива Барфеда (Реактив Барфеда можно готовить и по следующей прописи: в 200 мл горячей воды растворяют 13,3 г уксуснокислой меди. Помешивают до растворения соли, фильтруют.
К фильтрату прибавляют 1,9 мл ледяной уксусной кислоты — CH3 COOH.) и прибавляют по 1 мл в одну пробирку глюкозы (7%-ный раствор), в другую – мальтозы, а в третью лактозы (1%-ные растворы дисахаридов). Все пробирки нагревают на водяной бане в течение 10 мин. В пробирке с глюкозой образуется красный осадок оксида меди (I). Дисахариды этой реакции не дают.
Следует избегать длительного кипячения, т.к. дисахариды в кислой среде могут гидролизоваться до моносахаридов, и в результате реакция Барфеда станет положительной. Проба Барфеда отличается от других реакций восстановления тем, что окисление сахара протекает не в щелочной среде (где окисление протекает значительно легче, чем в нейтральной и особенно в кислой), а в среде слабо кислой. В этих условиях дисахариды практически не окисляются, что позволяет их отличить от моносахаридов.
Результат опыта занести в таблицу:
Источник: studfile.net