Это единения, содержащие карбонильную группу = С = О . У альдегидов карбонил связан радикалом и водородом. Общая формула альдегидов:
У кетонов карбонил связан с двумя радикалами. Общая формула кетонов:
Альдегиды являются более активными, чем кетоны (у кетонов карбонил как бы блокирован радикалами с обеих сторон).
Классификация
1.по углеводородному радикалу (предельные, непредельные, ароматические, циклические).
2.по числу карбонильных групп (одна, две и тд.)
Изомерия и номенклатура
Изомерия альдегидов обусловлена изомерией углеродного скелета. У кетонов помимо изомерии углеродного скелета наблюдается изомерия положения карбонильной группы. По тривиальной номенклатуре альдегиды называют соответственно карбоновым кислотам, в которые они переходят при окислении.
По научной номенклатуре названия альдегидов складываются из названий соответствующих углеводородов с добавлением окончания аль. Атом углерода альдегидной группы определяет начало нумерации. По эмпирической номенклатуре кетон называют по радикалам, связанным с карбоксилом с добавлением слова кетон. По научной номенклатуре названия кетонов складываются из названий соответствующих углеводородов с добавлением окончания ОН, в конце ставят номер углеродного атома, при котором стоит карбонил. Нумерацию начинают от ближайшего к кетонной группе конца цепи.
РЕАКЦИЯ СЕРЕБРЯНОГО ЗЕРКАЛА. КАЧЕСТВЕННАЯ РЕАКЦИЯ НА АЛЬДЕГИДЫ#shorts #chemistry #химия #эксперимент
Представители предельных альдегидов. CnH2n+1C=O
СН3 — СН2 — СН2 — С = О
СН3 — (СН2)3 — С = О
СН3 — (СН2)4 — С = О
Представители предельных кетонов
Способы получения
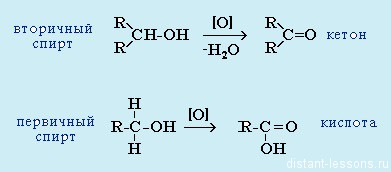
1) Путем окисления спиртов. Из первичных спиртов получаются альдегиды, из вторичных кетоны. Окисление спиртов происходит при действии сильных окислителей (хромовая смесь) при небольшом нагревании. В промышленности в качестве окисления используют кислород воздуха в присутствии катализатора — меди (Cu) при t0= 300-5000С
СН3 — СН2 — СН2 — ОН + О К2Cr2O7 CH3 — CH2 — C =O + HOH
СН3 — СН — СН3 + О К2Cr2O7 СН3 — С — СН3
пропанол -2 пропанон
2) Термическое разложение кальциевых солей карбоновых кислот, причем, если взть соль муравьиной кислоты, то образуются альдегиды, а если других кислот, то кетоны.
О — Са прокаливание СаСО3 + СН3 — С = О
О уксусный альдегид
О — Са прокаливание СаСО3 + СН3 — С = О
Это лабораторные способы получения.
3) По реакции Кучерова (из алкинов и воды, катализатор — соли ртути в кислой среде). Из ацетилена образуются альдегиды, из любых других алкинов — кетоны.
СН = СН + НОН СН2 = СН — ОН СН3 — С = О
ацетилен виниловый СН3
спирт уксусный альдегид
СН3 — С = СН + НОН СН3 — С = СН2 СН3 — С = О
пропенол — 2 ацетон
4) Оксосинтез. Это прямое взаимодействие алкенов с водным газом (СО+Н2) в присутствии кобальтового или никелевого катализаторов под давлением 100- 200 атмосфер при t0 = 100-2000С. По этому способу получают альдегиды
СН3 — СН2 — СН2 — С = О
СН3 — СН = СН2 + СО + Н2
ПОКРЫЛ ЁЛОЧНЫЕ ШАРЫ СЕРЕБРОМ. Реакция серебряного зеркала
5) Гидролиз дигалогенпроизводных. Если оба галогена находятся при первичном углеродном атоме, то образуется альдегид, если при вторичном — кетон.
СН3 — СН2 — С — CL2 + HOH 2HCL + CH3 — CH2 — C = O
СН3 — С — CH3 + HOH 2HCL + CH3 — C = O
Муравьиный альдегид — газ, другие низшие альдегиды и кетоны — жидкости, легко растворимые в воде; альдегиды обладают удушливым запахом, который при сильном разведении становится приятным(цветочным или фруктовым). Кетоны пахнут довольно приятно. Следовательно карбонил = С =О носитель запаха, поэтому альдегиды и кетоны применяются в парфюмерной промышленности. температура кипения альдегидов и кетонов возрастает по мере увеличения молекулярного веса.
Природа карбонильной группы
Большинство реакций альдегидов и кетонов обусловлено присутствием карбонильной группы. рассмотрим природу карбонила = С =О. например,
1.углерод с кислородом в карбониле связаны двойной связью : одна сигма — связь, другая пи — связь. За счет разрыва П- связи у альдегидов и кетонов идут реакции присоединения (нуклеофильного типа):
R — C = O R — C — O :
Кислород является более электроотрицательным элементом, чем углерод, и поэтому электронная плотность у атома кислорода больше, чем у атома углерода. При реакциях присоединения к углероду будет присоединяться нуклеофильная часть реагента, к кислороду — электрофильная часть.
2.приреакциях замещения может замещаться кислород карбонила. При этом происходит разрыв двойной связи между С и О
3.карбонил влияет на связи С — Н в радикале, ослабляя их, особенно в альфа-положении, то есть рядом с карбонильной группой.
Н — ?С -? С — ?С — С = О
При действии свободных галогенов будет замещаться водород в углеродном радикале при альфа- углеродном атоме.
СН3 — СН2 — СН2 — С = О + СL2 CH3 — CH2 — CH — C = O + HCL
Химические свойства
Из всех классов органических соединений альдегиды и кетоны самые реакционноспособные. Причем в химическом отношении альдегиды более активны, чем кетоны. Для них характерны следующие реакции: окисления, присоединения, замещения, полимеризации, конденсации. Для кетонов не характерны реакции полимеризации.
Альдегиды окисляются легко, даже слабыми окислителями HBrO, [Ag(NH3)2]OH, раствор Фелинга. При окислении альдегидов образуются карбоновые кислоты.
СН3 — С = О + О СН3 — С = О — уксусная кислота
Если окислителем является [Ag(NH3)2]OH , то выделяется свободное серебро (реакция «серебряного зеркала» — это качественная реакция на альдегиды).
СН3 — С = О + 2[Ag(NH3)2]OH СН3 — С = О + 2 Ag + 4 NH3 + Н2О
Окисление кетонов происходит гораздо труднее и только сильными окислителями. Продуктами окисления являются карбоновые кислоты. При окислении кетона образуется спиртокетон, затем дикетон, который, разрываясь, образует кислоты.
СН3 — СН2 — С — СН2 — СН3 + О СН3 — СН — С — СН2 — СН -Н2О+О СН3 — С — С — СН2 — СН3 +О +Н2О
диэтилкетон спиртокетон дикетон
СН3 — С = О + О = С — СН2 — СН3
уксусная к-та пропионовая к-та
В случае смешанного кетона окисление протекает по правилу Попова — Вагнера, то есть главное направление реакции — окисление соседнего с карбонилом наименее гидрированного атома углерода. Но помимо с главным направлением будет и побочное направление реакции, то есть окислится углеродный атом с другой стороны карбонила. При этом образуется смесь различных карбоновых кислот.
СН3 — С — СН — СН3 — спиртокетон +О — Н2О
СН3 — С — СН2 — СН3 ОН О
О СН2 — С — СН2 — СН3 + О — Н2О
СН3 — С — С — СН3 +О +Н2О 2 СН3 — С = О
дикетон уксусная кислота
СН-С — СН2 — СН3 + О +Н2О НС = О + СН3 — СН2 — С = О
дикетон муравьиная к-та пропионовая к-та
Протекают за счет разрыва пи-связи в карбониле. Эти реакции нуклеофильного присоединения, то есть сначала к положительно заряженному углероду карбонила присоединяется нуклеофильная часть реагента со свободной электронной парой (протекает медленно):
= С+ = О — + :Х — = С — О —
Вторая стадия — присоединение протона или другого катиона к образовавшемуся аниону (протекает быстро):
= С — О — + Н + = С — ОН
При этом из альдегидов получаются первичные спирты, из кетонов — вторичные. Реакция протекает в присутствии катализаторов Ni, Pt и др.
СН3 — С = О + Н + : Н — СН3 — С — Н
уксусный альдегид этанол
СН3 — С — СН3 + Н+ : Н — СН3 — СН — СН3
пропанон пропанол -2
2.Присоединение бисульфата натрия (гидросульфата):
R — C = O + HSO3Na R — C — SO3Na
При этом образуются бисульфитные производные. Эту реакцию используют для очистки альдегидов и кетонов и выделения их из примесей.
3.Присоединение синильной кислоты. При этом образуются ?- оксинитрилы, которые являются промежуточными продуктами синтеза оксикислот, аминокислот:
R — C = O + HCN R — C — C =N
4. Присоединение аммиака NH3. При этом образуются оксиамины.
R — C = O + H — NH2 CH3 — CH — NH2
5. Присоединение магнийгалогенорганических соединений (реактив Гриньяра). Реакцию используют для получения спиртов.
6.Присоединение спиртов (безводных). При этом первоначально образуются полуацетали (как обычная реакция присоединения). Затем при нагревании с избытком спирта образуются ацетали (как простые эфиры).
R — C = O + СН3 — ОН R — CН — О — СН3 +СН3ОН R — CН — О — СН3
В природе очень много соединений полуацетального и ацетального характера, особенно среди углеводов (сахаров).
Кислород карбонильных групп может замещаться на галогены и некоторые азотсодержащие соединения.
1.Замещение галогенами. Происходит при действии на альдегиды и кетоны фосфорных соединений галогенов PCL3 и PCL5. При действии же свободными галогенами замещается водород в углеводородном радикале при ?-углеродном атоме.
+ PCL5 CH3 — CH2 — CH -CL2 + POCL3
СН3 — СН2 — С = О 1,1-дихлорпопин (фосфора хлорокись)
Н +CL2 CH3 — CH — CH = O + HCL
2.Реакция с гидроксиамином NH2OH. При этом образуются окислы альдегидов (альдоксилы) и кетонов (кетоксины).
СН3 — СН = О + Н2N — OH CH3 — CH — N — OH + H2O
уксусный альдегид оксиэтаналь
Эту реакцию применяют для количественного определения карбоксильных соединений.
3.Реакция с гидразином NH2 — NH2 . Продуктами реакции являются гидразины (когда реагирует одна молекула альдегида или кетона) и азины (когда реагируют две молекулы).
СН3 — СН = О + NH2 — NH2 СН3 — СН = N — NH2
этаналь гидразин гидразин этаналь
СН3 — СН = N — NH2 + О = СН — СН3 СН3 — СН =N — N = НС — СН3
азин этаналь (альдазин)
СН3 — СН = О + Н2N — NH — C6H5 CH3 — CH = N — NH — C6H5
Окислы, гидразины, азины, фенилгидразины — твердые кристаллические вещества с характерными температурами плавления, по которым определяют природу (строение) карбонильного соединения.
Характерны только для альдегидов. Но и то, только газообразные и летучие альдегиды (муравьиный, уксусный) подвергаются полимеризации. Это очень удобно при хранении этих альдегидов. муравьиный альдегид полимеризуется в присутствии серной кислоты или соляной, при нормальной температуре. Коэффициент полимеризации n=10-50. Продукт полимеризации — твердое вещество, называется — полиоксиметилен (формалин).
Н — С = О — С — О — С — О — . — С — … — С — О —
Это твердое вещество, но его можно превратить в муравьиный альдегид, разбавляя водой и слегка подогревая.
Уксусный альдегид под влиянием кислот образует жидкий циклический триммер- паральдозу и твердый тетрамер — метальдозу («сухой спирт»).
СН3 — НС СН — СН3
4 СН3 — СН = О СН3 — НС О
1.Альдегиды в слабо основной среде (в присутствии ацетона калия, поташа, сульфата калия) подвергаются альдольной конденсации с образованием альдегидо — спиртов, сокращенно называемых альдолями. Разработана эта реакция химиком А.П. Бородиным (он же композитор). В реакции участвует одна молекула своей карбонильной группой, а другая молекула водородом при ?- углеродном атоме.
СН3 — СН = О + НСН2 — СН = О СН3 — СН — СН2 — СН = О
(3 — оксибутаналь или ?-оксимасляный альдегид)
СН3 — СН — СН2 — СН = О + НСН2 — СН = О СН3 — СН — СН2 — СН — СН2 -СН =О
С каждым разом увеличивается число групп ОН. Получается альдегидная смола при уплотнении большого числа молекул.
2. Кротоновая конденсация . для альдегидов она является продолжением альдольной конденсации, то есть при нагревании альдоль отщепляет воду с образованием непредельного альдегида.
СН3 — СН — СН2 — СН = О СН3 — СН = СН — С = О
Рассмотрим эти реакции для кетонов.
СН3 — С = О + НСН2 — С = О СН3 — С — СН2 — С = О СН3 — С = СН — С = О
СН3 СН3 ОН СН3 СН3 СН3 СН3
4 — окси — 4 — метилпентанон-2 4 — метилпентан -3-он-2
3.Сложноэфирная конденсация. Характерна только для альдегидов. Разработана В.Е.Тищенко. протекает в присутствии катализаторов алкоголятов алюминия (CH3 — CH2 — O)3 AL.
CH3 — CH = O + O = HC — CH3 CH3 — СН2 — О — С = О
Они содержат в углеводородном радикале двойную связь. Представители:
1.СН2 = СН — СН =О — пропен-2-аль — акриловый альдегид или акролеин
2.СН3 — СН = СН — СН = О — бутен — 2 — аль — кротоновый альдегид
Акролеин иначе называют чад, он получается при нагревании горении жиров. В химическом отношении непредельные альдегиды обладают всеми свойствами предельных по карбонильной группе, а за счет двойной связи в радикале могут вступать в реакции присоединения.
У этих альдегидов сопряженная система двойных связей, поэтому в химическом отношении они отличаются реакциями присоединения. Присоединение водорода, галогенов, галогенводородов происходит по концам сопряженной системы.
Электронная плотность смещена к кислороду и к нему направляются положительно заряженная часть реагента, а к положительно поляризованному углероду — отрицательная часть реагента.
СН2+ = СН- — СН+= О- + Н+: Br- CH2 — CH = CH — OH CH2 — CH2 — CH = O
Образующаяся при этом енольная форма альдегида немедленно превращается в более устойчивую карбонильную форму. Таким образом присоединение галогенводородов в радикал идет против правила Марковникова.
Ароматические альдегиды
Представители С6Н5 -СН = О — бензойный альдегид. Это жидкость с запахом горького миндаля, содержится в косточках слив, вишен, диких абрикос и других плодах.
Список использованной литературы
1) Гранберг И.И. Органическая химия. — М., 2002
2) Ким А.М. Органическая химия. — Новосибирск, 2007
Источник: www.e-ng.ru
§ 11. Альдегиды и кетоны


которая является частным случаем функциональной карбонильной группы
Под это определение не подпадает родоначальник гомологического ряда альдегидов — формальдегид, или муравьиный альдегид, или метаналь:

В его молекуле карбонильная группа связана с двумя атомами водорода.
Карбонильную группу содержат также и кетоны, только в них она связана с двумя углеводородными радикалами. Очевидно, что общая формула кетонов имеет вид

Простейшим представителем кетонов является ацетон, или диметилкетон (рис. 46):


Рис. 46.
Модель молекулы ацетона:
1 — шаростержневая; 2 — масштабная
Ацетон — это бесцветная летучая жидкость с характерным запахом. Его используют в качестве растворителя и при производстве полимерных материалов.
Однако вернемся к альдегидам.
Общим способом получения альдегидов является окисление соответствующих спиртов на медном катализаторе:

Уксусный альдегид, или этаналь, можно получить, как вы знаете, из ацетилена по реакции Кучерова:

Формальдегид (метаналь, муравьиный альдегид)

(рис. 47) — бесцветный газ с резким запахом, хорошо растворим в воде, очень ядовит. Метаналь применяют для производства фенолоформальдегидных пластмасс и многих лекарственных препаратов, например уротропина. Иногда спрессованный в виде брикетов уротропин применяют в качестве горючего (сухой спирт).

Рис. 47.
Модель молекулы метанала:
1 — шаростержневал; 2 — масштабная
Раствор формальдегида в воде называют формалином, его используют для хранения биопрепаратов, протравливания семян перед посевом, дубления кож.
Уксусный альдегид (этаналь, ацетальдегид)

(рис. 48) — летучая жидкость, хорошо растворимая в воде, с характерным запахом. Основное количество получаемого в промышленности ацетальдегида используют для производства уксусной кислоты, а также различных пластмасс и ацетатного волокна. Уксусный альдегид ядовит!

Рис. 48.
Модель молекулы уксусного альдегида <этанала):
1 — шаростержневая; 2 — масштабная
Химические свойства альдегидов обусловлены присутствием в молекуле альдегидной группы.
- реакция «серебряного зеркала» — с аммиачным раствором оксида серебра:

- реакция со свежеполученным осадком гидроксида меди (II) при нагревании — цвет содержимого пробирки изменяется на кирпично-красный из-за образовавшегося в результате ее оксида меди (I) (рис. 49):


Альдегиды восстанавливаются в соответствующие спирты — гидрируются:

Новые слова и понятия
- Альдегиды и кетоны.
- Ацетон.
- Получение альдегидов: окисление спиртов.
- Формальдегид.
- Уксусный альдегид.
- Химические свойства альдегидов: качественные реакции (реакция «серебряного зеркала» я взаимодействие с гидроксидом меди (II) при нагревании), гидрирование.
Вопросы и задания
- Какие вещества называют альдегидами, а какие — кетонами? Что общего между этими классами органических соединений?
- Являются ли альдегиды и кетоны межклассовыми изомерами? Аргументируйте свой вывод примерами.
- Охарактеризуйте получение, свойства и применение формальдегида. Ответ иллюстрируйте уравнениями соответствующих реакций.
- Охарактеризуйте получение, свойства и применение ацетальдегида. Ответ иллюстрируйте уравнениями соответствующих реакций.
- Как, по вашему мнению, образуются названия альдегидов и кетонов по международной номенклатуре?
- Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Источник: tepka.ru
Реакция серебряного зеркала формула с медью

Представьте себе запах свежеиспеченной булочки с ванилью… ммм! Вкуснотища!
Когда этот ароматизатор добавляют в выпечку, слюнки текут!
А знаете, что из себя представляет ванилин?
Структурная формула:

Вот эта группа в самом верху молекулы — -HС=O — карбонильная группа. Вещества, в составе которых присутствует такая группа, называются альдегидами, и зачастую, пахнут они очень приятно…
Альдегиды и кетоны
Альдегиды и кетоны относятся к карбонильным органическим соединениям.
Карбонильными соединениями называют органические вещества, в молекулах которых имеется группа >С=О (карбонил или оксогруппа).
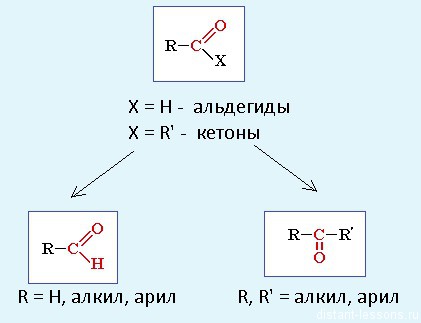
Номенклатура:
Альдегиды: называют радикал, затем окончание «аль»:
Нумерацию цепи начинают с карбонильного атома С:
Кетоны: название радикала, потом окончание «он»:
Изомерия альдегидов:

— изомерия углеродного скелета
— межклассовая изомерия (альдегиды кетоны)
— изомерия положения функциональной группы
Химические свойства:
Здесь все как всегда Есть химические реакции по радикалу R, есть реакции по функциональной группе. В данном курсе мы рассмотрим основные реакции по карбонильной группе
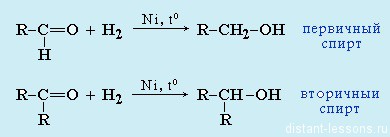
- Восстановление: альдегиды при восстановлении образуютпервичные спирты ,
кетоны — вторичные спирты.
- Окисление: альдегиды окисляются до карбоновых кислот — группа -СOH превращается а группу -COOHВсе реакции — качественные на карбонильную группу!

Реакция «серебряного зеркала»
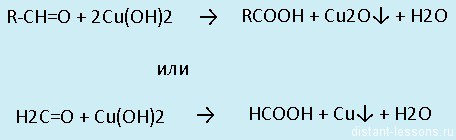
Реакция «медного зеркала»
Кетоны в такие реакции не вступают. У них идет «жесткое окисление» — разрыв связи С-С
Получение альдегидов и кетонов
- Из спиртов реакцией окисления: из первичных спиртов образуются альдегиды, из вторичных — кетоны
- Гидратация алкинов— реакция Кучерова. Обязательное условие — присутствие соли ртути (2+) в качестве катализатора:
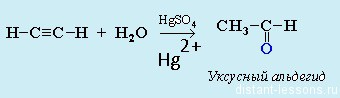
Чтобы получить кетон, надо просто взять любой другой гомолог ацетилена.
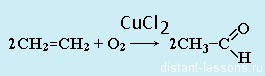
В самом начале лекции мы говорили про ваниль.
Почти все альдегиды и кетоны имеют интересные запахи:
(С6Н5)2С=О — бензофенон — запах герани;
СН3(СН2)7С(Н)=О — запах апельсина, цитрусовых;
С6Н5С(Н)=О — бензальдегид — запах горького миндаля;
В парфюмерии есть даже такой термин — «альдегидная нотка»!
Самыми известными цветочно-альдегидными ароматами считаются:
Arpege от Lanvin (1925)
Madame Rochas (1960)
Climat Lancome (1967)
Hermes Caleche (1961)
First Van Cleef https://ollimpia.ru/reaktsiya-serebryanogo-zerkala-formula-s-medyu/» target=»_blank»]ollimpia.ru[/mask_link]