Цели урока. На основании строения молекул альдегидов и кетонов спрогнозировать их химические свойства, которые затем рассмотреть в сравнении для обоих классов этих соединений.
Оборудование: йод кристаллический, иодид калия, ацетон; растворы аммиака, нитрата серебра, сульфата меди (II), гидроксида натрия, глюкозы; растворитель 645 или 646; спиртовка, пробирки.
I. Теоретический прогноз реакционной способности альдегидов и кетонов
В профильных классах это утверждение рассматривается глубже. В отличие от кратной углерод-углеродной связи в алкенах двойная связь углерод-кислород сильно полярна. Значительный положительный заряд на атоме углерода предполагает, что присоединяющийся реагент должен иметь нуклеофильный характер.
Следовательно, большинство реакций присоединения по карбонильной группе являются реакциями нуклеофильного присоединения. В профильном классе учитель объясняет механизм подобных реакций, приведенный в учебнике. Так присоединяются к альдегидам синильная кислота, гидросульфит натрия, металлорганические соединения (например, реактивы Гриньяра).
Качественные реакции на альдегиды
Нуклеофильное присоединение является первой стадией второго важнейшего типа реакций альдегидов и кетонов — конденсации. В результате реакций присоединения образуются продукты, содержащие гидроксильную группу. Если фрагмент нуклеофила Nu имеет подвижный атом водорода в a-положении к реакционному центру, возможно отщепление молекулы воды с образованием продукта конденсации. По такому пути протекает реакция двух молекул альдегида между собой (кротоновая конденсация).

Кроме того, молекула воды может отщепляться и межмолекулярно, в этом случае возможно образование продукта поликонденсации. Такой путь реализуется, например, при реакции формальдегида с фенолом.
Характерной особенностью альдегидов, отличающей их от кетонов, является легкое окисление. На этом свойстве основаны качественные реакции на альдегидную группу.
Переходить к детализации химических свойств изучаемых классов соединений удобно, имея на плакате или слайде соответствующую схему. Пример такой схемы приведен на рисунке 26.

Рис. 26. Химические свойства альдегидов
II. Химические свойства альдегидов и кетонов
Гидрирование. Присоединение водорода по кратной связи С=О происходит при нагревании в присутствии катализаторов гидрирования (никель, платина, палладий):

![]()
В результате образуются спирты соответствующего строения. Это реакция, обратная получению карбонильных соединений из спиртов. Внимательные учащиеся смогут ответить на вопрос: чем отличаются друг от друга спирты, полученные гидрированием альдегидов и кетонов? Из альдегидов можно получить только первичные спирты, гидрированием кетонов — только вторичные.
Опыты по химии. Окисление спирта в альдегид
Присоединение циановодорода. Альдегиды и кетоны присоединяют по карбонильной группе полярную молекулу синильной кислоты (циановодород). Присоединение идет в соответствии с распределением электронной плотности в реагентах:

Образующийся продукт реакции относится к классу циангидринов (нитрил оксикислоты) и содержит на один атом углерода больше, чем исходный альдегид. Такая реакция применяется для наращивания углеродной цепи в органических молекулах.
Присоединение гидросульфита натрия. Альдегиды в отличие от кетонов способны присоединять молекулу гидросульфита натрия. Эта важная реакция позволяет не только обнаружить альдегиды, но и выделить их из смеси с другими веществами. Образующиеся сульфопроизводные выпадают в осадок и очень легко разлагаются кислотами с образованием исходного альдегида:

Присоединение реактивов Гриньяра. В профильном классе невозможно не упомянуть об одной из выдающихся страниц препаративной органической химии — использовании в синтезах магнийорганических соединений. Начало XX в. в органической химии ознаменовалось выдающимся событием. В 1900 г. французский химик Франсуа Огюст Виктор Гриньяр сообщил о получении органических веществ, в которых содержался связанный с углеродом атом металла — магния:

Поскольку на атоме углерода, связанном с металлом, сосредоточен частичный отрицательный заряд (почему?), реактивы Гриньяра сразу же после их открытия стали использоваться как уникальные нуклеофильные реагенты для синтеза углеводородов, спиртов, кетонов, альдегидов, карбоновых кислот и их производных. Работы Гриньяра положили начало универсальным методам магнийорганического синтеза, открыли новый этап в развитии препаративной органической химии. На примере взаимодействия реактивов Гриньяра с карбонильными соединениями (см. учебник) учитель объясняет, как можно «сконструировать» молекулы первичных, вторичных или третичных спиртов заданного строения.
Наступило время демонстрационного эксперимента. Учитель уже объяснил, что в результате окисления альдегидов образуется новый класс веществ, называемый карбоновыми кислотами. В качестве окислителя можно использовать и кислород воздуха, и неорганические соли (перманганат калия), и даже такие специфические слабые окислители, как аммиачный раствор оксида серебра или гидроксид меди (И).
Для проведения реакции «серебряного зеркала» учителю потребуется чисто вымытая пробирка. В нее наливают 2-3 мл 1%-ного раствора нитрата серебра и небольшими порциями добавляют 10%-ный раствор аммиака до полного растворения образующегося вначале серого осадка оксида серебра. (При отсутствии в лаборатории нитрата серебра можно воспользоваться раствором измельченного аптечного ляписного карандаша в воде).
К полученному раствору комплексного соединения приливают 1-2 мл раствора альдегида. Поскольку, как правило, формалина в школьной лаборатории нет, можно использовать 2%-ный раствор глюкозы (в порошке или ампулах продается в аптеке). Следующий этап — самый ответственный.
Для получения ровного зеркального налета пробирку следует держать вертикально и вращать вокруг пламени горелки, нагревая не дно, а стенки. Избегать закипания жидкости! Если опыт получился, зеркальную пробирку можно сохранить для последующих демонстраций, высушив и залив ее парафином.
Для учащихся общеобразовательных классов окислитель в уравнении реакции можно изображать в виде оксида серебра Ag2О.
В профильном классе учитель знакомит ребят с «аммиачным раствором оксида серебра» более подробно. В 1881 г. немецкий химик Бернгард Толленс предложил использовать для обнаружения в растворе соединений с альдегидной группой комплексное соединение серебра. При добавлении к раствору нитрата серебра водного раствора аммиака происходит выпадение серо-черного осадка оксида, поскольку гидроксид серебра при обычных условиях не существует.

Оксид серебра растворяется в избытке аммиачнои воды, образуя комплексное соединение.
![]()
Полученный бесцветный раствор и получил название реактива Толленса.
Второй демонстрационный эксперимент проводится так. В пробирке получают осадок гидроксида меди (II), добавляя к раствору сульфата меди (П) немного гидроксида натрия. В ту же пробирку приливают 3-4 мл раствора альдегида (с глюкозой опыт также получается замечательно) и нагревают. Смесь приобретает сначала бурый оттенок, а затем отчетливо виден кирпично-красный мелкокристаллический осадок оксида меди (I).
Кетоны окисляются только в очень жестких условиях (нагревание с азотной или хромовой кислотами) с разрывом углерод-углеродных связей, ближайших к карбонильной группе.
Изучением свойств альдегидов занимался выдающийся русский химик и композитор, автор знаменитой «Богатырской симфонии» и всемирно известной оперы «Князь Игорь» Александр Порфирьевич Бородин. В 1872 г. он обнаружил, что при действии металлического натрия на альдегиды образуются не только продукты их диспропорционирования (спирт и карбоновая кислота), но также вещества с удвоенной по сравнению с альдегидом молекулярной массой. Детальное исследование необычного продукта привело ученого к выводу, что вещество содержит одновременно и альдегидную, и гидроксильную группы, то есть является альдегидоспиртом (альдолем). По химическому строению альдоль представлял собой продукт присоединения одной молекулы альдегида к другой:

Открытая Бородиным реакция получила название альдольной конденсации. Она протекает в щелочной среде и широко используется в промышленности для получения синтетического каучука, смол, лаков и душистых веществ.
Оказалось, что альдоли очень легко дегидратируются с образованием непредельных альдегидов с сопряженными С=С и С=О связями. По тривиальному названию продукта, получаемого при этом из уксусного альдегида (кротоновый альдегид), конденсацию такого типа назвали кротоновой:

Наиболее практическими значимыми реакциями конденсации альдегидов являются реакции поликонденсации, в частности с фенолом. Если в качестве альдегида использован формальдегид, образуется полимерный продукт — фенолоформальдегидная смола. Этот материал уже знаком ребятам по теме фенолы.

При избытке галогена замещению могут подвергаться все атомы водорода в a-положении к карбонильной группе. В 1831 г. Ю. Либих действием хлора на ацетальдегид впервые получил вещество, названное хлораль:

На основе хлораля получают некоторые средства борьбы с насекомыми (инсектициды), в том числе хлорофос, а также гербициды.
На том же свойстве основана качественная реакция на метилкетоны и ацетальдегид — йодоформная реакция или проба Люголя, с которой учащиеся познакомились на примере этилового спирта. Учитель может повторить ее, обнаружив ацетон в товарном растворителе. Преамбула эксперимента такова. Многие кетоны являются хорошими растворителями для лаков и красок.
Например, ацетон входит в состав таких выпускаемых промышленностью смесей, как «Растворитель 645» и «Растворитель 646». Содержание пропанона-2 (ацетона) в них можно обнаружить с помощью йодоформной реакции. В пробирку, содержащую 2 мл воды, добавляют 8-10 капель растворителя.
Полного растворения не наблюдается, поскольку в состав исследуемой жидкости входят нерастворимые в воде толуол и сложные эфиры. Затем в пробирку добавляют 1 мл 10%-ного раствора гидроксида натрия и 0,5-1 мл раствора реактива Люголя (его приготовление см. в теме «Спирты»). Если смесь окрашена, ее обесцвечивают добавлением раствора щелочи. Образуется желтый осадок (или помутнение) и ощущается резкий неприятный запах трийодметана (йодоформа).
![]()
Строго говоря, положительную реакцию может дать не только ацетон, но и этанол, содержащийся в этих растворителях, хотя об этом можно и умолчать. Если же учитель не хочет хитрить, опыт можно показать с чистым ацетоном.
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений. При необходимости укажите условия протекания реакций:

В трех пробирках без этикеток находятся растворы уксусного альдегида, этиленгликоля и ацетона. Как при помощи растворов сульфата меди (II) и гидроксида натрия узнать, где какое вещество?
Органическое вещество содержит 62,0% углерода, 27,6% кислорода и 10,4% водорода и легко восстанавливает аммиачный раствор оксида серебра. Определите структурную формулу вещества.
Какой объем формалина с массовой долей НСНО 40% (ρ = 1,1 г/мл) можно получить при окислении 200 мл 60%-ного раствора метилового спирта (ρ = 0,8 г/мл)?
При окислении 450 мл пропанола-2 (ρ = 0,80 г/мл) получили 300 г кетона. Найдите массовую долю выхода продукта реакции.
При окислении 4,3 г альдегида аммиачным раствором оксида серебра выделилось 10,8 г металла. Напишите формулы всех возможных изомеров и назовите их по международной номенклатуре.
Библиотека образовательных материалов для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы из сети Интернет, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
Источник: compendium.school
Химические свойства альдегидов

Альдегиды являются производными углеводородов, их главной характеристикой является наличие карбонильной группы в молекулах. Что такое альдегиды, и каковы их химические свойства?
Альдегиды. Характеристика
Альдегиды – кислородосодержащие производные углеводородов, содержащие карбонильную группу C=O. В альдегиде две валентности атома углерода карбонила заняты алкильным радикалом и атомом водорода.
Общая структурная формула альдегида выглядит следующим образом:
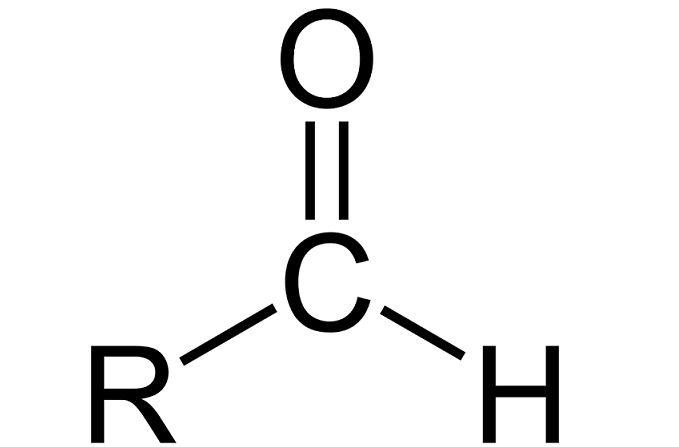
Альдегиды характеризуются изомерией углеводородного радикала. они могут иметь разветвленную или неразветвленную цепь. По международной номенклатуре названия альдегидов происходят от соответствующих углеводородов с прибавлением суффикса -аль, или от исторически сложившихся названий соответствующих карбоновых кислот, в которые они превращаются при окислении.
В альдегидах карбонильная группа всегда связана с атомом водорода. Также альдегидная группа обладает большой химической активностью.
Химические свойства альдегидов
Химические свойства альдегидов очень схожи с химическими свойствами кетонов. однако альдегиды способны проявлять большую активность, что связано с поляризацией связей.
Для карбонильных соединений характерны реакции присоединения, окисления и полимеризации подобно непредельным углеводородам. К реакциям с участием карбонильных групп относятся реакции присоединения, окисления и полимеризации:
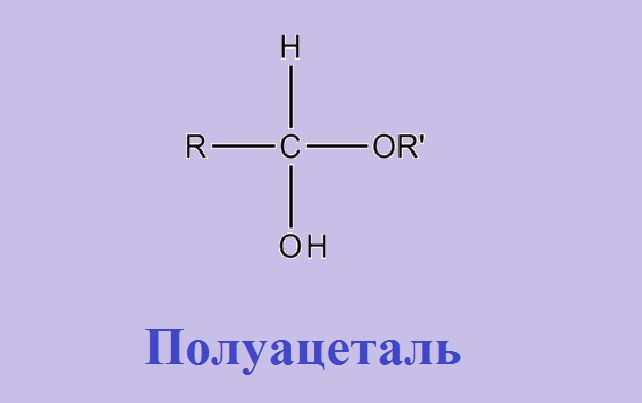
Реакция получения полуацеталей обратима, так как это не стойкие соединения

- окисление. Альдегиды очень легко окисляются, так как при окисленном атоме углерода есть атом водорода. Качественными реакциями на наличие альдегидной группы являются реакции «серебряного зеркала» (восстановление гидроксида диамино-серебра или, как часто упрощенно пишут, оксида серебра) и реакция восстановления свежеосажденного гидроксида меди (II) до образования красно-оранжевого осадка оксида меди (I).
- образование полимеров. Полимеры с участием альдегидов могут образовываться не только за счет полимеризации, но и посредством присоединения к альдегидной группе с последующей поликонденсацией образовавшегося мономера. Так, из формальдегида и фенола образуются фенолформальдегидные смолы, которые используют в качестве электроизоляционных лаков, клеев и пластмасс.
Что мы узнали?
Альдегиды – органические соединения, в состав которых входит альдегидная группа (-CHO). Эти вещества, химические свойства которых изучаются в 10 классе, могут взаимодействовать со спиртами, окисляться, а также способны образовывать полимеры.
Источник: obrazovaka.ru
АЛЬДЕГИДЫ И КЕТОНЫ
АЛЬДЕГИДЫ И КЕТОНЫ – органические соединения, содержащие фрагмент >C=O (углерод, связанный двойной связью с кислородом, его называют карбонильным). У альдегидов карбонильный углерод соединен с атомом Н и органической группой R (общая формула RHC=O), а в кетонах – с двумя органическими группами (общая формула R2С=О).
Также по теме:
ХИМИЯ ОРГАНИЧЕСКАЯ
Номенклатура альдегидов и кетонов. Группу –(Н)С=О называют альдегидной, для связывания с органическими группами у нее есть всего одна свободная валентность, это позволяет ей находится только на конце углеводородной цепи (но не в середине). При составлении названия альдегида указывается название соответствующего углеводорода, к которому добавляется суффикс «аль», например, метаналь Н2С=О, этаналь Н3СС(Н)=О, пропаналь Н3ССН2С(Н)=О. В более сложных случаях углеродную цепь группы R нумеруют, начиная с карбонильного углерода, затем с помощью числовых индексов указывают положение функциональных групп и различных заместителей.
Рис. 1. НОМЕНКЛАТУРА АЛЬДЕГИДОВ. Замещающие и функциональные группы, а также соответствующие им цифровые индексы выделены различающимися цветами.
Для некоторых альдегидов часто используют тривиальные (упрощенные) названия, сложившиеся исторически, например, формальдегид Н2С=О, ацетальдегид Н3СС(Н)=О, кротоновый альдегид СН3СН=CHC(H)=O.
В отличие от альдегидной, кетонная группа >C=O может находиться также в середине углеводородной цепи, поэтому в простых случаях указывают названия органических групп (упоминая их в порядке увеличения) и добавляют слово «кетон»: диметилкетон CH3–CO–CH3, метилэтилкетон CH3CH2–CO–CH3. В более сложных случаях положение кетонной группы в углеводородной цепи указывают цифровым индексом, добавляя суффикс «он». Нумерацию углеводородной цепи начинают с того конца, который находится ближе к кетонной группе (рис. 2).
Рис. 2. НОМЕНКЛАТУРА КЕТОНОВ. Замещающие и функциональные группы и соответствующие им цифровые индексы выделены различными цветами.
Для простейшего кетона CH3–CO–CH3 принято тривиальное название – ацетон.
Химические свойства альдегидов и кетонов
определяются особенностями карбонильной группы >C=O, обладающей полярностью – электронная плотность между атомами С и О распределена неравномерно, сдвинута к более электроотрицательному атому О. В результате карбонильная группа приобретает повышенную реакционную способность, что проявляется в разнообразных реакциях присоединения по двойной связи. Во всех случаях кетоны менее реакционноспособны, чем альдегиды, в частности, из-за пространственных затруднений, создаваемых двумя органическими группами R, наиболее легко участвует в реакциях формальдегид Н2С=О.
1. Присоединение по двойной связи С=О.
При взаимодействии со спиртами альдегиды образуют полуацетали – соединения, содержащие одновременно алкокси- и гидрокси-группу у одного атома углерода: >C(OH)OR. Полуацетали могут далее реагировать с еще одной молекулой спирта, образуя полные ацетали – соединения, где у одного атома углерода находятся одновременно две RО-группы: >C(OR)2. Реакцию катализируют кислоты и основания (рис. 3А). В случае кетонов присоединение спиртов к двойной связи в С=О затруднено.
Сходным образом альдегиды и кетоны реагируют с синильной кислотой HCN, образуя гидроксинитрилы – соединения, содержащие у одного атома углерода ОН- и CN-группу: >C(OH)C є N (рис. 3Б). Реакция примечательна тем, что позволяет увеличивать углеродную цепь (возникает новая связь С-С).
Точно так же (раскрывая двойную связь С=О) аммиак и амины реагируют с альдегидами и кетонами, продукты присоединения неустойчивы и конденсируются с выделением воды и образованием двойной связи C=N. В случае аммиака получаются имины (рис. 3В), а из аминов образуются так называемые основания Шиффа – соединения, содержащие фрагмент >C=NR (рис. 3Г).
Продукт взаимодействия формальдегида с аммиаком несколько иной – это результат циклизации трех промежуточных молекул, в результате получается каркасное соединение гексаметилентетрамин, используемое в медицине как препарат уротропин (рис. 3Д).
Конденсация альдегидов и кетонов с фенолами идет с удалением карбонильного атома О (в виде воды), а метиленовая группа СН2 или замещенная метиленовая группа (СНR либо СR2) встраивается между двумя молекулами фенола. Наиболее широко эту реакцию применяют для получения фенолоформальдегидных смол (рис. 5.).
Рис. 5. КОНДЕНСАЦИЯ ФЕНОЛА С ФОРМАЛЬДЕГИДОМ
3. Полимеризация карбонильных соединений протекает с раскрытием двойной связи С=О и свойственна, в основном, альдегидам. При упаривании в вакууме водных растворов формальдегида образуется смесь циклических соединений (в основном, триоксиметилен) и линейных продуктов с незначительной длиной цепи n = 8–12 (параформ). Полимеризацией циклического продукта получают полиформальдегид (рис. 6) – полимер с высокой прочностью и хорошими электроизоляционными свойствами, используемый как конструкционный материал в машино- и приборостроении.
Рис. 6. ПРОДУКТЫ ПОЛИМЕРИЗАЦИИ ФОРМАЛЬДЕГИДА
4. Восстановление и окисление. Альдегиды и кетоны представляют собой как бы промежуточные соединения между спиртами и карбоновыми кислотами: восстановление приводит к спиртам, а окисление –- к карбоновым кислотам. При действии Н2 (в присутствии катализатора Pt или Ni) либо других восстанавливающих реагентов, например, LiAlH4, альдегиды восстанавливаются, образуя первичные спирты, а кетоны – вторичные спирты (рис. 7, схемы А и Б).
Окисление альдегидов до карбоновых кислот проходит достаточно легко в присутствии О2 или при действии слабых окислителей, таких как аммиачный раствор гидроксида серебра (рис. 7В). Эта эффектная реакция сопровождается образованием серебряного зеркала на внутренней поверхности реакционного прибора (чаще, обычной пробирки), ее используют для качественного обнаружения альдегидной группы. В отличие от альдегидов, кетоны более устойчивы к окислению, при их нагревании в присутствии сильных окислителей, например, КМnО4, образуются смеси карбоновых кислот, имеющих укороченную (в сравнении с исходным кетоном) углеводородную цепь.
Рис. 7. ВОССТАНОВЛЕНИЕ И ОКИСЛЕНИЕ АЛЬДЕГИДОВ И КЕТОНОВ
Дополнительным подтверждением того, что альдегиды занимают промежуточное положение между спиртами и кислотами, служит реакция, в результате которой из двух молекул альдегида получаются спирт и карбоновая кислота (рис. 8А), т.е. одна молекула альдегида окисляется, а другая восстанавливается. В некоторых случаях два полученных соединения – спирт и карбоновая кислота – далее реагируют между собой, образуя сложный эфир (рис.8Б).
Рис. 8. ПРОТЕКАЮЩЕЕ ОДНОВРЕМЕННО ОКИСЛЕНИЕ И ВОССТАНОВЛЕНИЕ АЛЬДЕГИДОВ
Получение альдегидов и кетонов.
Наиболее универсальный способ – окисление спиртов, при этом из первичных спиртов образуются альдегиды, а из вторичных – кетоны (рис. 9А и Б). Это реакции, обратные реакциям на рис. 7А и Б. Реакция поворачивает «вспять», если изменен действующий реагент (окислитель вместо восстановителя) и катализатор, при окислении спиртов эффективен медный катализатор.
В промышленности ацетальдегид получают окислением этилена (рис. 9В), на промежуточной стадии образуется спирт, у которого ОН-группа «примыкает» к двойной связи (виниловый спирт), такие спирты неустойчивы и сразу изомеризуются в карбонильные соединения. Другой способ – каталитическая гидратация ацетилена (рис. 9Г), промежуточное соединение – виниловый спирт.
Если вместо ацетилена взять метилацетилен, то получится ацетон (рис. 9Д). Промышленный способ получения ацетона – окислением кумола. Ароматические кетоны, например, ацетофенон, получают каталитическим присоединением ацетильной группы к ароматическому ядру (рис. 9Е).
Применение альдегидов и кетонов.
Формальдегид Н2С=О (его водный раствор называют формалином) используют как дубитель кожи и консервант биологических препаратов.
Ацетон (СН3)2С=О – широко применяемый экстрагент и растворитель лаков и эмалей.
Ароматический кетон бензофенон (С6Н5)2С=О с запахом герани, используется в парфюмерных композициях и для ароматизации мыла.
Некоторые из альдегидов были сначала найдены в составе эфирных масел растений, а позже искусственно синтезированы.
Алифатический альдегид СН3(СН2)7С(Н)=О (тривиальное название – пеларгоновый альдегид) содержится в эфирных маслах цитрусовых растений, обладает запахом апельсина, его используют как пищевой ароматизатор.
Ароматический альдегид ванилин (рис. 10) содержится в плодах тропического растения ванили, сейчас чаще используется синтетический ванилин – широко известная ароматизирующая добавка в кондитерские изделия (рис. 10).
Рис. 10. ВАНИЛИН
Бензальдегид С6Н5С(Н)=О с запахом горького миндаля содержится в миндальном масле и в эфирном масле эвкалипта. Синтетический бензальдегид используется в пищевых ароматических эссенциях и в парфюмерных композициях.
Бензофенон (С6Н5)2С=О и его производные способны поглощать УФ-лучи, что определило их применение в кремах и лосьонах от загара, кроме того, некоторые производные бензофенона обладают противомикробной активностью и применяются в качестве консервантов. Бензофенон обладает приятным запахом герани, и потому его используют в парфюмерных композициях и для ароматизации мыла.
Способность альдегидов и кетонов участвовать в различных превращениях определила их основное применение в качестве исходных соединений для синтеза разнообразных органических веществ: спиртов, карбоновых кислот и их ангидридов, лекарственных препаратов (уротропин), полимерных продуктов (фенолоформальдегидные смолы, полиформальдегид), в производстве всевозможных душистых веществ (на основе бензальдегида) и красителей.
Источник: www.krugosvet.ru