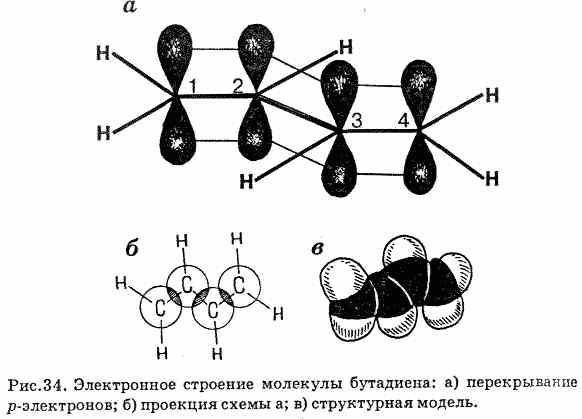
При избытке брома к молекуле бутадиена-1,3 может быть присоединена еще одна молекула его по месту образовавшейся двойной связи. Продуктом реакции в этом случае будет – 1,2,3,4-тетрабромбутан.
Таким образом, алкадиены также как и алкены способны обесцвечивать бромную воду.
2. Реакция полимеризации. Важной особенностью алкадиенов является большая легкость их к полимеризации. Эта реакция лежит в основе получения синтетических каучуков. Полимеризация сопряженных алкадиенов протекает как 1,4-присоединение.
синтетический бутадиеновый каучук
3. Реакция гидрирования: продуктами являются алкены.
4. Реакция гидрогалогенирования: в случае алкадиенов с сопряженными двойными связями возможно 1,4-присоединение или 1,2-присоединение.

2. С помощью каких химических превращений можно получить метан из:
Напишите уравнения соответствующих реакций.
Реакция серебряного зеркала
а) 2CH4 —> C2H2 + 3H2 C2H2 + H2 —> C2H4 C2H4 + H2O —> C2H5OH
б) СН4 + Сl2 = CH3Cl + HCl 2CH3Cl + 2Na = C2H6 + 2NaCl C2H6 + Br2 = C2H5Br + HBr C2H5Br + 2Na = C4H10 + 2NaBr
4. Для сжигания 30 л метана израсходовали 300 л воздуха. Рассчитайте объемную долю кислорода потребовавшегося для данной реакции?
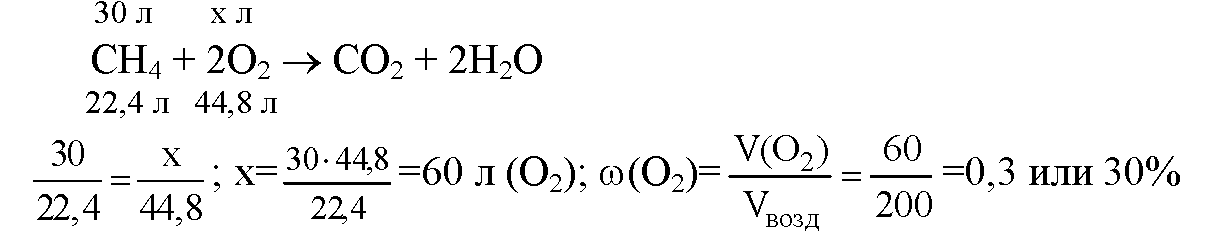
5. Приведите примеры реакций с участием предельных углеводородов, протекающих: а) с удлинением углеродной цепи; б) с уменьшением углеродной цепи (по 2 примера в каждом случае).
Увеличение углеродной цепи происходит при взаимодействии углеводорода с металлическим натрием 2CH3-CH2-Cl + 2Na —-> CH3-CH2-CH2-CH3 А вот с уменьшением немного сложнее.Тут можно рассматривать 2 вар-та: 1)Декарбоксилирование с образованием метана: CH3COONa + NaOH CH4 + Na2CO3 2)Простое замыкание углеводородов в цикл Cl-CH2-CH2-CH2-Cl + Zn —>
6. Как можно различить следующие соединения:
а) этанол и этаналь;
б) этан и этилен;
в) бутин-1 и бутин-2.
а) В лабораторных условиях эти два вещества можно различить с помощью качественных реакций. Качественная реакция на этаналь (точнее на альдегиды) — это реакция «серебряного зеркала» с гидроксидом меди III, в результате которой образуется металлическое серебро и выпадает на дно стакана в виде «зеркала» из серебряного осадка. Реакция на этанол (на одноатомные спирты) — это окисление спирта оксидом меди. Когда пары спирта пропускают над раскаленным оксидом меди, спирт окисляется до альдегида. Полученный альдегид улавливают фуксинсернистой кислотой и раствор становится фиолетовым.
Этаналь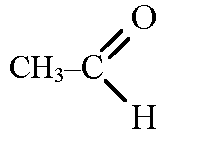 Этанол
Этанол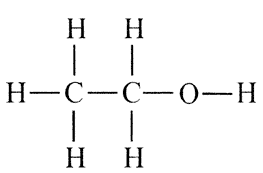
Б) Эти два органических вещества относятся к различным классам соединений: этан — к предельным углеводородам (алканам), а этилен — к непредельным, а именно к алкинам.
Реакция серебряного зеркала с глюкозой / The silver mirror reaction with gluccose
Этилен (С2Н4) — это изолог этана (С2Н6), то есть химический состав молекул этих веществ отличается всего на два атома водорода. На практике этан и этилен, как и любой другой насыщенный и ненасыщенный углеводород, можно отличить с помощью реакции с раствором перманганата калия. Этилен обесцветится при взаимодействии с марганцовкой, в то время как этан вовсе не вступит в реакцию.
Этилен 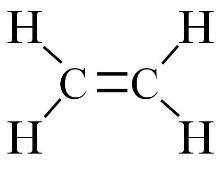 Этан
Этан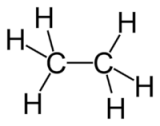
В) по реакции с нитратом серебра. в случае бутин-1 будет выпадать осадок CH3-CH2-C≡CAg в случае с бутином-2 такого происходить не будет, потому что не будет настолько «кислых» протонов.
Источник: studfile.net
Карбонильные соединения.
Органические соединения, в состав которых входит С=О группа, называют карбонильными соединениями. Они делятся на:
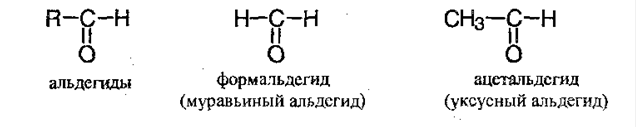

Углеводороды могут быть насыщенными и ненасыщенными, а также ароматическими.
Радикалы в кетоне могут быть различными и одинаковой длины, в таком случае они называются нессиметричными (смешанными) или симметричными.
Строение карбонильных соединений.
В связи С=О связь двойная, где углерод находится в sp 2 -гибридизации и образует 3 сильные связи, лежащие в плоскости под углом 120º.
С-О образована π-электронами при перекрывании негибридных орбиталей. В силу большей электроотрицательности электронная плотность смещена в сторону атома кислорода:
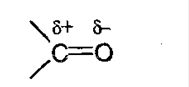
Изомерия карбонильных соединений.
Для карбонильных соединений свойственна изомерия углеродного скелета и положением карбонильной группы:

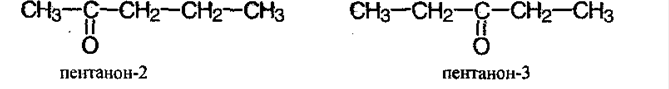
Как называть карбонильные соединения?
По правилам ИЮПАК альдегид называют путем прибавления суффикса –аль, а кетон – он. Тот атом углерода, который связан с С=О группой является при нумерации первым.
Физические свойства карбонильных соединений.
Низшие альдегиды и кетоны – легкокипящие жидкости с резким запахом и хорошо растворимы в воде. Формальдегид является газом. Т.к. в молекуле нет водородных связей, значит температуры кипения и плавления у карбонильных соединений значительно ниже, чем у соответствующих алкенов, спиртов.
Получение карбонильных соединений.
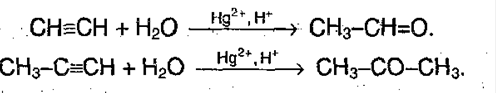
Способ очень дорогой и продукты реакции весьма токсичны (т.к. в реакции участвует ртуть), поэтому применяется данный метод нечасто.
2. Окисление спиртов. Окисление проводят перманганатом калия, дихроматом, а также оксидом меди (II):
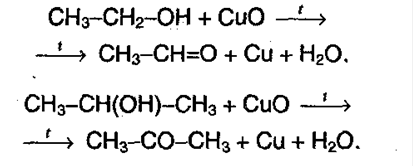
3. Щелочной гидролиз дигалогеналканов, в которых содержатся 2 атома галогена при одном атоме углерода. В результате образуется двухатомный спирт, который очень неустойчив и превращается в:
4. Дегидрирование спиртов. Этот метод имеет промышленное значение. В качестве катализаторов используют металлическую медь, серебро, хром, никель, оксид цинка:
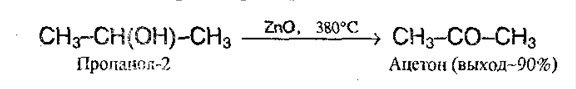
5. Окисление алкенов. Очень экономичный метод, используется в промышленных целях. Процесс проводят в присутствие хлоридов палладия (II) и меди (II):
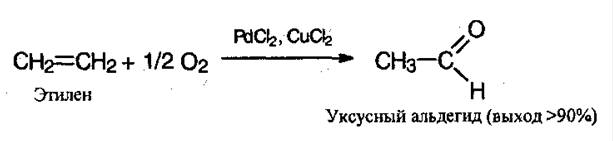
Химические свойства карбонильных соединений.
В состав альдегидов и кетонов входит карбонильная группа с полярной связью. Поэтому карбонильные соединения вступают в реакции нуклеофильного присоединения. Активность соединений определяется величиной частично положительного заряда на атоме углерода. Электронодонорные группы понижают это значение. Самый активный – формальшегид.
1) гидрирование. Из альдегидов получаются первичные спирты, из кетонов – вторичные:
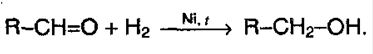
2) присоединение HCN (синильная кислота, циановодородная):
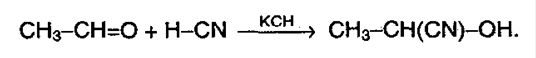
Эту реакцию используют для удлинения цепи.
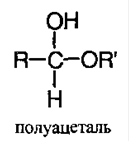
3) Реакция со спиртами с образование ацеталей и полуацеталей:
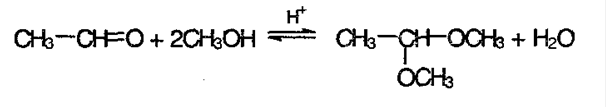
Полуацеталь – соединение, в котором у одного атома углерода содержится гидроксильная и алкоксильная группы:
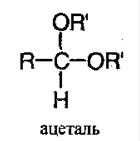
Ацеталь – соединение, в котором у атома углерода содержится 2 алкоксильные группы:
4) Реакция с гидросульфитом:
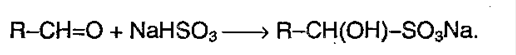
5) Реакция с реактивом Гриньяра – металлоорганическое соединение. С помощью его можно получить спирты, а также из альдегида можно получить кетон:
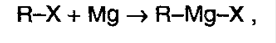
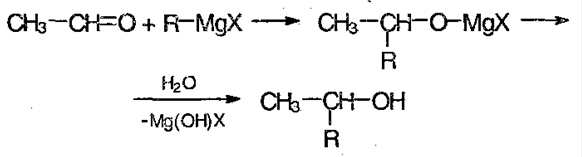
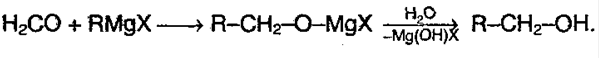
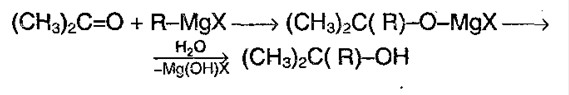
6) Присоединение воды – гидратация:
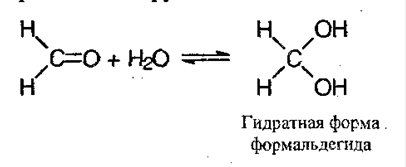
Альдегиды при окислении легко образуют соответствующие карбоновые кислоты. В качестве окислителей можно использовать перманганат калия, гидроксиды серебра и меди. Кетоны более инертны по отношению к окислителям, они вступают в реакцию только с сильными окислителями, в результате которых связь С-С рвется.
Реакция серебряного зеркала – это взаимодействие с аммиачным раствором серебра или оксидом серебра или гидроксидом меди. Эти реакции являются качественными на карбонильные соединения:

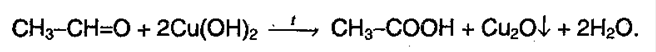
В упрощенном виде:

Применение карбонильных соединений.
Формальдегид используют для получения полимерных материалов. В водном растворе формальдегида хранят анатомические препараты. Ацетон используют в качестве растворителя в лакокрасочной промышленности.
Источник: www.calc.ru
Качественные реакции


Такой раздел науки, как аналитическая химия, изучает состав и структуру химических веществ. Он применяется для исследования неизвестного соединения или смеси. Качественный анализ позволяет определить присутствие или отсутствие элементов или радикалов в химическом соединении, а количественный анализ включает в себя определение содержания химического вещества в анализируемом образце, то есть количество составляющих смесь компонентов. Для качественного анализа используют характерные для определенных элементов химические реакции, которые легко выполнить. Качественные реакции позволяют наблюдать ожидаемые эффекты или отсутствие их.
Аналитическая химия занимается разработкой новых и совершенствованием существующих методов анализа, их практическим применением, а также изучением теоретических основ аналитических процессов. Специалисты в этой области владеют химическими, физическими и физико-химическими методами анализа. В основе многих из них лежат качественные реакции, которые используются для обнаружения радикалов и элементов, а также соединений, входящих в состав исследуемых образцов. Для изучения качественного и количественного состава применяются:
Для установления качественного состава многих продуктов питания используется ксантопротеиновая.
- элементарный анализ (определяется элементный состав);
- молекулярный анализ (устанавливается строение химических соединений на молекулярном уровне);
- структурный анализ (один из видов молекулярного анализа, исследует пространственное строение атомов и молекул, их молекулярные массы и эмпирические формулы);
- функциональный анализ (органические соединения изучаются по функциональным группам).
Таким образом, могут распознаваться как неорганические, так и органические соединения. В присутствии конкретных элементов может появляться или исчезать окраска, выделяться или растворяться осадок, наблюдаться выделение пузырьков газа и прочее. Если качественные реакции подобраны правильно, то есть селективны (избирательны) по отношению к конкретному катиону или аниону, а также высокочувствительны (то есть порог обнаружения позволяет устанавливать малые количества), то итогом будет достоверный результат — заключение о присутствии или отсутствии в образце элемента или вещества. В основе такого анализа водных растворов лежат известные ионные качественные реакции.
Натрий — один из щелочных металлов. Таблица химических элементов показывает его как атом.
Для неорганических соединений они часто протекают в водных растворах, но в случае с катионами щелочных металлов обнаружение проводят при внесении сухих солей в среднюю (самую горячую) часть пламени спиртовки. Катионы лития (Li+) окрасят пламя в темно-розовый цвет. Катионы калия (K+) — в фиолетовый, натрия (Na+) — в желтый, рубидия (Rb+) — в красный, цезия (Cs+) — в голубой.
Качественные реакции на катионы можно проводить для солей бария: присутствие катионов бария (Ba2+) устанавливается добавлением реактива с сульфат-ионами (SO42-), так как образовавшийся сульфат бария выпадет в осадок белого цвета, который не растворяется в кислотах: Ba2+ + SO42- → BaSO4↓. Присутствие катионов свинца (Pb2+)обнаруживаются при воздействии на водный раствор соли сульфидом (S2-), в результате образовывается сульфид свинца, который выпадает в виде осадка черного цвета: Pb2+ + S2- → PbS↓. Таких известных качественных реакций, как на катионы, так и на анионы очень много, и они описаны в аналитической химии.
Рассмотрим некоторые характеристики разных классов углеводородов. Выявим качественные реакции на.
Выбирая качественные реакции для тестирования образца, полезно знать общие правила растворимости химических соединений:
- Все нитраты являются растворимыми.
- Практически все соли калия, натрия и аммония растворимы.
- Все хлориды, бромиды и йодиды растворимы, за исключением галогенидов серебра, ртути (I) и свинца (II).
- Все сульфаты растворимы, за исключением сульфатов бария, стронция и свинца (II), которые являются нерастворимыми, и сульфатов кальция и серебра, которые являются умеренно растворимыми.
- Все карбонаты, сульфиты и фосфаты не растворяются за исключением карбонатов, сульфитов и фосфатов калия, натрия и аммония.
- Все сульфиды нерастворимы, за исключением сульфидов щелочных металлов, щелочноземельных металлов и аммония.
- Все гидроксиды нерастворимы за исключением гидроксидов щелочных металлов. Гидроокиси стронция, кальция и бария умеренно растворимы.
Такие органические вещества, как алканы (предельные углеводороды) или алкены (непредельные углеводороды) можно обнаружить при помощи раствора перманганаты калия, который в первом случае не изменит свою окраску, так как парафиновые углеводороды с перманганатом на холоде не реагируют. Во втором случае раствор обесцветится из-за протекания реакции Вагнера (например, с этиленом): 2KMnO4 + 3C2H4 + 4H2O -→ 2KOH + 3CH2OH-CH2OH + 2MnO2↓.
В результате выпадает осадок двуокиси марганца, имеющий бурый цвет. Белки являются сложными органическими соединениями, которые обеспечивают жизнедеятельность любого живого организма. Их огромное множество, определение их имеет огромное практическое значение. Для этих целей используются качественные реакции на белки, они делятся на цветные и именные. С их помощью определяются не сами белки, а аминокислоты, входящие в их состав.
Источник: autogear.ru