Алканы не окисляются перманганатом калия при нормальных условиях, вследствие этого раствор не обесцвечивается.
2) Качественная реакция на алкены.
При взаимодействии алкена с водным раствором перманганата калия при комнатной температуре происходит обесцвечивание раствора (реакция Вагнера):
Качественная реакция на непредельные углеводороды, в том числе и на алкены. Реакция может идти и в гетерогенной системе между газообразным или жидким алкеном и водным раствором брома (бромной водой), при этом бромная вода, имеющая желтую окраску, обесцвечивается.
3) Качественная реакция на алкины.
Алкины, так же как и алкены обесцвечивают раствор перманганата калия и бромную воду:
3CH ≡ CH + 8KMnO4 → 3KOOC − COOK + 8MnO2↓ + 2KOH + 2H2O
Алкины с тройной связью у крайнего атома углерода, реагируют с аммиачным раствором оксида серебра Ag[(NH3)2]OH или с аммиачным раствором хлорида меди (I) Cu[(NH3)2]Cl
Алкины у которых тройная связь в середине (R – С ≡ С – R) в эту реакцию не вступают. Такая способность алкинов – замещать атом водорода на атом металла, подобно кислотам – обусловлена тем, что атом углерода находится в состоянии sp -гибридизации и электроотрицательность атома углерода в таком состоянии выше, чем в состоянии sp 3 , sp 2 — гибридизации. Вследствие этого атом углерода сильнее обогащается электронной плотностью, и протон водорода становится подвижным. Эти реакции позволяют отличить алкины с концевой тройной связью от алканов, алкенов и алкинов с тройной связью в середине углеродной цепи.
РЕАКЦИЯ СЕРЕБРЯНОГО ЗЕРКАЛА. КАЧЕСТВЕННАЯ РЕАКЦИЯ НА АЛЬДЕГИДЫ#shorts #chemistry #химия #эксперимент
4) Качественные реакции на спирты.
Спирты по количеству гидроксильных групп бывают одно-, многоатомными. Для одно- и многоатомных реакции качественные различны.
Качественные реакции на одноатомные спирты:
Окисление спирта оксидом меди (II). Для этого пары спирта пропускают над раскаленным оксидом меди.
Черный цвет проволоки меняется на красный. Появляется запах альдегида.
Качественная реакция на многоатомные спирты.
Качественной реакцией на многоатомные спирты, содержащие гидроксильные группы у соседних атомов углерода, является их взаимодействие со свежеосажденным гидроксидом меди (II). Ярко-синее окрашивание раствора в результате образования комплексного соединения свидетельствует о наличии многоатомных спиртов.
2 СН – ОН + Сu(OH)2 → СН – О O − CH + 2Н2О
5) Качественные реакции на фенол.
Качественной реакцией на фенол является его взаимодействие с раствором хлорида железа (III), в результате которого образуется интенсивно окрашенное комплексное соединение фиолетового цвета.
Взаимодействие фенола с бромной водой также является качественной реакцией на фенол. Образуется осадок желтоватого цвета при пропускании фенола в водный раствор брома − 2,4,6-трибромфенол:
6) Качественная реакция на альдегиды.
Качественная реакция предназначена для выявления соединений, содержащих альдегидную группу. Аммиачный раствор оксида серебра (реактив Толленса) окисляет альдегиды до соответствующих карбоновых кислот, которые в присутствии аммиака образуют аммонийные соли. Сам окислитель при этой реакции восстанавливается до металлического серебра. За тонкий серебряный налет на стенках пробирки, эта реакция получила название реакции «серебряного зеркала»:
Реакция серебряного зеркала Качетсвенная реакция на алтдегидную группу
Реакцией серебряного зеркала также можно выявить метановую (муравьиную) кислоту HCOOH. Муравьиная кислота — единственная из карбоновых кислот, содержащая одновременно альдегидную и карбоксильную группы:
В ходе реакции метановая кислота окисляется до угольной, которая разлагается на углекислый газ и воду:
Помимо реакции серебряного зеркала существует также реакция с гидроксидом меди (II). Для этого к свежеприготовленному гидроксиду меди (II) добавляют альдегид и нагревают смесь:
Выпадает оксид меди (I). Cu2O — осадок красного цвета.
При добавлении альдегида к раствору фуксинсернистой кислоты раствор окрашивается в светло-фиолетовый цвет.
7) Качественные реакции на карбоновые кислоты.
Качественные реакции на предельные одноосновные карбоновые кислоты:
1. Изменение цвета индикатора (лакмус на красный, метилоранжевый на красный, фенолфталеин остается бесцветным)
R–COOH ↔ R–COO – + H +
2. Сильные карбоновые кислоты вытесняют слабые кислоты из их солей. Выделяющийся углекислый газ, вызывает помутнение известковой воды:
Эта реакция позволяет отличить карбоновые кислоты от фенолов, также обладающих кислотными свойствами.
Качественная реакция на метановую кислоту HCOOH.
При добавлении концентрированной серной кислоты к раствору муравьиной кислоты образуется угарный газ и вода:
Угарный газ можно поджечь. Горит синим пламенем:
2CO + O2 2CO2
Качественная реакция на многоосновные кислоты:
Качественная реакция на щавелевую кислоту H2C2O4 (HOOC−COOH). При добавлении к раствору щавелевой кислоты раствор соли меди (II) выпадет осадок оксалата меди (II)
Щавелевая кислота так же, как и муравьиная, разлагается концентрированной серной кислотой:
Качественная реакция на непредельные кислоты:
Обесцвечивают бромную воду:
R− CH = CH − RCOOH + Br2 → R− CHBr – CHBr − RCOOH
Обесцвечивают раствор перманганата калия:
3R− CH = CH − RCOOH + 2KMnO4 + 4H2O → 3R− CH(OH) − CH(OH) − RCOOH +
8) Качественные реакции на амины.
На амины качественных реакций нет (за исключением анилина). Можно доказать наличие амина окрашиванием лакмуса в синий цвет. Если же амины нельзя выявить, то можно различить первичный амин, от вторичного путем взаимодействия с азотистой кислотой HNO2.
Для начала нужно ее приготовить, а затем добавить амин:
Первичные дают азот N2:
Вторичные — алкилнитрозоамины — вещества с резким запахом (на примере диметилнитрозоамина):
Третичные амины в мягких условиях с HNO2 не реагируют.
Анилин образует осадок при добавлении бромной воды:
Анилин также можно обнаружить по сиреневой окраске при добавлении хлорной извести.
9) Качественные реакции на углеводы.
Качественные реакции на глюкозу:
Глюкоза – альдегидоспирт. Как и все альдегиды, глюкоза вступает в реакцию «серебряного зеркала» c образованием аммонийной соли глюконовой кислоты.
Взаимодействие с гидроксидом меди (II) приводит к образованию алкоголята меди (характерное синее окрашивание). Реакцию проводят при комнатной температуре (реакция на многоатомные спирты).
При нагревании глюкоза окисляется до глюконовой кислоты (реакция на альдегидную группу)
Качественная реакция на крахмал:
Крахмал в присутствии иода окрашивается в темно-синий цвет. При нагревании окраска исчезает, при охлаждении появляется вновь.
10) Качественная реакция на белки.
Белки выявляются в основном на реакциях, основанных на окрасках.
Ксантопротеиновая реакция. При действии на белки концентрированной азотной кислотой образуется желтая окраска, связанная с нитрованием ароматических колец в соответствующих аминокислотах (на примере тирозина):
Обнаружение серосодержащих аминокислот:
Белок + (CH3COO)2Pb —NaOH →PbS↓ (осадок черного цвета).
Биуретовая реакция для обнаружения пептидной связи (CO-NH)
Белок + CuSO4 + NaOH → фиолетовое окрашивание.
Источник: mydocx.ru
Качественные реакции карбонильных соединений.
Качественные реакции карбонильных соединений многочисленны и разнообразны, что объясняется склонностью карбонильных соединений вступать в различные реакции замещения и присоединения. Альдегиды и кетоны ведут себя в этих реакциях почти одинаково. В некоторых случаях существует, однако, различие в скорости протекания реакций, чем и пользуются для того, чтобы различить карбонильные соединения разных групп (например, альдегиды от кетонов, альдегиды жирного ряда от ароматических и т. д.). В качественном анализе используется также реакция окисления.
Реакция с 2,4-динитрофенилгидразином.Карбонильные соединения можно обнаружить по реакциям с фенилгидразином и замещенными фенилгидразинами. Лучшие результаты дают и наиболее часто применяются 2,4-динитрофенилгидразин, n-нитрофенилгидразин и n-карбоксифенилгидразин:
Образующиеся в этой реакции замещенные фенилгидразоны плохо растворимы в воде и поэтому обнаружение карбонильных соединений можно проводить в разбавленных водных растворах.
Реакция с солянокислым гидроксиламином.Соединения, содержащие карбонильную группу, при взаимодействии с солянокислым гидроксиламином выделяют свободную соляную кислоту:
Изменение pH среды можно обнаружить по изменению окраски индикатора, например метилового оранжевого.
Реакция с бисульфитом натрия.Альдегиды и алифатические метилкетоны реагируют с бисульфитом натрия с образованием хорошо кристаллизующихся бисульфитных соединений, которые являются натриевыми солями а -оксисульфокислот:
Реакция «серебрянного зеркала» (взаимодействие с [Ag(NH3)2]OH). Все альдегиды восстанавливают аммиачный раствор окиси серебра:
| R – C = O +2 [Ag(NH3)2]OH → R – C = O + 2Ag + H2O + 3NH3 | | H ONH4 |
Выделяющееся металлическое серебро оседает на стенках пробирки в виде зеркала. Эту реакцию могут также давать некоторые ароматические амины, многоатомные фенолы и дикетоны.
Реакция с реактивом Фелинга.Альдегиды жирного ряда восстанавливают двухвалентную медь в одновалентную. В качестве реактива, содержащего ионы двухвалентной меди, применяется реактив Фелинга. Реактив Фелинга готовят перед употреблением, смешивая два раствора: раствор CuSO4 и щелочной раствор сегнетовой соли (калиево-натриевой соли винной кислоты). При сливании растворов образуется гидроокись меди, которая с сегнетовой солью дает комплексное соединение типа гликолята меди:
Ароматические альдегиды эту реакцию не дают.
Реакция с фуксинсернистой кислотой.Альдегиды дают цветную реакцию с раствором фуксинсернистой кислоты (реактив Шиффа). Бесцветный реактив, приготовленный из фуксина действием сернистого ангидрида, в присутствии альдегидов приобретает фиолетово-пурпурную окраску. Образующиеся окрашенные соединения обесцвечиваются при добавлении избытка минеральной кислоты, за исключением более устойчивого производного формальдегида.
Некоторые кетоны и ненасыщенные соединения вызывают частичное восстановление первоначальной окраски фуксина. Поэтому возникновение слабой розовой окраски не считается положительной пробой. Некоторые ароматические альдегиды не дают положительной пробы.
Реакция с нитропруссидом натрия.В присутствии альдегидов и кетонов нитропруссид натрия — пентацианонитрозоферрат натрия Na2[Fe(CN)5NO] окрашивается в красно-фиолетовый цвет, причем наиболее яркую окраску дают кетоны. Ароматические карбонильные соединения, в которых карбонильная группа связана с незамещенным ароматическим ядром, не дают этой реакции.
Иодоформная проба.Эту реакцию дают метилкетоны и вещества, способные при окислении образовывать ацетильную группу (СН3С-О-):
Качественные реакции карбоновых кислот
В качественном и количественном анализе карбоновых кислот используют их кислотные свойства. Для получения производных важны реакции замещения водорода или гидроксила в группе -СООН.
Реакция на лакмус.Карбоновые кислоты дают отчетливую реакцию на лакмус. Влажная синяя лакмусовая бумажка окрашивается в красный цвет. Эта реакция достаточно чувствительна, так что даже для плохо растворимых в воде кислот получаются хорошие результаты. Применение универсальной индикаторной бумажки позволяет более точно определить изменение pH среды.
Следует иметь в виду, что кислую реакцию на лакмус могут показывать и другие органические соединения, не содержащие карбоксильной группы, сульфокислоты, тиофенолы, нитрофенолы, пиримидины и др.
Реакция с бикарбонатом натрия Na2CO3.Выделение двуокиси углерода при добавлении исследуемого вещества к водному раствору бикарбоната натрия может являться доказательством наличия карбоксильной группы. В этом случае, кроме карбоновых кислот, только сульфокислоты, ди- и тринитрофенолы, барбитуровая кислота и некоторые другие оксипиримидины дают положительную реакцию.
Образование солей.Для обнаружения карбоновых кислот можно воспользоваться образованием серебряных, свинцовых, а иногда и бариевых солей, плохо растворимых в воде. Эти соли выпадают в осадок при добавлении к водным или спиртовым растворам натриевых солей карбоновых кислот растворов нитратов серебра или свинца, или хлорида бария. Если реакция проводится в спирте, то пробу можно разбавить водой для растворения выпадающих наряду с солями органических кислот минеральных солей.
Дата добавления: 2018-05-13 ; просмотров: 3959 ; Мы поможем в написании вашей работы!
Поделиться с друзьями:
Источник: studopedia.net
Карбонильные соединения.
Органические соединения, в состав которых входит С=О группа, называют карбонильными соединениями. Они делятся на:
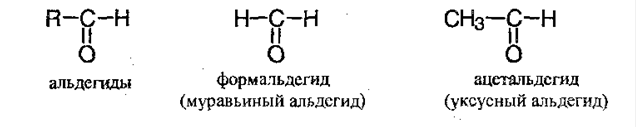

Углеводороды могут быть насыщенными и ненасыщенными, а также ароматическими.
Радикалы в кетоне могут быть различными и одинаковой длины, в таком случае они называются нессиметричными (смешанными) или симметричными.
Строение карбонильных соединений.
В связи С=О связь двойная, где углерод находится в sp 2 -гибридизации и образует 3 сильные связи, лежащие в плоскости под углом 120º.
С-О образована π-электронами при перекрывании негибридных орбиталей. В силу большей электроотрицательности электронная плотность смещена в сторону атома кислорода:
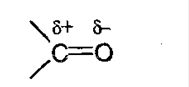
Изомерия карбонильных соединений.
Для карбонильных соединений свойственна изомерия углеродного скелета и положением карбонильной группы:

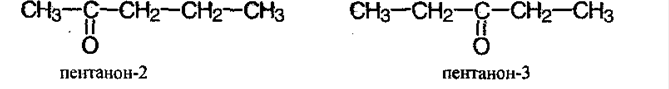
Как называть карбонильные соединения?
По правилам ИЮПАК альдегид называют путем прибавления суффикса –аль, а кетон – он. Тот атом углерода, который связан с С=О группой является при нумерации первым.
Физические свойства карбонильных соединений.
Низшие альдегиды и кетоны – легкокипящие жидкости с резким запахом и хорошо растворимы в воде. Формальдегид является газом. Т.к. в молекуле нет водородных связей, значит температуры кипения и плавления у карбонильных соединений значительно ниже, чем у соответствующих алкенов, спиртов.
Получение карбонильных соединений.
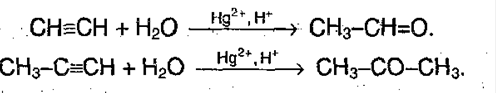
Способ очень дорогой и продукты реакции весьма токсичны (т.к. в реакции участвует ртуть), поэтому применяется данный метод нечасто.
2. Окисление спиртов. Окисление проводят перманганатом калия, дихроматом, а также оксидом меди (II):
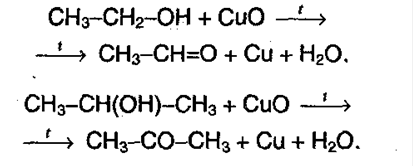
3. Щелочной гидролиз дигалогеналканов, в которых содержатся 2 атома галогена при одном атоме углерода. В результате образуется двухатомный спирт, который очень неустойчив и превращается в:
4. Дегидрирование спиртов. Этот метод имеет промышленное значение. В качестве катализаторов используют металлическую медь, серебро, хром, никель, оксид цинка:
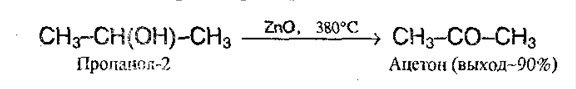
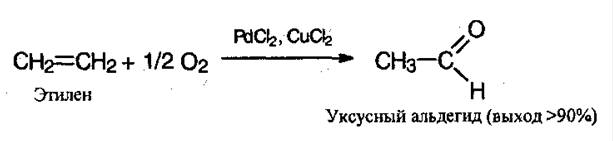
5. Окисление алкенов. Очень экономичный метод, используется в промышленных целях. Процесс проводят в присутствие хлоридов палладия (II) и меди (II):
Химические свойства карбонильных соединений.
В состав альдегидов и кетонов входит карбонильная группа с полярной связью. Поэтому карбонильные соединения вступают в реакции нуклеофильного присоединения. Активность соединений определяется величиной частично положительного заряда на атоме углерода. Электронодонорные группы понижают это значение. Самый активный – формальшегид.
1) гидрирование. Из альдегидов получаются первичные спирты, из кетонов – вторичные:
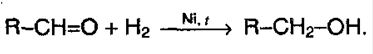
2) присоединение HCN (синильная кислота, циановодородная):
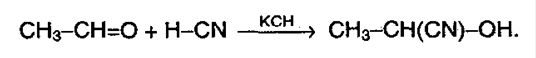
Эту реакцию используют для удлинения цепи.
3) Реакция со спиртами с образование ацеталей и полуацеталей:
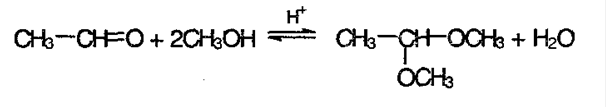
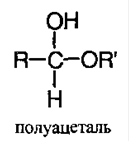
Полуацеталь – соединение, в котором у одного атома углерода содержится гидроксильная и алкоксильная группы:
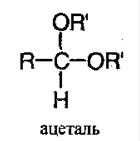
Ацеталь – соединение, в котором у атома углерода содержится 2 алкоксильные группы:
4) Реакция с гидросульфитом:
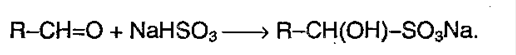
5) Реакция с реактивом Гриньяра – металлоорганическое соединение. С помощью его можно получить спирты, а также из альдегида можно получить кетон:
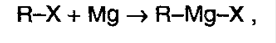
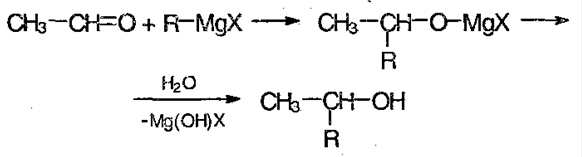
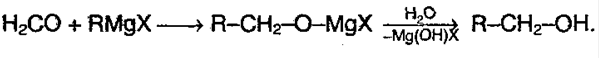
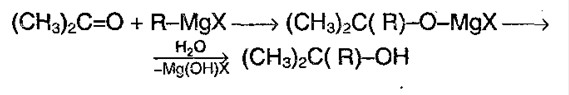
6) Присоединение воды – гидратация:
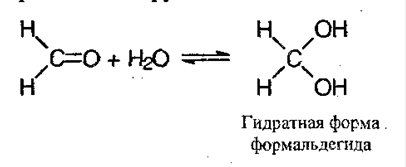
Альдегиды при окислении легко образуют соответствующие карбоновые кислоты. В качестве окислителей можно использовать перманганат калия, гидроксиды серебра и меди. Кетоны более инертны по отношению к окислителям, они вступают в реакцию только с сильными окислителями, в результате которых связь С-С рвется.
Реакция серебряного зеркала – это взаимодействие с аммиачным раствором серебра или оксидом серебра или гидроксидом меди. Эти реакции являются качественными на карбонильные соединения:

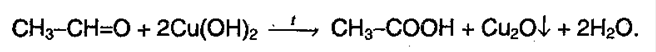
В упрощенном виде:

Применение карбонильных соединений.
Формальдегид используют для получения полимерных материалов. В водном растворе формальдегида хранят анатомические препараты. Ацетон используют в качестве растворителя в лакокрасочной промышленности.
Источник: www.calc.ru