Цель: исследовать химические свойства альдегидов и осуществить качественные реакции на карбонильные соединения.
Опыт 1. Цветная реакция на альдегиды с фуксинсернистой кислотой
Реактивы и материалы: формальдегид, 40%-ный водный раствор; этаналь; фуксинсернистая кислота.
В две пробирки помещают по 2 капли раствора фуксинсернистой кислоты и добавляют в одну из них 2 капли раствора формальдегида, в другую – 2 капли этаналя. Раствор фуксинсернистой кислоты при добавлении раствора формальдегида постепенно окрашивается в фиолетовый цвет, при добавлении этаналя — в розово-фиолетовый цвет.
Опыт 2. Самоокисление водных растворов формальдегида
Реактивы и материалы: формальдегид, 40%-ный водный раствор, метиловый красный, раствор.
В пробирку помещают 2—3 капли раствора формальдегида и добавляют 1 каплю индикатора метилового красного. Раствор принимает красную окраску, что указывает на кислую реакцию.
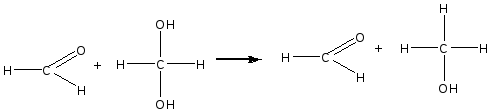
Альдегиды очень легко окисляются. В водных растворах они могут окисляться до кислоты за счет кислорода другой молекулы альдегида, восстанавливая ее в спирт — происходит реакция окислительного восстановления (дисмутации):
Альдегиды | Органическая химия ЕГЭ, ЦТ
Сформулируйте вывод по работе.
Опыт 3. Окисление альдегидов аммиачным раствором оксида серебра (реакция «серебряного зеркала»)
Реактивы и материалы: формальдегид, 40%-ный водный раствор; аммиак, 2 н. раствор; нитрат серебра, 0,2 н. раствор.
В чистую пробирку вводят 2 капли раствора нитрата серебра и прибавляют каплю аммиака. Образующийся бурый осадок гидроксида серебра растворяют, добавляя избыток (1—2 капли) раствора аммиака. Затем прибавляют каплю раствора формальдегида и медленно подогревают содержимое пробирки над пламенем горелки. При осторожном нагревании содержимое пробирки буреет и на ее стенках может выделиться серебро в виде блестящего зеркального налета (комплексный ион металла восстанавливается до металлического серебра). Альдегид окисляется до кислоты, которая образует аммониевую соль. Химизм процесса:

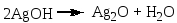
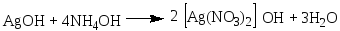
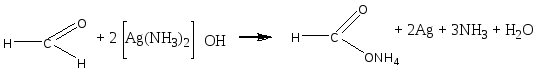
Сформулируйте вывод по работе.
Опыт 4. Окисление альдегидов гидроксидом меди (II)
Реактивы и материалы: формальдегид, 40%-ный водный раствор; сульфат меди CuSO4, 0,2 н. раствор; едкий натр, 2 н. раствор.
В пробирку помещают 4 капли раствора едкого натра, разбавляют 4 каплями воды и добавляют 2 капли раствора сульфата меди (II). К выпавшему осадку гидроксида меди (II) прибавляют 1 каплю раствора формальдегида и взбалтывают содержимое пробирки. Нагревают над пламенем горелки до кипения только верхнюю часть раствора так, чтобы нижняя часть оставалась для контроля холодной. В нагретой части пробирки выделяется желтый осадок гидроксида меди (I) (СuОН), переходящий в красный оксид меди (I) (Сu2О), а иногда на стенках пробирки выделяется даже металлическая медь.
Все кислородсодержащие органические соединения за 45 | Химия ЕГЭ 2022 Умскул
Повторите этот опыт, заменив раствор формальдегида раствором этаналя.
Сформулируйте вывод по работе.
Опыт 5. Реакция бензальдегида с гидросульфитом натрия
Реактивы и оборудование: бензальдегид; гидросульфит натрия (насыщенный раствор; водяная баня.
В пробирку помещают 3 капли бензойного альдегида, добавляют 5 капель насыщенного раствора гидросульфита натрия и энергично встряхивают смесь. Образуются кристаллы гидросульфитного соединения.
Затем к смеси добавляют 6 капель воды и помещают пробирку в горячую водяную баню. Кристаллы быстр исчезают, в растворе появляются маслянистые капли ощущается характерный запах бензальдегида. Химизм процесса:
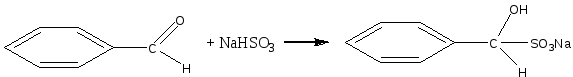
При нагревании в водном растворе гидросульфитное соединение легко разлагается на исходные вещества:
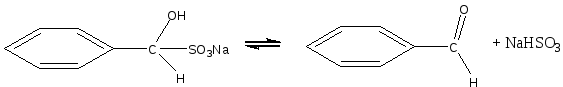
Сформулируйте вывод по работе.
Опыт 6. Свойства ализарина.
Реактивы и оборудование: ализарин; алюминиевые квасцы, насыщенный водный раствор; едкий нарт, 0,1 н. раствор; белая хлопчатобумажная ткань; фарфоровая чашка.
В пробирку помещают 3-5 капель ализарина, добавляют 6 капель щелочи и тщательно взбалтывают. Получается раствор, окрашенный в фиолетовый цвет.
1.В пробирку помещают 2 капли раствора ализарина и добавляют 3 капли раствора квасцов. Образуется оранжево-красный осадок алюминиевого ализаринового лака.
2.Кусочек белой ткани простирывают с мылом и тщательно прополаскивают в воде. В фарфоровую чашечку наливают раствор квасцов, пропитывают им ткань и отжимают.
В пробирку помещают 5 капель щелочного раствора ализарина, нагревают и в горячий раствор погружают кусочек «протравленной» ткани на 1—2 мин. Затем ткань, окрашенную в красный цвет, промывают водой.
Ализарин, или 1,2-диоксиантрахинон, образует оранжевые игольчатые кристаллы с т. пл. 290°С. Он нерастворим в воде и растворим в обычных органических растворителях. Растворяется он также в водном растворе едкого натра, причем раствор имеет пурпурную окраску.
Ализарин — протравной краситель. С алюминиевой протравой он дает ярко-красную окраску; с оловянной — фиолетово-красную; с железной — черно-фиолетовую. С ионами этих металлов ализарин образует хелатные соединения за счет групп С=О и группы ОН, находящейся в α-положении:
Источник: studfile.net
1)Реакцию серебряного зеркала дает: фенол; муравьиная кислота; глицерин; бензол 2)к наркотическим
веществам относят: этанол; пропанол; метанол; бутанол 3) масса циклогексана полученная в результате взаимодействия 7,8 г бензола с водородом равна(записать число с точностью до десятых) 4)Какой объем водорода выделится(н.у) при взаимодействии 0,1 этанола с избытком металлического натрия
Ответы на вопрос

Отвечает Шулегин Саша.
1) Муравьиная кислота.
2) Этанол.
3) 8,4 г.
4) 1,12 л.
Топ вопросов за вчера в категории Химия

Химия 29.03.2020 13:02 200 Шишкин Паша.

Химия 23.05.2020 08:08 161 Сапожникова Валентина.
Источник: uznavalka.pro
Спирты и фенолы. Альдегиды и кетоны
1 (2 балла). Общая формула предельных одноатомных спиртов:
2 (2 балла). Название вещества, формула которого
А. Бутаналь. Б. Бутанол-2. В. Бутанол-3. Г. 3-Метилпропанол-1.
3 (2 балла). Вид изомерии, характерный для предельных одноатомных спиртов:
A. Зеркальная. Б. Положения кратной связи.
B. Пространственная (стереоизомерия). Г. Межклассовая.
4 (2 балла). (2 балла). Продуктами окисления первичных одноатомных спиртов являются:
А. Альдегиды. Б. Кетоны. В. Простые эфиры. Г. Сложные эфиры.
5 (2 балла). В цепочке превращений
веществом X является:
А. 1-Хлорпропан. Б. 2-Хлорпропан. В. 1,2-Дихлорпропан. Г. Пропан.
6 (2 балла). Формула вещества с наиболее ярко выраженными кислотными свойствами:
7 (2 балла). Этанол не вступает в реакцию с веществом, формула которого:
A. Na. Б. НВг. В. NaOH. Г. СН3СООН.
8 (2 балла). Реактивом для распознавания этиленгликоля является:
А. Бромная вода. В. Гидроксид меди (II).
Б. Оксид меди (II). Г. Хлорид железа (III).
9 (2 балла). Вещество, из которого с помощью реакции нитрования А. Нобель изготовил динамит:
А. Глицерин. Б. Глицин. В. Фенол. Г. Этанол.
10 (2 балла). «Древесный спирт», впервые полученный путем сухой перегонки древесины, — это:
А. Бутанол. В. Пропанол.
Б. Метанол. Г. Этанол.
11 (2 балла). Число σ-связей в молекуле метаналя:
А. 2. Б. 3. В. 4. Г. 5.
12. (2 балла). Общая формула альдегидов:
ЧАСТЬ Б. Задания со свободным ответом
13 (8 баллов). Составьте уравнения реакций по приведенной ниже схеме и укажите условия их осуществления:
метан—-► ацетилен—-> бензол —-> хлорбензол—-► фенол.
14 (6 баллов). Для 2-метилбутанола-1 составьте структурные формулы одного изомера и одного гомолога. Назовите все вещества.
15 (4 балла). С какими из перечисленных веществ: гидроксид натрия, бромная вода, бензол — будет реагировать фенол? Составьте уравнения возможных реакций и назовите органические вещества.
16 (3 балла). Напишите уравнение качественной реакции на альдегиды. Укажите признак этой реакции.
17 (5 баллов). Рассчитайте объем водорода (н. у.), полученного при взаимодействии 1,5 моль метанола с металлическим натрием, взятом в достаточном количестве.
Спирты и фенолы. Альдегиды и кетоны.
Вариант 2 ЧАСТЬ А. Тестовые задания с выбором ответа
1 (2 балла). Многоатомным спиртом является:
А. Бутанол-2. Б. Глицерин В. Фенол. Г. Этанол.
2 (2 балла). Название вещества, формула которого
А. 2-Метилбутанол-З. В. З-Метилбутанол-2. Б. Пентанол-2. Г. Метилбутанол.
3 (2 балла). Вид гибридизации электронных орбиталей атома углерода, отмеченного звездочкой в веществе, формула которого СН3—С * Н2ОН:
A. sp 3 . Б. sp 2 . В. sp. Г. Не гибридизирован.
4 (2 балла). Продуктом реакции гидратации углеводорода, формула которого
A. 3-Метилпентанол-1. Б. 3-Метилпентанол-2. B. 3-Метилпентанол-3.
5 (2 балла). В цепочке превращений
веществом X является: А. Хлорэтан. Б. 1,1-Дихлорэтан. В. 2,2-Дихлорэтан. Г. Этаналь.
6 (2 балла). Продуктами восстановления альдегидов водородом (катализатор Pt) являются:
A. Кетоны. Б. Сложные эфиры. B. Карбоновые кислоты. Г. Одноатомные спирты.
7 (2 балла). Метанол взаимодействует с веществом, формула которого:
A. Zn. Б. НВr. В. КОН. Г. Вr2(водн).
8 (2 балла). В реакцию «серебряного зеркала» могут вступать:
А. Альдегиды. Б. Фенолы. В. Кетоны. Г. Одноатомные спирты.
9 (2 балла). Вещество, применяемое для производства антифризов:
А. Глицерин. Б. Метанол. В. Этанол. Г. Этиленгликоль.
10 (2 балла). Пикриновую кислоту (тринитрофенол) можно получить путем взаимодействия фенола с веществом, формула которого:
11. (2 балла). Растворитель ацетон относят к классу органических веществ:
А. Альдегиды. Б. Кетоны. В. Сложные эфиры. Г. Спирты.
12. (2 балла). Межклассовыми изомерами являются:
A. Многоатомные спирты и фенолы. Б. Одноатомные спирты и фенолы.
B. Одноатомные спирты и простые эфиры. Г. Карбоновые кислоты и альдегиды.
ЧАСТЬ Б. Задания со свободным ответом
13 (8 баллов). Составьте уравнения реакций по приведенной ниже схеме и укажите условия их осуществления:
этилен—-> хлорэтан—-► бутан—-> 2-хлорбутан—-► бутанол-2.
14. (6 баллов). Составьте структурные формулы одного изомера и одного гомолога для бутаналя. Назовите все вещества.
15. (3 балла). Напишите уравнение качественной реакции для предельных одноатомных спиртов, укажите признак этой реакции.
16 (5 баллов). Рассчитайте массу фенолята натрия, полученного при взаимодействии 0,5 моль фенола с достаточным количеством раствора гидроксида натрия.
17 (4 балла). С какими из перечисленных веществ: гидроксид натрия, бромоводород, кислород — будет реагировать метанол? Составьте уравнения возможных реакций и назовите органические вещества.
Спирты и фенолы. Альдегиды и кетоны.
Вариант 3 ЧАСТЬ А. Тестовые задания с выбором ответа
1 (2 балла). Формула вещества, относящегося к классу предельных многоатомных спиртов:
2 (2 балла). Название вещества, формула которого
А. Пентанол-2. Б. 1-Метилбутанол-3. В. Метилбутанол. Г. 4-Метилбутанол-2.
3 (2 балла). Вид изомерии, характерный для предельных многоатомных спиртов:
A. Положения функциональной группы. Б. Положения кратной связи.
B. Пространственная (стереоизомерия). Г. Межклассовая.
4 (2 балла). Вид гибридизации электронных орбита-лей атома углерода, отмеченного звездочкой в веществе, формула которого СН3—С * ОН:
A. sp 3 . Б. sp 2 . В. sp. Г. Не гибридизирован.
5 (2 балла). В цепочке превращений
веществом X является:
А. Этаналь. Б. Этановая кислота. В. Этен. Г. Этин.
6 (2 балла). С металлическим натрием наиболее активно реагирует:
А. Метанол. Б. Этанол. В. Пропанол-1. Г. Бутанол-1.
7 (2 балла). Фенол не вступает в реакцию с веществом, формула которого:
8 (2 балла). Реактивом для распознавания глицерина является:
А. Бромная вода. Б. Гидроксид меди (II). В. Оксид меди (II). Г. Хлорид железа (III).
9 (2 балла). Вещество, которое впервые применили в качестве антисептика при хирургических операциях:
А. Глицерин. Б. Метанол. В. Фенол. Г. Этанол.
10 (2 балла). Пищевой этиловый спирт получают:
A. Брожением глюкозы. Б. Гидратацией этилена.
B. Гидролизом бромэтана. Г. Гидролизом целлюлозы.
11. (2 балла). Число σ-связей в молекуле метанола:
А. 3. Б. 4. В. 5. Г. 6.
12. (2 балла). Продуктами окисления вторичных одноатомных спиртов являются:
А. Альдегиды. Б. Кетоны. В. Простые эфиры. Г. Сложные эфиры.
ЧАСТЬ Б. Задания со свободным ответом
13 (8 баллов). Составьте уравнения реакций по приведенной ниже схеме и укажите условия их осуществления:
этан—-> этен—-> этанол—-> бромэтан—-► бутан.
14 (6 баллов). Составьте структурные формулы одного изомера и одного гомолога для 2-метилпропаналя. Назовите все вещества.
15 (4 балла). С какими из перечисленных веществ: оксид меди (II), натрий, гидроксид натрия — будет реагировать этанол? Составьте уравнения возможных реакций и назовите органические вещества.
16. (5 баллов). Рассчитайте объем углекислого газа (н. у.), полученного при сгорании 160 г метанола.
17. (3 балла). Напишите уравнение качественной реакции на многоатомные спирты, укажите признак этой реакции.
Вариант 4 ЧАСТЬ А. Тестовые задания с выбором ответа
1 (2 балла). Формула вещества, относящегося к классу фенолов:
2 (2 балла). Название вещества, формула которого
A. 1,3-Диметилбутанол-2. Б. 2,4-Диметилбутанол-З.
B. 4-Метилпентанол-З. Г. 2-Метилпентанол-З.
3 (2 балла). Вид изомерии, характерный для предельных одноатомных спиртов:
А. Положения функциональной группы. Б. Положения кратной связи.
38В. Пространственная (стереоизомерия). Г. Зеркальная.
4 (2 балла). Продуктом реакции гидратации углеводорода, формула которого
I является: СН3
А. 2-Метилбутан. В. 2-Метилбутанол-З.
Б. 2-Метилбутанол-2. Г. З-Метилбутанол-2.
5 (2 балла). В цепочке превращений
веществом X является:
А. Хлорбензол. В. Гексан.
Б. Циклогексан. Г. Гексахлорциклогексан.
6 (2 балла). Вещество с наиболее ярко выраженными кислотными свойствами:
А. Вода. Б. Метанол. В. Пропанол-1. Г. Этанол.
7 (2 балла). Этиленгликоль не взаимодействует с веществом, формула которого:
8 (2 балла). Реактивом для распознавания предельных одноатомных спиртов является:
А. Бромная вода. В. Оксид меди (II). .
Б. Гидроксид меди (II). Г. Хлорид железа (III).
9 (2 балла). Вещество, выполняющее роль увлажнителя в косметических кремах:
А. Глицерин. В. Этанол.
Б. Фенол. Г. Этиленгликоль.
10 (2 балла). Из чего Ф. Рунге впервые получил фенол? А. Из бензола. В. Из нефти.
Б. Из каменного угля. Г. Из природного газа.
ЧАСТЬ Б. Задания со свободным ответом
11 (8 баллов). Составьте уравнения реакций по приведенной ниже схеме и укажите условия их осуществления:
ацетилен—-> бензол—-> бромбензол—->
—-► фенол—-► пикриновая кислота.
3912 (6 баллов). Для бутадиола-1,2 составьте структурные формулы одного изомера и одного гомолога. Назовите все вещества.
13 (4 балла). С какими из перечисленных веществ: азотная кислота, натрий, бромная вода — будет реагировать глицерин? Составьте уравнения возможных реакций и назовите органические вещества.
14 (6 баллов). Напишите уравнения реакций получения фенола из бензола, укажите условия их осуществления.
15 (6 баллов). Рассчитайте массу гидроксида натрия, необходимого для нейтрализации 0,25 моль фенола.
Карбонильные соединения
Вариант 1 ЧАСТЬ А. Тестовые задания с выбором ответа
12 (12 баллов). Напишите уравнения химических реакций по схеме, определив неизвестные вещества:
ЧАСТЬ Б. Задания со свободным ответом
11 (5 баллов). При полном сгорании 2 моль неизвестного альдегида получено 2 моль углекислого газа и 2 моль воды. Определите формулу альдегида. Ответ подтвердите, написав уравнение реакции.
12 (12 баллов). Напишите уравнения химических реакций по схеме, определив неизвестные вещества:
Б. CoHcCl. 1* -’25″’25*
10 (2 балла). Для хранения влажных биологических препаратов используют водный раствор:
A. Муравьиной кислоты. Б. Формальдегида.
B. Уксусной кислоты. Г. Этанола.
ЧАСТЬ Б. Задания со свободным ответом
12 (12 баллов). Напишите уравнения химических реакций по схеме, определив неизвестные вещества:
Укажите тип реакций, дайте названия исходных веществ и продуктов реакций.
13 (6 баллов). Составьте схему получения этанола из этана, над стрелками переходов укажите условия осуществления реакций и формулы необходимых для этого веществ.
Вариант 4 ЧАСТЬ А. Тестовые задания с выбором ответа
1 (2 балла). Общая формула кетонов: A. RCOH. В. RORg.
Б. RCOOH. Г. ROORg.
4 (2 балла). Вещество, в молекуле которого имеется л-связь:
А. Метанол. В. Этанол.
Б. Этаналь. Г. Этандиол-1,2.
6 (2 балла). Продуктами взаимодействия спиртов с карбоновыми кислотами являются:
А. Кетоны. В. Сложные эфиры.
Б. Простые эфиры. Г. Фенолы.
8 (2 балла). В реакцию этерификации могут вступать:
А. Альдегиды. В. Кетоны.
Б. Сложные эфиры. Г. Карбоновые кислоты.
9 (2 балла). Формула вещества X в цепочке превращений
ЧАСТЬ Б. Задания со свободным ответом
11 (5 баллов). При полном сгорании 1 моль предельного одноатомного спирта получено 44,8 л (н. у.) углекислого газа и 54 г воды. Определите формулу спирта.
12 (12 баллов). Напишите уравнения химических реакций по схеме, определив неизвестные вещества:
Укажите тип реакций, дайте названия исходных веществ и продуктов реакций.
Источник: geum.ru