Новые вопросы по химии
Что произойдёт с железом при взаимодействии с водой? 3 класс.
C8h18 формула глюкозы
1. Цинк растворили в концентрированной азотной кислоте. Полученный газ растворили в горячей воде. В ходе этого взаимодействия образовался бесцветный газ. Он легко окисляется кислородом воздуха до образования бурого газа.
Закончите формулы. H2+CuO= Na+HCl =
Что такое макроэлементы и ультромикроэлементы?
Главная » Химия » Какое из веществ не дает реакцию»серебряного зеркала». а) глюкоза б) сахароза в) муравьиная кислота г) формальдегид
Источник: urokam.net
ФОРМАЛЬДЕГИД (МЕТАНАЛЬ)

План изучения этого вещества целесообразно построить так, чтобы сразу после ознакомления с физическими свойствами альдегидов учащиеся изучили способы получения его, затем химические свойства и т.д. Несколько более раннее ознакомление со способами получения альдегида даст возможность далее, при изучении химических свойств (реакции окисления), рассматривать альдегиды как звено в цепи окисления углеводородов.
Органические реакции, в которых постоянно ошибаются | ЕГЭ ХИМИЯ 2022 | СОТКА
В качестве образца при ознакомлении со свойствами формальдегида можно пользоваться формалином. При этом следует сразу же добиться, чтобы учащиеся отчетливо понимали разницу между формалином и формальдегидом.
Запах формальдегида. Из физических свойств формальдегида наиболее доступно на практике ознакомление с запахом. Для этой цели на ученические столы раздаются пробирки с 0,5-1 мл формалина. После того как учащиеся ознакомятся с запахом, формалин может быть собран и использован для дальнейших опытов. Ознакомление с запахом формалина даст возможность учащимся обнаруживать это вещество в других опытах.
Горючесть формальдегида. Нагревают формалин в пробирке и поджигают выделяющиеся пары; они горят почти бесцветным пламенем. Пламя можно заметить, если в нем поджечь лучинку или бумажку. Опыт проводят в вытяжном шкафу.
Получение формальдегида. Так как до ознакомления с химическими свойствами формальдегид может быть обнаружен только по запаху, то первый опыт получения его следует поставить в виде лабораторной работы.
1. В пробирку наливают несколько капель метанола. В пламени горелки нагревают свернутый в трубочку небольшой кусочек медной сетки или спираль из медной проволоки и быстро опускают ее в метанол.
При прокаливании медь окисляется и покрывается черным налетом оксида меди, в спирте она снова восстанавливается и становится красной:
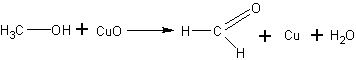
Обнаруживают резкий запах альдегида. Если процесс окисления повторить 2—3 раза, то можно получить значительную концентрацию формальдегида и раствор использовать для последующих опытов.
2. Кроме оксида меди для получения формальдегида могут быть использованы другие знакомые учащимся окислители.
К слабому раствору перманганата калия в демонстрационной пробирке добавляют 0,5 мл метанола и смесь нагревают до кипения. Появляется запах формальдегида, а фиолетовая окраска перманганата исчезает.
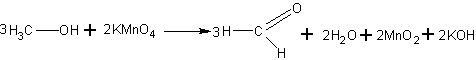
В пробирку наливают 2—3 мл насыщенного раствора бихромата калия К2Сг2О7 и такой же объем концентрированной серной кислоты. Добавляют по каплям метанол и очень осторожно подогревают смесь (отверстие пробирки направляют в сторону!). Далее реакция идет с выделением тепла. Желтая окраска хромовой смеси исчезает, и появляется зеленая окраска сульфата хрома
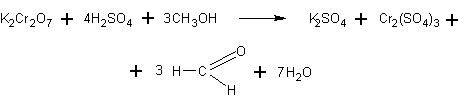
Уравнение реакции с учащимися можно не разбирать. Как и в предыдущем случае, им лишь сообщается, что бихромат калия окисляет метиловый спирт в альдегид, превращаясь при этом в соль трехвалентного хрома Cr2(SO4)3.
Взаимодействие формальдегида с оксидом серебра (реакция серебряного зеркала). Этот опыт должен быть продемонстрирован учащимся так, чтобы он одновременно явился и инструктажем к последующему практическому занятию.
Природа аммиачного раствора оксида серебра может быть подробно разъяснена учащимся, а можно лишь сообщить им, что образующийся при реакции гидроксид серебра — вещество непрочное и легко распадается на оксид серебра и воду:
Оксид серебра обладает свойством растворяться в аммиаке.
Окислительное действие оксида серебра объясняется тем, что это вещество является оксидом благородного металла, поэтому оксид неустойчив и при наличии восстановителя, т.е. вещества, легко окисляющегося, он легко отдает кислород, вследствие чего происходит выделение (восстановление) металлического серебра. Уравнение реакции можно дать в обычном виде:
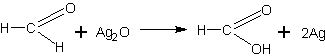
а можно представить полное уравнение реакции:
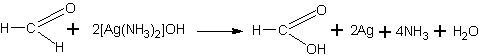
Серебряное зеркано образуется в том случае, если восстанавливающееся серебро осаждается на гладких стенках сосуда из не слишком концентрированных растворов. Малейшие загрязнения мешают восстанавливающемуся серебру «уцепиться» за стекло и заставляют его выделяться в виде рыхлого осадка. Значительно меньшее влияние на успех опыта оказывает характер нагревания. Если сосуд недостаточно чист, то даже самое осторожное нагревание не дает зеркала, и наоборот, если сосуд подготовлен тщательно, то даже нагревание смеси на открытом огне может дать желаемый результат.
Первый опыт получения серебряного зеркала следует провести в колбочке, а не в пробирке.
Колбу емкостью 50—100 мл до урока очищают от механических загрязнений, промывают ершиком с мыльной водой или нагревают в колбе раствор щелочи, затем споласкивают водой, промывают хромовой смесью и наконец начисто промывают дистиллированной водой.
В колбу наливают на четверть объема 2-процентный раствор нитрата серебра, затем добавляют постепенно раствор аммиака
(25-процентный аммиак следует разбавить в 8-10 раз) до тех пор, пока образующийся вначале осадок не растворится в его избытке. К образующемуся раствору добавляют осторожно по стенке 0,5-1 мл формалина и помещают колбу в стакан с горячей (лучше кипящей) водой. Вскоре в колбе образуется красивое серебряное зеркало.
Колбу можно нагревать без водяной бани, непосредственно на маленьком пламени, обнося пламя вокруг колбы и не встряхивая ее.
При демонстрации опыта вместо серебряного зеркала иногда образуется черный осадок. Учитель в таком случае обычно совершенно бракует опыт. Между тем при таком результате следует разъяснить учащимся, что здесь также произошло восстановление серебра только в виде рыхлого черного осадка.
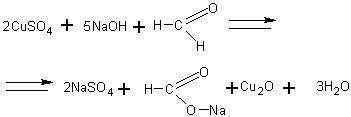
Окисление формальдегида гидроксидом меди ( II ). В пробирку наливают 2 мл 5-процентного раствора формальдегида, 2 мл 10-процентного раствора гидроксида натрия и при встряхивании добавляют по каплям 2-процентный раствор сульфата меди (11) до появления неисчезающей взвеси. Содержимое пробирки нагревают до начала кипения и наблюдают изменение окраски реакционной смеси а именно: голубая окраска меняется на желтую (осадок), а затем на красную (осадок). Эта реакция, как и реакция серебряного зеркала, является качественной реакцией на альдегиды. Суммарное уравнение этой реакции следующее:
Однако с учащимися целесообразно рассматривать этот процесс поэтапно:
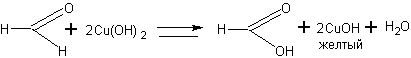
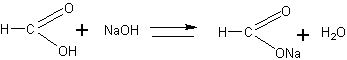
Обращают внимание учащихся на то, что реакция протекает в
щелочной среде, поэтому образуется не муравьиная кислота, а соль как продукт нейтрализации. Изменяющаяся цветовая гамма продуктов является результатом превращений соединений меди, связанных с изменением степени ее окисления.
Дезинфицирующее действие формальдегида. Дезинфицирующее действие формальдегида объясняется его свойством свертывать белок.
К нескольким миллилитрам формалина в пробирке добавляют 1 мл куриного белка. Белок свертывается.
Полимеризация и деполимеризация альдегида. Формальдегид, как это впервые показал А.М.Бутлеров, легко уплотняется.
В продаже существует твердый полимер формальдегида — параформальдегид (СН2О)n или параформ.
а) Параформ может быть легко деполимеризован.
В сухую пробирку помещают несколько крупинок параформа и нагревают. Вещество разлагается, образуя газообразный формальдегид, который частично улетает (запах!), а частично на холодных стенках пробирки снова образуется полимер. Опыт объясняет применение параформа для дезинфекции помещений.
б) Полимеризацию формальдегида можно наблюдать при выпаривании его раствора.
Выпаривают осторожно на водяной бане в фарфоровой чашке 4—5 мл формалина. Образуется твердый остаток. Остаток нагревают на голом огне. Происходит деполимеризация и улетучивание продукта (вытяжной шкаф). Убедившись в этом, прекращают нагревание.
Взаимодействие формальдегида с аммиаком. Нагревая формальдегид с аммиаком, А.М.Бутлеров получил уротропин, широко известное антисептическое средство.
В фарфоровой чашке на водяной бане выпаривают смесь равных объемов формалина и концентрированного раствора аммиака. По мере улетучивания жидкости остаются бесцветные кристаллы уротропина (гексаметилентетрамина (CH2)6N4)N.
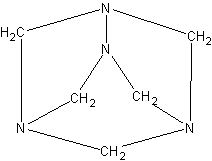
Знакомство учащихся со структурной формулой уротропина может быть лишь довольно поверхностным, так как класс аминов
еще не изучался. Однако структурная формула может быть ими осмыслена на основе знания валентности элементов.
С синтезированным или готовым уротропином можно выполнить следующие опыты. Нагревают уротропин в фарфоровой чашке, он улетучивается не плавясь. Раствор уротропина даст щелочную реакцию. При действии раствора щелочи уротропин разлагается, выделяющийся аммиак можно обнаружить обычными способами. При действии раствора серной кислоты на раствор уротропина (нагревание) также происходит разложение его, выделяющийся формальдегид может быть обнаружен по запаху.
Получение фенолформальдегидных смол. Основная масса получаемого в промышленности формальдегида идет на синтез фенолформальдегидных и других смол, необходимых для производства пластических масс. В основе получения фенолформальдегидных смол лежит реакция поликонденсации.
Наиболее доступен в школьных условиях синтез фенолформальдегидной смолы. Учащиеся к этому времени знакомы уже с обоими исходными веществами для получения смолы — фенолом и формальдегидом; опыт сравнительно несложен и идет безотказно; химизм процесса не представляет особой трудности для учащихся, если изобразить его следующим образом:
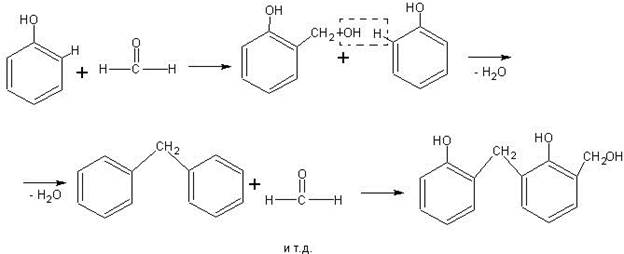
В зависимости от количественного соотношения фенола и формальдегида, а также от применяемого катализатора (кислотный или щелочной) может получаться новолачная или резольная смола. Первая из них термопластична и имеет линейную структуру, приведенную выше. Вторая — термореактивна, так как в ее линейных молекулах содержатся свободные спиртовые группы — СН2ОН, способные реагировать с подвижными водородными атомами других молекул, в результате чего образуется трехмерная структура.
В процессе классного изучения нет необходимости отдельно демонстрировать опыты получения новолачной и резольной смолы. Достаточно показать на одном опыте сам факт образования
высокомолекулярного соединения. В процессе внеклассных занятий можно получить смолы разного типа и даже формовать изделия из них. Опыты необходимо проводить под тягой вследствие летучести формальдегида.
а) Нагревают в пробирке на пламени спиртовки смесь 2,5 г кристаллического фенола и 5 мл формалина (40-процентного). Даже при кипении жидкости в ней не наблюдается химической реакции. Приливают к смеси 7-8 капель соляной кислоты (1 : 1). Вскоре происходит бурная реакция, и жидкость становится мутной. Охлаждают пробирку и дают смеси отстояться: внизу образуется смола, сверху — вода.
Сливают водный слой и выливают смолу на лист картона или жести. Застывшая смола имеет светло-желтую окраску. Опыт убедительно показывает роль соляной кислоты как катализатора реакции.
б) Не ставя целью показать роль катализатора, опыт можно провести проще. Нагревают в пробирке смесь указанных выше количеств фенола, формальдегида и кислоты, пока не начнется бурная реакция. После того как образуется муть, дают смеси расслоиться и далее поступают как в предыдущем случае.
в) Действие аммиака в качестве катализатора можно проследить на следующем опыте, который можно поставить и в несколько укрупненном масштабе.
В большую пробирку насыпают 4—5 г фенола, приливают 10 мл 40-процентного формалина и 1—2 мл концентрированного раствора аммиака. Смесь нагревают в течение нескольких минут в пламени горелки. После того как смесь вскипит (бурная реакция) и затем сделается мутной вследствие образования смолы, охлаждают пробирку и дают жидкости расслоиться.
Сливают верхний водный слой и демонстрируют в пробирке вязкую жидкость — фенолформальдегидную смолу. Затем смолу помещают в пробирке или в какой-нибудь формочке в сушильный шкаф, Через час-полтора (иногда раньше) смола превращается в твердую пластмассу. Так очень упрощенно может быть имитировано производство литых изделий из смолы.
г) Действие щелочного и кислотного катализатора на процесс поликонденсации можно показать одновременно. В две пробирки помешают по 2,5 г фенола и по 5 мл формалина. Затем в одну пробирку приливают 1 мл концентрированного раствора аммиака, а в другую — 7—8 капель соляной кислоты. Пробирки помешают в кипящую водяную баню. Через 5—10 мин в пробирках образуется смола.
Сливают после отстаивания верхний водный слой и затем выливают смолу на листы картона или жести.
д) В химическом кружке учащиеся могут получить фенолфор-
мальдегидную смолу в большем количестве и с более тщательным соблюдением режима.
В круглодонную колбу с обратным холодильником помещают 25 г фенола, 50 мл формалина и 3 мл 40-процентного раствора едкого натра. Осторожно нагревают смесь через асбестированную сетку. Нагрев регулируют так, чтобы жидкость не кипела слишком бурно.
По мере нагревания жидкость становится все более вязкой и примерно через час настолько густеет, что пузырьки газа с трудом вырываются на поверхность. Выливают жидкость в пробирку, При охлаждении она образует непрозрачную твердую массу. Чтобы довести процесс поликонденсации до образования трехмерной структуры, пробирку помещают в сушильный шкаф, где выдерживают продукт 1 ч при 50— 60°С и 3—4 ч при 70— 80°С. Образуется твердая нерастворимая смола ярко-розового цвета.
Источник: megaobuchalka.ru

1. ЗНАЧИМОСТЬ ИЗУЧАЕМОЙ ТЕМЫ: Соединения, содержащие карбонильную группу >С=О, в зависимости от характера связанных с ней заместителей, делятся на альдегиды, кетоны, карбоновые кислоты и их функциональные производные. В альдегидах наряду с углеводородным радикалом карбонильная группа обязательно связана с атомом водорода и в целом группу
называют альдегидной. В кетонах оба заместителя имеют углеводородную природу.
Для альдегидов и кетонов характерны реакции нуклеофильного присоединения (взаимодействие с водой, спиртами, тиолами, аминами, реакции альдольной и кротоновой конденсации и др.), которые являются основой их функционирования in vivo.
2. ЦЕЛЬ ЗАНЯТИЯ: Сформировать знания химических свойств карбонилсодержащих соединений для понимания их реакционной способности обуславливающей протекание ряда реакций в биологических системах.
3. ЗАДАЧИ: после изучения темы
студент должен знать:
— классификацию и номенклатуру альдегидов и кетонов;
— особенности электронного строения карбонильной группы;
— важнейшие химические свойства альдегидов и кетонов, являющихся основой их биологического функционирования;
— механизм реакций нуклеофильного присоединения;
студент должен уметь:
— составлять структурные формулы альдегидов и кетонов и давать им названия по заместительной и радикально-функциональной номенклатуре;
— составлять уравнения реакций гидратации, ацетализации, альдольной и кротоновой конденсации альдегидов и кетонов и описывать их механизм;
— составлять уравнения реакций окисления, восстановления и диспропорционирования альдегидов и описывать их механизм;
— составлять уравнения реакций взаимодействия альдегидов и кетонов с аммиаком и аминами и описывать их механизм;
— составлять уравнения реакций гидролиза ацеталей и полуацеталей и описывать их механизм;
приобрести практические навыки:
— по составлению структурных формул альдегидов и кетонов;
— по составлению уравнений химических реакций с участием альдегидов и кетонов и описанию их механизмов;
— по выполнению качественных (аналитических) реакций на альдегиды и кетоны.
ОСНОВНЫЕ ВОПРОСЫ ТЕМЫ:
1. Оксогруппа >С=О, ее электронное строение и основные характеристики двойной связи (энергия, длина).
ВСПОМОГАТЕЛЬНЫЕ МАТЕРИАЛЫ (ОСНАЩЕНИЕ ЗАНЯТИЯ)
2. Учебные таблицы:
а) периодическая система химических элементов Д.И. Менделеева (1);
б) таблица старшинства функциональных групп по классификации ИЮПАК (12);
в) таблица «Электронные эффекты заместителей» (13);
г) химическая посуда: пробирки, пипетки, спиртовки, водяные бани;
д) реактивы, необходимые для проведения лабораторной работы.
МАТЕРИАЛЫ ДЛЯ КОНТРОЛЯ ЗА УСВОЕНИЕМ ТЕМЫ: тексты контрольных работ
МАТЕРИАЛЫ ДЛЯ САМОПОДГОТОВКИ СТУДЕНТОВ:
1. Напишите схемы реакций:
а) окисления муравьиного альдегида аммиачным раствором оксида серебра (реакция «серебряного зеркала»);
б) восстановления уксусного альдегида и ацетона алюмогидридом лития LiAlH4. Какая частица выступает в роли нуклеофила?
в) пропионового альдегида с этиловым и пропиловым спиртом. Опишите механизм. Объясните роль кислотного катализатора и особенности полученных соединений в отношении к гидролизу.
2. Напишите уравнение реакции взаимодействия ацетона с синильной кислотой (HCN).
3. Напишите схему альдольной конденсации пропионового альдегида. Опишите механизм. Будут ли вступать в эту реакцию триметилуксусный альдегид? Какая структурная особенность предопределяет участие альдегидов в этой реакции?
4. Напишите схему диспропорционирования бензойного альдегида.
5. Напишите уравнение иодоформной реакции открытия ацетона.
ПЕРЕЧЕНЬ СОЕДИНЕНИЙ, ФОРМУЛЫ КОТОРЫХ НЕОБХОДИМО ЗНАТЬ:
1. Формальдегид 5. Иодоформ
2. Ацетальдегид 6. Ацетон
3. Акролеин 7. Бензальдегид
4. Глицериновый альдегид 8. Кротоновый альдегид
ЛАБОРАТОРНАЯ РАБОТА N 6
ОПЫТ 1. Отношение формальдегида и ацетона к окислению щелочными растворами оксидов тяжелых металлов
1) ОКИСЛЕНИЕ ГИДРОКСИДОМ СЕРЕБРА
Возьмите две пробирки и в каждую из них поместите по 2 капли 5% раствора нитрата серебра AgNO3 и 1 каплю 10% раствора гидроксида натрия NaOH. К полученному бурому осадку добавьте по каплям 10% водный раствор аммиака до полного его растворения. Затем в 1-ю пробирку прибавить 4 капли 40% формалина, а во 2-ю — 2 капли ацетона.
В 1-й пробирке образуется осадок черного цвета, который при осторожном нагревании может выделяться на стенках пробирки в виде блестящего зеркального налета. Эта реакция носит название реакции «серебряного зеркала». Во 2-й пробирке выпадение осадка не наблюдается при обычных условиях.
ФОРМА ОТЧЕТА:
1. Напишите уравнение реакции «серебряного зеркала». Чем объясняется выпадение осадка черного цвета в 1-й пробирке?
2. Что произойдет с продуктами реакции при дальнейшем их окислении, т.е. при избытке окислителя? Напишите уравнение реакции.
2) ОКИСЛЕНИЕ ГИДРОКСИДОМ МЕДИ (II)
Поместите в каждую из двух пробирок по 8-10 капель 10% раствора гидроксида натрия и воды, добавьте по 1-5 капель 2% раствора сульфата меди CuSO4. К выпавшему осадку гидроксида меди (II) прибавьте в 1-ю пробирку 3-6 капель 40% раствора формалина, а во 2-ю — 3-5 капель ацетона. Пробирки осторожно нагрейте до кипения. В 1-й пробирке осадок приобретает сначала желтый цвет, затем — красный и , если пробирка чистая, на ее стенках может выделится металлическая медь («медное зеркало»).
Изменение осадков объясняется различной степенью окисления меди.
Голубая Желтая Красная Металлическая
окраска окраска окраска медь
ФОРМА ОТЧЕТА:
1. Наблюдается ли выпадение осадка во 2-й пробирке?
2. Напишите реакцию окисления формальдегида гидроксидом меди (II).
ОПЫТ 2. Получение оксима ацетона
В пробирку поместите по 1 лопаточке гидрохлорида гидроксиламина NH2OH . HCl и кристаллического карбоната натрия (на общем столе) и растворите в 10-25 каплях воды. После выделения основной массы диоксида углерода охладите пробирку и добавьте при хорошем перемешивании 15-20 капель ацетона. Смесь разогревается и выпадают белые кристаллы.
ФОРМА ОТЧЕТА:
Напишите схему реакции получения оксима ацетона и опишите механизм.
ОПЫТ 3. Открытие ацетона переводом его в иодоформ
Эта реакция используется в клинических лабораториях и имеет практическое значение для диагностики сахарного диабета.
В пробирку поместите 5 капель раствора иода в иодиде калия и прибавьте почти до обесцвечивания по каплям 10% раствор гидроксида натрия. К обесцвеченному раствору добавьте 1-3 капли ацетона. При слабом нагревании от тепла рук выпадает желтовато-белый осадок с характерным запахом иодоформа.
ФОРМА ОТЧЕТА:
1. Напишите уравнение реакции образования иодоформа.
2. Способен ли этиловый спирт образовывать иодоформ?
ОПЫТ 4. Реакция взаимодействия формальдегида с фуксинсернистой кислотой ( реакция Шиффа)
В две пробирки наливают по 1 мл бесцветного раствора фуксинсернистой кислоты и добавляют в одну из них несколько капель водного раствора формальдегида, а в другую — несколько капель ацетона. В первую пробирку добавляют осторожно 0,5 мл концентрированной НСl. Что наблюдается?
ФОРМА ОТЧЕТА:
1. Написать краткую методику проведения опыта.
ОПЫТ 5. Реакция диспропорционирования водных растворов
формальдегида (реакция Канниццаро).
Поместите в пробирку 2-3 капли 40% формальдегида и добавьте 1 каплю 0,2% раствора индикатора метилового красного. Что наблюдается?
ФОРМА ОТЧЕТА:
1. Написать краткую методику проведения опыта.
2. Написать уравнение реакции диспропорционирования формальдегида. Наличие какого соединения обуславливает кислую реакцию среды?
3. По какому механизму осуществляется реакция диспрорционирования формальдегида?
ОПЫТ 6. Реакция альдегидов с нитропруссидом натрия
В пробирку налить 1 мл воды и 2-3 капли ацетона. Затем добавить 1 мл 0,5% раствора нитропруссида натрия. После приливания нескольких капель 1н раствора гидроксида натрия смесь принимает красно-фиолетовую окраску, которая затем переходит в желтую.
ФОРМА ОТЧЕТА: 1. Написать краткую методику проведения опыта.
ОПЫТ 7. Окисление этилового спирта
В пробирку поместите 1мл раствора дихромата калия, добавьте столько же разбавленной серной кислоты и 1мл этилового спирта. Осторожно перемешайте, нагрейте — ощущается фруктовый запах уксусного альдегида. Раствор приобретает зеленую окраску от образования соли хрома (III)
ФОРМА ОТЧЕТА:
Напишите уравнение реакции окисления этилового спирта дихроматом калия в кислой среде. Укажите аналитический эффект реакции.
МАТЕРИАЛЫ УИРС:
1. Конспект лекций.
2. Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия: Учеб. для студ. мед. институтов. — 2-е изд.перераб и доп. — М.: Медицина, 1991. — с. 181-194, 213-230.
3. Руководство к лабораторным занятиям по биоорганической химии/ Под ред. Н.А. Тюкавкиной. — М: Медицина, 1985. — с.92- 108, 128-137.
ДОПОЛНИТЕЛЬНАЯ:
1. Г. Тейлор. Основа органической химии для студентов нехимических специальностей. — М: Мир, 1989. — с. 113-141.
2. Степаненко Б.Н. Курс органической химии: Учеб.для студ. мед. институтов. — 3-е изд. перераб и доп. — М.: Высшая школа, 1979. — с. 183-207.
Похожие материалы
- Взаимное влияние атомов в молекулах органических соединений. Сопряжение, ароматичность
- Заслоненная и заторможенная конформации хлористого этила и коламина в проекции Ньюмена. Механизм реакции этерификации муравьиной кислоты изопропиловым спиртом. Определение понятиям «энергия сопряжения» (стабилизации) и «ароматичность»
- Карбоновые кислоты и их функциональные производные
Источник: vunivere.ru