В 1844 году, профессор России [1] . История открытия Рутения напечатана в Бюллетнях Академии наук СССР.
Получение [ ]
Физические и химические свойства [ ]
Физические свойства [ ]
По тугоплавкости (Тпл 2250 °C) рутений уступает лишь нескольким элементам — рению, осмию, вольфраму.
Химические свойства [ ]
Рутений весьма инертный металл.
Неорганические соединения [ ]
Рутений не растворяется в кислотах и хлором выше 400 °C (образуется RuCl3) и со смесью щелочи и нитрата при сплавлении (образуются рутенаты, например Na2RuO4).
Рутений способен давать соединения, соответствующие разной степени окисления:
Органическая химия рутения [ ]
Рутений образует ряд металлоорганических соединений и является активным Применение [ ]
- Небольшая добавка рутения (0,1 %) увеличивает коррозионную стойкость титана.
- В сплаве с платиной используется для изготовления чрезвычайно износостойких электрических контактов.
- молибдена и вольфрама (имея приемущество так же в высокой стойкости к окислению). В последние годы широко изучается [2] .
Физиологическое действие [ ]
Является единственным платиноидным металлом, который обнаруживается в составе живых организмов. (По некоторым данным — ещё и платина) Концентрируется в основном в мышечной ткани.
РЕЗИСТОРЫ СОДЕРЖАЩИЕ РУТЕНИЙ ПАЛЛАДИЙ И СЕРЕБРО
Примечания [ ]
- ↑Популярная библиотека химических элементов. Рутений
- ↑ А. И. Беляков. ЭЛЕКТРОХИМИЧЕСКИЕ СУПЕРКОНДЕНСАТОРЫ: ТЕКУЩЕЕ СОСТОЯНИЕ И ПРОБЛЕМЫ РАЗВИТИЯ //ЭЛЕКТРОХИМИЧЕСКАЯ ЭНЕРГЕТИКА. 2006. Т. 6, № 3. С.146-149
Ссылки [ ]

| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | Xe | |
| Cs | Ba | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | |
| Uue | Ubn | ||||||||||||||||
| La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||
| Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
| Это незавершённая статья о химическом элементе. Вы можете помочь проекту, исправив и дополнив её. |
Эта страница использует содержимое раздела Википедии на русском языке. Оригинальная статья находится по адресу: Рутений. Список первоначальных авторов статьи можно посмотреть в истории правок. Эта статья так же, как и статья, размещённая в Википедии, доступна на условиях CC-BY-SA .
Рутений — Самый ПОДОЗРИТЕЛЬНЫЙ МЕТАЛЛ НА ЗЕМЛЕ!
Источник: vlab.fandom.com
Рутений: факты и фактики

Кто открыл рутений? По общепринятой версии, это сделал в 1844 году профессор Казанского университета Карл Карлович Клаус, который исследовал остатки руды после извлечения платины. В первых опытах ему посчастливилось найти в них много неизвлеченного металла, и Клаус занялся было созданием более эффективного способа.
Однако дальнейшее изучение показало, что, как правило, платины остается немного. «Надежда применить мой способ для выгодного извлечения платины исчезла, осталось только исследование, интересное для науки», — писал Клаус. В этом-то исследовании он выделил шесть граммов неизвестного светлого металла, которые отправил в Стокгольм — Йенсу Якобу Берцелиусу на анализ. Тот поначалу не поверил, что найден новый элемент, но потом, проведя опыты, согласился с мнением Клауса. Так появился элемент рутений, имя же его происходит от латинского названия России.
Однако есть в этом деле интрига. В 1808 году Ян Снядецкий, ректор Императорского Виленского университета, написал письмо президенту французской Академии наук Жан-Батисту Даламберу о том, что его брат Анджей нашел в платине новый элемент — вестий, названый так по имени недавно открытой малой планеты Весты.
Аналогичное письмо ректор отправил академикам в Санкт-Петербург; процедура извлечения нового металла была подробно описана в приложениях к обоим письмам. Впоследствии возникло мнение, что этим металлом и был рутений. Однако современные исследователи внимательно прочитали те письма и нашли, что вестий рутением никак быть не мог.
Во-первых, Снядецкий выделил его из жидкой фракции, получившейся при растворении платины в царской водке, а рутений как раз в ней и не растворяется. Во-вторых, металл был получен в виде хлорида, нерастворимого в спирту, тогда как хлорид рутения в спирту хорошо растворяется («Comptes Rendus Chimie»). Выходит, и французские и русские академики справедливо отказали исследователю в заявке на открытие. Вообще же Анджей Снядецкий известен тем, что написал первый учебник по химии на польском языке и издал первый в истории фундаментальный труд по биохимии — «Теорию живых существ».
Кому мешает рутений? Ядерщикам. Для них он — один из самых неприятных реакторных ядов. Рутений, как и многие другие элементы, получается из осколков деления урана и плутония. Эти тяжелые элементы в атомном топливе совсем не нужны: мало того, что они захватывают нейтроны, снижая эффективность ядерной реакции, так они еще и бывают радиоактивными.
В частности, у рутения есть два относительно долгоживущих изотопа, с периодами полураспада 39,26 суток для рутения-103 и 373,59 — для рутения-106. Первый распадается и исчезает во время выдержки отработанного топлива, а вот второй приходится извлекать при переработке топлива.
И этот рутений — крайне неприятный элемент, который никак не хочет расставаться ни с ураном, ни, что самое главное, с плутонием. Более того, оказавшись в сточных водах, рутений и тут проявляет свой вредный характер — норовит просочиться в грунтовые воды и делает это гораздо более умело, чем другие элементы, рожденные в атомном реакторе. Интересно, что при распаде плутония на рутений приходится более 30% осколков деления, то есть от плутониевого реактора рутениевой грязи получается гораздо больше, чем от уранового. Плох рутений еще и тем, что его высший оксид RuO4 плавится при 25,4°С, а кипит при 40°С, то есть это хорошо летучая жидкость, которая, если уж она появилась, легко разносится по помещению или окружающему пространству.
Шестого октября французский Институт радиационной защиты, IRSN, выдал свою версию. «Расчеты IRSN, основанные на уровнях концентрации, измеренных в нескольких европейских странах, и на метеорологических условиях последних нескольких дней, по-видимому, указывают на то, что загрязняющий воздух мог прийти из южных районов Урала. IRSN продолжает свои исследования, чтобы попытаться подтвердить происхождение этого загрязнения атмосферы».
Высказанные французами предположения имели следствием заявление немецкого Федерального ведомства по радиационной защите от 9 октября: «Причина недавно зафиксированного небольшого повышения показателей радиоактивного рутения-106 по-прежнему неясна. Однако с высокой долей вероятности его источник находится на Южном Урале. Другие регионы на юге России по-прежнему нельзя исключать. Учитывая тот факт, что Россия считается источником радиоактивного выброса, Федеральное министерство окружающей среды ожидает реакции как ответственных российских агентств, так и МАГАТЭ, а также разъяснения и предоставления достоверной информации о причинах повышенного уровня рутения». Российские предприятия ответили, что никаких аварий в этот период на ядерных объектах не было, а МАГАТЭ провело расследование и издало следующий меморандум.
«В период с 3 по 6 октября 2017 года IEC при МАГАТЭ был проинформирован некоторыми странами — членами МАГАТЭ о том, что в образцах воздуха были обнаружены малые концентрации 106 Ru. Измерения не содержали данных о концентрации каких-либо других радионуклидов (например, 137 Cs) и находились на уровнях, значительно более низких, чем допустимые. Начиная с 06.10.2017 ситуацией интересовалось все больше государств — членов МАГАТЭ. В связи с этим и с установленной в таких случаях процедурой, 07.10.2017 IEC при МАГАТЭ направил официальные просьбы государствам-членам ответить на два следующих вопроса:
1. Были ли произведены измерения 106 Ru в воздухе и, если «да», могут ли результаты быть переданы в МАГАТЭ?
2. Были ли какие-то недавние события в тех странах, где зафиксировано появление 106 Ru и, если «да», то может ли информация быть передана в МАГАТЭ?
На сайте USIE был создан раздел для передачи всей информации под названием «Измерения 106 Ru в Европе», на котором этой информацией могли делиться государства — члены МАГАТЭ и международные организации. С 08.10.2017 МАГАТЭ публикует на сайте USIE всю информацию, которая была предоставлена государствами-членами в ответ на запрос.
Большинство публикуемых данных основаны на исследованиях образцов воздуха, полученных в течение последних семи дней. Обобщенно измерения 106 Ru фиксировались в пределах от 10 мкБк до 100 мБк на кубометр воздуха, с наибольшим показателем 145 мБк, зафиксированным в Бухаресте 30.09.2017. В дополнение к измерениям 106 Ru Шведское агентство по радиационной безопасности 09.10.2017 сообщило о трех случаях фиксации 103 Ru очень низкой концентрации.
Отсутствие каких-либо других продуктов деления в образцах воздуха означает, что источником 106 Ru не являются реакторы АЭС. 106 Ru используют для лечения онкологических заболеваний глаз, однако уровни активности препаратов, используемые при таких способах лечения рака, не способны вызвать проблемы, если они будут рассеяны в воздухе. В некоторых научных источниках указано, что 106 Ru может быть использован для радиоизотопного термоэлектрического генератора, однако такое использование не является распространенным из-за короткого периода полураспада.
На основании данных мониторинга и информации, предоставленной государствами — членами МАГАТЭ, не было определено какого-либо конкретного события или конкретного места рассеивания 106 Ru в атмосферу».
Так инцидент был исчерпан, однако загадка, откуда взялся этот рутений в осеннем небе над Бухарестом, осталась неразгаданной. Видимо, навсегда.
Карта распределения рутения-106 в воздухе над Европой осенью 2017 года по данным МАГАТЭ
Кому нужен рутений? Его использование невелико: если в 60-х годах XX века производство рутения исчислялось сотнями килограммов, то спустя полвека это несколько тонн. Самая важная особенность рутения — его способность с легкостью принимать все возможные валентности, от 0 до 8, да еще образовывать кратные связи между своими атомами. Такую гибкость используют, применяя рутений как катализатор либо в виде соединений, где его атом окружен различными лигандами, либо в качестве добавки к платине.
Не исключено, что в этом качестве рутений поможет человечеству бороться с проблемами нефтегазовой экономики, а именно помогать переходу к водородной экономике и утилизации углекислого газа. Например, из-за того, что свет легко возбуждает атомы рутения, соединения с ним служат фотосенсибилизаторами, которые помогают разлагать воду солнечным светом и освобождать из нее водород без всяких затрат нефтегазовой энергии.
Из двух атомов рутения, прицепив к ним свои наборы лигандов, можно сделать и катализатор для разложения солнечным светом углекислого газа с возможностью последующего синтеза муравьиной кислоты (водород при этом берется из жертвенного углеводорода, см. рис.). При этом один атом рутения служит антенной, а второй катализирует реакцию. Интересно, что другой рутениевый катализатор выполняет обратную задачу — разрушает муравьиную кислоту, высвобождая водород, что пригодится в топливных элементах. Вообще, рутений прекрасно соединяется с водородом — один его объем способен поглотить 1500 объемов газа. Однако поскольку рутений крайне редкий элемент, вряд ли из него станут делать хранилища водорода для водородных автомобилей.
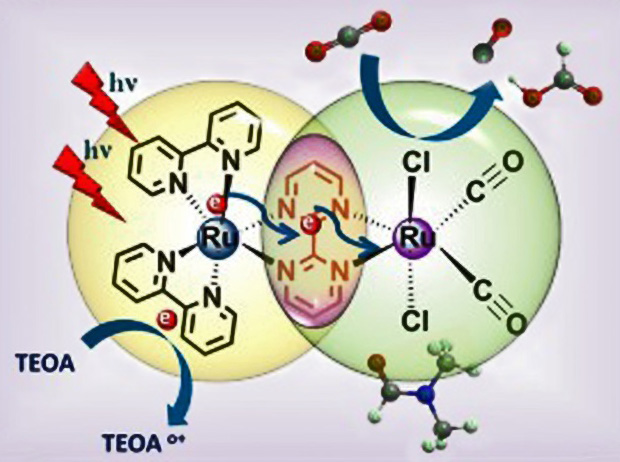 |
| В системе из двух атомов рутения один возбуждается светом, а второй благодаря этому возбуждению разрушает молекулу углекислого газа («Journal of Industrial and Engineering Chemistry») |
Зачем рутений планетологам? С его помощью они пытаются выяснить загадки происхождения Солнечной системы. Вот, например, такой вопрос: как кристаллизуются железо-никелевые ядра планет? Согласно современной модели планетообразования, в определенный момент истории все планеты представляют собой расплавленные капли, движущиеся по орбите вокруг светила.
В этом состоянии начинается так называемое фракционирование — тяжелые элементы собираются в ядрах, а легкие всплывают в верхние слои мантии и формируют потом твердую кору; на Земле, например, — из оксидов кремния и алюминия. Кстати, эта модель порождает вопрос: откуда на поверхности Земли взялись месторождения тяжелых металлов. Ведь они все должны были утонуть так глубоко, что даже вулкану практически невозможно их вынести наружу. Так вот, ядро может оставаться в жидком состоянии, а может и закристаллизоваться, причем неясно, идет ли фронт кристаллизации снаружи или изнутри.
Добраться до ядра человечеству пока что не под силу, но можно изучать обломки ядра одной из планет — железо-никелевые метеориты. По распределению изотопов того же рутения можно попытаться понять, как кристаллизовалось ядро, ведь легкие изотопы рутения оттесняются в жидкость, а тяжелые концентрируются в твердом веществе. Пока, правда, попытки безуспешны.
Например, изучение нескольких метеоритов показало, что одни действительно образовались из первого материала, выпавшего из расплава, а другие — из остающейся жидкости. Однако в некоторых метеоритах присутствуют одновременно области и с тяжелыми, и с легкими изотопами. Видимо, и тут имела место дендритная ликвация, когда в прослойках между образовавшимися кристаллами остается обогащенная легкоплавкими элементами жидкость.
По изотопам рутения можно также узнать, откуда шла бомбардировка Земли после формирования твердой коры, если сравнить соотношение изотопов рутения в метеоритах и в образцах древней мантии. Сравнение показывает, что, скорее всего, бомбардировка шла железными метеоритами и так называемыми энстатитовыми хондритами. Такие хондриты сейчас — редкий тип метеоритов, они содержат много неокисленного железа. Видимо, подобные метеориты и создали на Земле месторождения тяжелых металлов, коль скоро исходные канули в глубинах планеты.
Как рутений защитит дегустаторов? От искусства дегустатора зависит качество виски, коньяка, купажированного вина или чая, в общем, всего, что смешивают из продукции разного производства, а точнее, зависит стабильный из года в год вкус этих продуктов. Но перечислены, так сказать, безобидные продукты. А что, если нужно оценить остроту перца?
Оказывается, и на этот случай имеется свой дегустатор, но вряд ли его работу можно признать столь же безопасной, как у пробователя коньячных спиртов. Химики пытаются помочь: изобретают датчики на капсаицин, главный жгучий алкалоид горького перца. В частности, рутений существенно повышает чувствительность такого датчика и его способность распознавать остроту перца.
Что делают с рутением медики? Рутений находится в центре внимания разработчиков новых лекарств. Дело в том, что родственная ему платина оказалась открытием для онкологов. Изготовленные из ее соединений препараты (первым из них был цисплатин) сегодня составляют чуть ли не половину всех средств, применяемых для химиотерапии.
Однако не секрет, что химиопрепараты отнюдь не безопасны, они разрушают здоровые клетки, что ведет к тяжелым побочным эффектам. Кроме того, некоторые клетки опухолей развивают устойчивость и к платиновым препаратам.
Естественно, возникает желание повторить успех платины с каким-то ее соседом по таблице Менделеева, тем более что с химической точки зрения — переменная в широких пределах валентность, способность образовывать сложные металлорганические соединения — все платиноиды подобны. Рутений — один из чемпионов по числу лигандов, которые можно привязать к этому металлу.
При попадании в организм либо непосредственно в целевую клетку лиганды могут отщепляться и выполнять свою разрушительную функцию, или же все соединение может работать как яд, уничтожая митохондрии, или, соединяясь с ДНК, мешать жизни клетки. Из рутениевых соединений пытаются сделать и препараты для фототерапии: такое вещество становится убийственным после того, как поймает квант света и возбудится. К сожалению, пока особых успехов нет, в клиническую практику никакой рутениевый препарат не вошел, а некоторые клинические испытанию показывают, что его препараты совсем не эффективнее известных. Однако с учетом того разнообразия соединений, которым может похвастаться химия рутения, когда-нибудь исследователям и пациентам может и повезти.
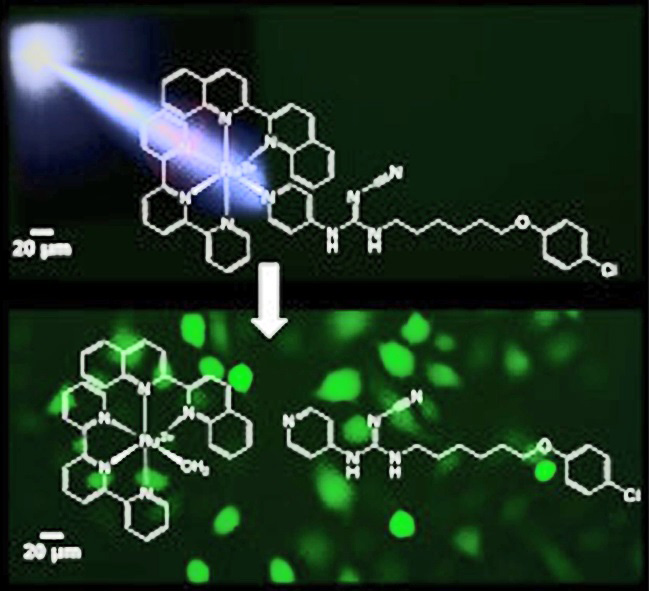 |
| При освещении от рутениевого комплекса отщепляется фрагмент, который убивает клетку («Journal of Inorganic Biochemistry») |
Источник: hij.ru
Рутений как химический элемент таблицы Менделеева

Рутений является химическим элементом периодической таблицы Менделеева с атомным номером 44 и условным обозначением Ru. Рутений представляет собой редкий серебристо-белый переходный металл.
- Как был открыт Рутений;
- Где и как добывают Рутений;
- Распространенность Рутения;
- Применение Рутения;
- Интересные факты
Как был открыт Рутений
История открытия рутения начинается с давних времен. Платиновые руды, содержащие все шесть металлов платиновой группы, были известны еще во времена до открытия Колумбом американского континента. Тот факт, что природная платина содержит примеси палладия, родия, осмия и иридия был известен еще в начале XIX века.
Платина в 18 веке добывалась на аллювийных песках рек Российской Империи и применялась в пластинах и медалях, а так же для чеканки рублевых монет. Так вот остатки платины от чеканки монет из платины добытой на Урале отправлялись на исследования. Исследования проходили преимущественно на территории Восточной Европы.
В 1819 году исследованием этих руд занялись Йонс Якоб Берцелиус и Готфрид Осанн. В 1828 году Готфрид Осанн получил неизвестный белый оксид, свойства которого не соответствовали ни одному известному на тот момент оксиду. После восстановления получился неизвестный метал золотисто-желтого цвета. Осанн назвал новый химический элемент Рутений в честь страны России.
С тех пор в принципе и пошла мода на название элемента в честь страны в которой он был найден. Проблема заключалась в том, что Берцелиус не сумел повторить опыт Осанна. Даже спустя время сам Осанн не смог повторить свой опыт и отказался от данного открытия.

В 1841 году профессор Казанского университета немецко-балтийского происхождения Карл Клаус занялся повторением опытов по выделению металлов из платиновых руд. Уже в 1844 году Карл Клаус обнаруживает рутений среди выделенных металлов. Научная статья посвященная этому химическому элементу выпущена русским ученым в этом же году. Она имела название «Химические исследования остатков Уральской платиновой руды и металла рутения».
О своем научном достижении Карл Клаус сообщил Г.И. Гессу в письме на немецком языке. Там он изложил характеристики, свойства, метод и технологию выделения чистого металла. Гесс в свою очередь зачитал доклад 13 сентября 1844 года в Петербургской Академии наук и отметил сходство между остальным элементами этой группы.
Где и как добывают Рутений

Добыча рутения осуществляется из платиновых руд, но сходство и низкая реакционная способность металлов содержащихся в данной руде затрудняет их извлечение. На сегодняшний день существует несколько способов извлечения рутения.
В случае, когда платиновая руда содержит высокую концентрацию рутения обычно сначала отделяют его методом перегонки. Для этого раствор, содержащий трехвалентный или шестивалентный рутений, смешивают с окислителями, такими как хлор, хлораты или перманганат калия, и окисляют рутений до летучего оксида рутения(VIII). Обычно это делают в разбавленной соляной кислоте.
Затем его собирают и восстанавливают до водорастворимых хлоррутенатных комплексов. Причиной такой процедуры являются опасности образования оксида рутения(VIII) во время разделения. Например, при взаимодействии оксида рутения (VIII) с солями аммония могут образовываться взрывоопасные соединения азота и хлора.
Если исходный материал содержит лишь небольшое количество рутения, сначала отделяют остальные платиновые металлы. Для этого существуют различные методы для различных металлов, в частности, экстракция подходящими растворителями или осаждение труднорастворимых солей. В конце концов растворенный рутений остается. Раствор освобождают от любого присутствующего аммония и рутений окисляют до оксида рутения (VIII), а затем отделяют перегонкой.
Для получения металлического рутения его либо осаждают в виде гексахлоррутената аммония, либо в виде оксида рутения (IV) и восстанавливают при 800°С в атмосфере водорода. Формула получения выглядит приблизительно следующим образом:
Помимо платиновых руд важным сырьем для извлечения рутения и других платиновых металлов является анодный шлам, образующийся при производстве никеля. Другим источником рутения являются отработавшие тепловыделяющие элементы, поскольку платиновые металлы также образуются при делении ядер.
Одна тонна этих топливных элементов содержит более двух килограммов рутения, а также более ценных платиновых металлов, таких как родий или палладий. Этот рутений из отработанных топливных элементов содержит почти 4% радиоактивного 106 Ru (мягкий бета-излучатель, период полураспада около 1 года), который распадается до 106 Rh. Родий распадается мгновенно (период полураспада 30 с) с испусканием гамма-излучения. Таким образом, использование рутения из ядерных реакторов в нынешних обстоятельствах не предвидится. Мировое производство рутения составляет около 20 т в год (по состоянию на 2008 г.).
Распространенность Рутения

Другими крупными месторождениями являются река Миасс на Южном Урале (Российская Федерация), месторождение возле Нижнего Тагила (Российская Федерация), река Урю в Японии и река Юба в Калифорнии.
Как и другие платиновые металлы он встречается в природе в виде минералов. Сегодня известно всего 13 минералов содержащих рутений. В большинстве случаев они представляют собой сплавы с другими платиновыми металлами. Примерами таких минералов могут служить рутениридосмин, лаурит и арсенит рутена.
Применение Рутения

Применение рутения является достаточно ограниченным из-за его редкости. Большая часть металла используется в электронной промышленности. Зарегистрирован с 2006 года и в основном играет роль элемента перпендикулярной магнитной записи.
Причина, по которой используется рутений, связана с его гексагональной кристаллической структурой, которая имеет такую же постоянную кристаллическую решетку, как и используемый сплав накопительного слоя. Тонкие слои рутения используются в электрических контактах, таких как токосъемные кольца или герконовые реле. По сравнению с другими металлами которые можно использовать, такими как закаленное кобальтом золото, они тверже и, следовательно, более устойчивы к истиранию.
Как и другие платиновые металлы, рутений обладает каталитическим действием. Таким образом, речь может идти о гидрогенизации из ароматических соединений кислот и кетонов. Рутений также способен оказывать каталитическое действие при метанировании — производстве метана из водорода и окиси (или двуокиси) углерода. Более низкие температуры, необходимые для метанирования рутением, могут представлять интерес для долгосрочных космических полетов, поскольку углекислый газ, выдыхаемый космонавтами, может быть преобразован и кислородный цикл становится замкнутым.
Аналогично железу и осмию, рутений также катализирует синтез аммиака из азота и водорода. Он обладает более высокой каталитической активностью, чем железо, и, таким образом, обеспечивает более высокий выход при более низких давлениях. Использование металла в основном ограничивается его ценой. Рутениевый катализатор, нанесенный на углеродную матрицу и улучшенный барием и цезием в качестве промоторов, используется в промышленности с 1998 года на двух производственных предприятиях KBR в Тринидаде. Поскольку медленное метанирование углеродного носителя мешает процессу, ведутся исследования безуглеродных рутениевых катализаторов синтеза аммиака.
В небольших количествах рутений используется в сплавах палладия или платины для повышения твердости. Сплавы, содержащие рутений, используются, среди прочего, для перьев перьевых ручек или для пломбирования зубов. Небольшое количество рутения (0,1%) делает титановые сплавы более устойчивыми к коррозии, что важно для применения в химической промышленности или нефтедобыче. Это возможная альтернатива палладию. Также в жаропрочных сплавах на основе никеля, которые используются для лопаток турбин, рутений может быть легирующей составляющей, что оказывает здесь влияние на повышенную фазовую стабильность.
Большая часть рутения используется не в виде металла, а в виде соединения, прежде всего в виде оксида рутения (IV), который используется, среди прочего, в качестве материала для резисторов и электродов , например для покрытия титановых анодов в хлорщелочном электролизе. Бета — излучатель 106 Ru используется для лучевой терапии на хориоиде и меланомы.
Интересные факты
Интересных фактов связанных с рутением не очень много из-за его редкости и неизученности. Рутений, как и другие платиновые металлы, обычно не встречаются в организме человека. Отдельные соединения рутения обладают фармакологическим потенциалом. Сегодня идут изучения этого элемента в качестве активного вещества.
То есть вещества способного вызывать специфические реакции в организме человека при его внутреннем и наружном применении. Уже есть положительные результаты в применении в качестве цитостатического агента. Это означает, что некоторые соединения рутения подавляют деление клеток в живых организмах. Такое исследование может положительно сказаться на методах по лечению (или хотя бы сдерживанию) раковых заболеваний. Помимо противоопухолевого действия, которым обладают соединения нескольких платиновых металлов, оно основано прежде всего на трех свойствах комплексов рутения:
- медленный обмен лигандами (комплекс может достигать нужного места в организме, не реагируя с водой или другими молекулами);
- несколько возможных степеней окисления (+2, +3, +4) в физиологических условиях;
- имеет большое сходство с железом ( соединения рутения могут замещать его в белках, таких как трансферрин).
В дополнение к использованию в противоопухолевой химиотерапии также исследуются применения соединений рутения в качестве иммунодепрессантов, антибиотиков и противомикробных веществ, например, для борьбы с малярией или болезнью Шагаса.
Как металл рутений нетоксичен. В отличие от осмия, ядовитый и легколетучий тетраоксид образуется не при взаимодействии с кислородом при комнатной температуре, а только при взаимодействии с сильными окислителями. В виде порошка рутений легко воспламеняется, в случае пожара его нельзя тушить водой, а только порошковыми или металлическими огнетушителями.
Рутений представляет собой серебристо-белый, твердый и хрупкий металл. С плотностью 12,37 г/см 3 это второй по легкости платиновый металл после палладия. Рутений плавится при 2606 К и кипит при температуре около 4423 К. При температуре ниже 0,49 К элемент становится сверхпроводником.
Источник: biobloger.ru