Алкины реагируют с сильными окислителями (перманганаты или соединения хрома (VI)). При этом происходит окисление тройной связи С≡С и связей С-Н у атомов углерода при тройной связи. При этом образуются связи с кислородом.
При окислении трех связей у атома углерода в кислой среде образуется карбоксильная группа СООН, четырех — углекислый газ СО2. В нейтральной среде — соль карбоновой кислоты и карбонат (гидрокарбонат) соответственно.
Таблица соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| R-C≡ | R-COOH | -COOMe |
| CH≡ | CO2 | Me2CO3 (MeHCO3) |
При окислении бутина-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента СН3–C≡, поэтому образуется уксусная кислота:
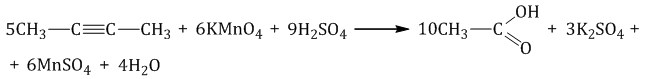
Примеры решения задания №16 ЕГЭ по химии
При окислении 3-метилпентина-1 перманганатом калия в серной кислоте окислению подвергаются фрагменты R–C и H–C, поэтому образуются карбоновая кислота и углекислый газ:
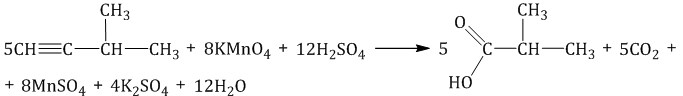
При окислении алкинов сильными окислителями в нейтральной среде углеродсодержащие продукты реакции жесткого окисления (кислота, углекислый газ) могут реагировать с образующейся в растворе щелочью в соотношении, которое определяется электронным балансом с образованием соответствующих солей.
Например, при окислении бутина-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента R–C≡, поэтому образуется соль уксусной кислоты – ацетат калия.
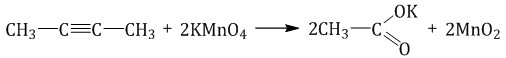
Аналогичные органические продукты образуются при взаимодействии алкинов с хроматами или дихроматами.
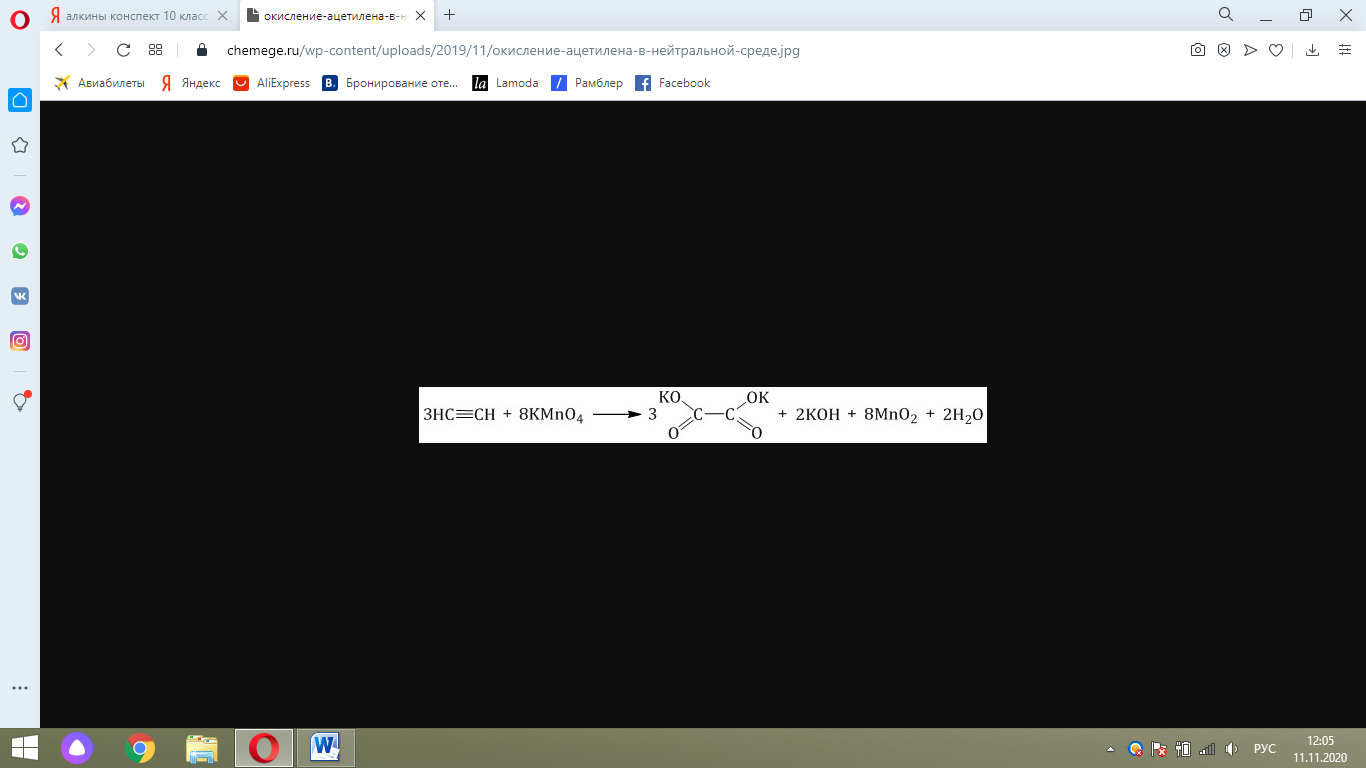
Окисление ацетилена протекает немного иначе, σ-связь С–С не разрывается, поэтому в кислой среде образуется щавелевая кислота:
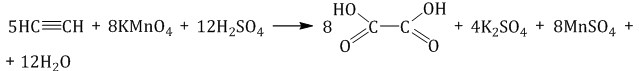
В нейтральной среде образуется соль щавелевой кислоты – оксалат калия:
Обесцвечивание раствора перманганата калия — качественная реакция на тройную связь.
Кислотные свойства алкинов
Связь атома углерода при тройной связи (атома углерода в sp-гибридизованном состоянии) с водородом значительно более полярная. чем связь С–Н атома углерода при двойной или одинарной связи (в sp 2 и sp 3 -гибридном состоянии соответственно). Это обусловлено большим вкладом s-орбитали в гибридизованное состояние.
| Гибридизация: | sp | sp 2 | sp 3 |
| Число s-орбиталей | 1 | 1 | 1 |
| Число p-орбиталей | 1 | 2 | 3 |
| Доля s-орбитали | 50% | 33% | 25% |
15. Алкины (часть 3)
Повышенная полярность связи С–Н у атомов углерода при тройной связи в алкинах приводит к возможности отщепления протона Н + , т.е. приводит к появлению у алкинов с тройной связью на конце молекулы (алкинов-1) кислотных свойств.
Ацетилен и его гомологи с тройной связью на конце молекулы R–C≡C–H проявляют слабые кислотные свойства, атомы водорода на конце молекулы могут легко замещаться на атомы металлов.
Алкины с тройной связью на конце молекулы взаимодействуют с активными металлами, гидридами, амидами металлов и т.д.
Например, ацетилен взаимодействует с натрием с образованием ацетиленида натрия.
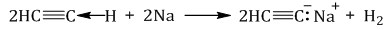
Например, пропин взаимодействует с амидом натрия с образованием пропинида натрия.

Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра (I) или аммиачным раствором хлорида меди (I).
При этом образуются нерастворимые в воде ацетилениды серебра или меди (I):
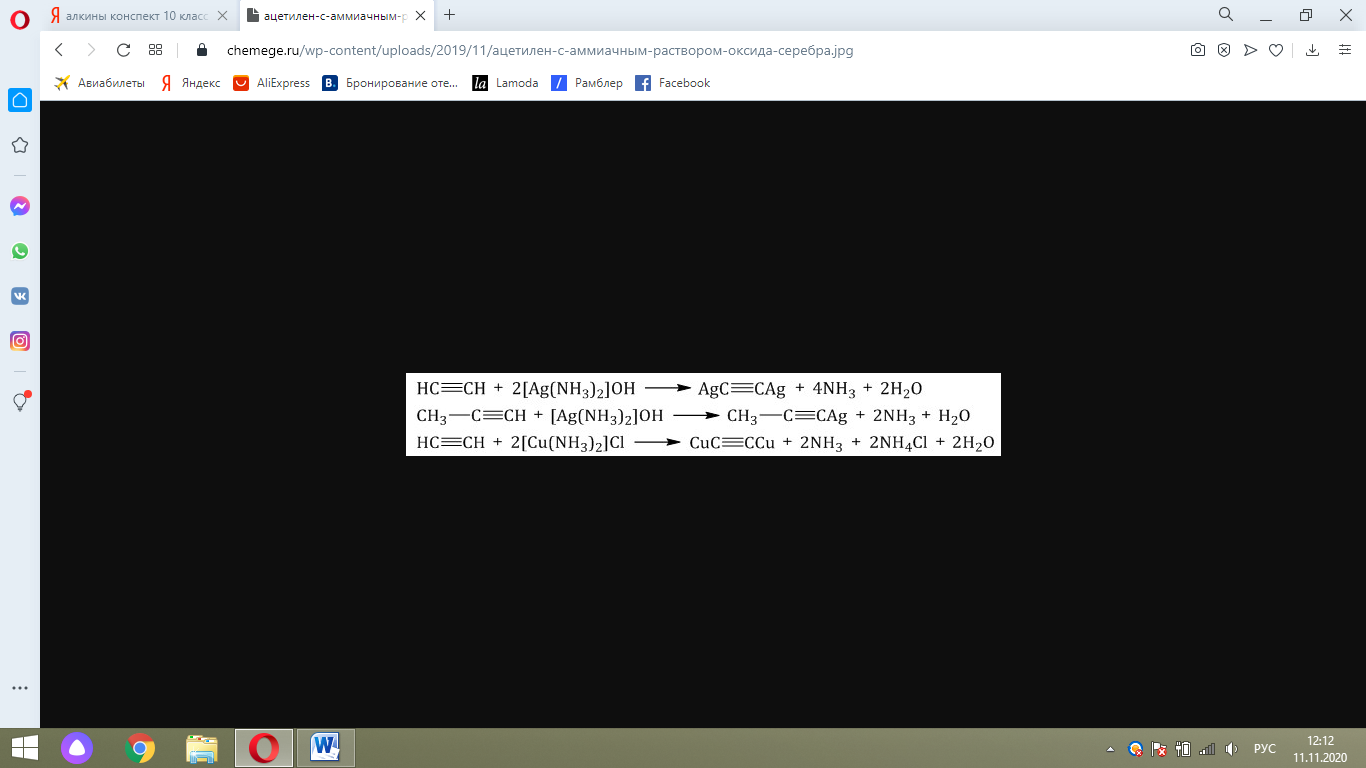
Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра или аммиачным раствором хлорида меди (I) с образованием белого или красно-коричневого осадка соответственно. Это качественная реакция на алкины с тройной связью на конце молекулы.
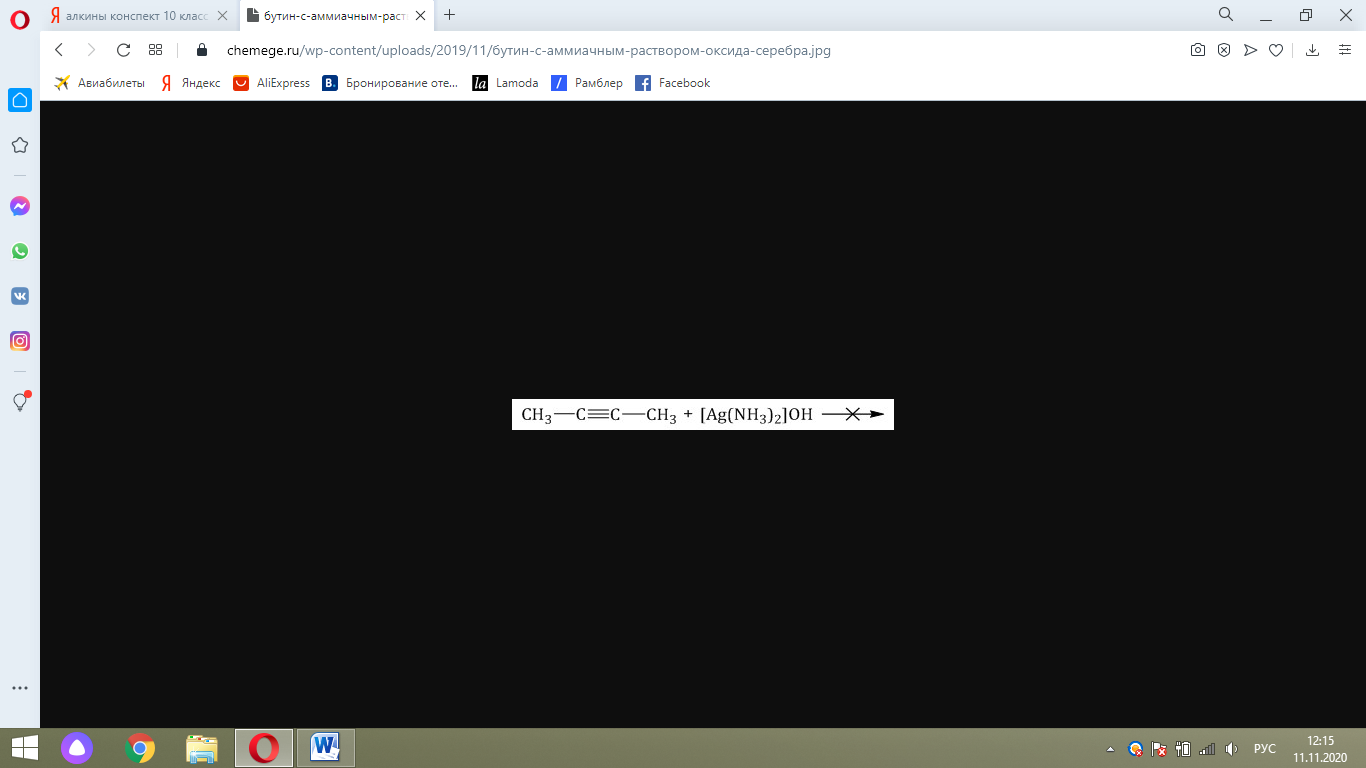
Соответственно, алкины, в которых тройная связь расположена не на конце молекулы, не реагируют с аммиачными растворами оксида серебра или хлорида меди (I).
Получение алкинов
Дегидрирование алканов
При дегидрировании алканов, содержащих от двух до трех атомов углерода в молекуле, образуются двойные и тройные связи.
Например, при дегидрировании этана может образоваться этилен или ацетилен:
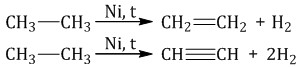
Пиролиз метана
Пиролиз метана – это промышленный способ получения ацетилена.

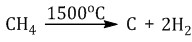
Реакцию проводят, очень быстро пропуская метан между электродами (электродуговой способ) — примерно 0,1-0,01 секунды при температуре 1500 о С.
Если процесс проводить дольше, то метан разлагается на углерод и водород:
Гидролиз карбида кальция
Лабораторный способ получения ацетилена – водный или кислотный гидролиз карбида кальция CaC2.
СаС 2 + 2Н 2 О = Са(ОН) 2 + С 2 Н 2
В кислой среде образуется ацетилен и соответствующая соль:
CaC 2 + 2HCl = CaCl 2 + C 2 H 2
Карбид кальция можно получить, нагревая оксид кальция с углеродом:
СаО + 3С (изб) → СаС 2 + СО
Источник: infopedia.su