МЕДЬ (лат. Cuprum), Cu (читается «купрум»), химический элемент I группы периодической системы Менделеева, атомный номер 29, атомная масса 63,546.
Природная медь состоит из двух стабильных нуклидов 63 Cu (69,09% по массе) и 65 Cu (30,91%). Конфигурация двух внешних электронных слоев нейтрального атома меди 3s 2 p 6 d 10 4s 1 . Образует соединения в степенях окисления +2 (валентность II) и +1 (валентность I), очень редко проявляет степени окисления +3 и +4.
В периодической системе Менделеева медь расположена в четвертом периоде и входит в группу IВ, к которой относятся такие благородные металлы, как серебро (Ag) и золото (Au).
По шкале Полинга электроотрицательность меди 1,9; медь принадлежит к числу переходных металлов. Стандартный электродный потенциал Cu/Cu 2+ 0,339 В. В ряду стандартных потенциалов медь расположена правее водорода (H) и ни из воды, ни из кислот водорода не вытесняет.
Простое вещество медь — красивый розовато-красный пластичный металл.
Название: латинское название меди происходит от названия острова Кипра (Cuprus), где в древности добывали медную руду; однозначного объяснения происхождения этого слова в русском языке нет.
АФФИНАЖ СЕРЕБРА — ВЫТЕСНЕНИЕ МЕДЬЮ!
Физические и химические свойства: кристаллическая решетка металлической меди кубическая гранецентрированная, параметр решетки а = 0,36150 нм. Плотность 8,92 г/см 3 , температура плавления 1083,4°C, температура кипения 2567°C. Медь среди всех других металлов обладает одной из самых высоких теплопроводностей и одним из самых низких электрических сопротивлений (при 20°C удельное сопротивление 1,68·10 –3 Ом·м).
В сухой атмосфере медь практически не изменяется. Во влажном воздухе на поверхности меди в присутствии углекислого газа образуется зеленоватая пленка состава Cu(OH)2·CuCO3. Так как в воздухе всегда имеются следы сернистого газа и сероводорода, то в составе поверхностной пленки на металлической меди обычно имеются и сернистые соединения меди.
Такая пленка, возникающая с течением времени на изделиях из меди и ее сплавов, называется патиной. Патина предохраняет металл от дальнейшего разрушения. Для создания на художественных предметах «налета старины» на них наносят слой меди, который затем специально патинируется.
При нагревании на воздухе медь тускнеет и в конце концов чернеет из-за образования на поверхности оксидного слоя. Сначала образуется оксид Cu2O, затем — оксид CuO.
Красновато-коричневый оксид меди (I) Cu2O при растворении в бромо- и иодоводородной кислотах образует, соответственно, бромид меди (I) CuBr и иодид меди (I) CuI. При взаимодействии Cu2O с разбавленной серной кислотой возникают медь и сульфат меди:
При нагревании на воздухе или в кислороде Cu2O окисляется до CuO, при нагревании в токе водорода — восстанавливается до свободного металла.
Черный оксид меди (II) CuO, как и Cu2O, c водой не реагирует. При взаимодействии CuO с кислотами образуются соли меди (II):
При сплавлении со щелочами CuO образуются купраты, например:
как отделить медь от серебра???
Нагревание Cu2O в инертной атмосфере приводит к реакции диспропорционирования:
Такие восстановители, как водород, метан, аммиак, оксид углерода (II) и другие восстанавливают CuO до свободной меди, например:
CuO + СО = Cu + СО2.
Кроме оксидов меди Cu2O и CuO, получен также темно-красный оксид меди (III) Cu2O3, обладающий сильными окислительными свойствами.
Медь реагирует с галогенами, например, при нагревании хлор реагирует с медью с образованием темно-коричневого дихлорида CuCl2. Существуют также дифторид меди CuF2 и дибромид меди CuBr2, но дииодида меди нет. И CuCl2, и CuBr2 хорошо растворимы в воде, при этом ионы меди гидратируются и образуют голубые растворы.
При реакции CuCl2 с порошком металлической меди образуется бесцветный нерастворимый в воде хлорид меди (I) CuCl. Эта соль легко растворяется в концентрированной соляной кислоте, причем образуются комплексные анионы [CuCl2] – , [CuCl3] 2– и [СuCl4] 3– , например за счет процесса:
При сплавлении меди с серой образуетcя нерастворимый в воде сульфид Cu2S. Сульфид меди (II) CuS выпадает в осадок, например, при пропускании сероводорода через раствор соли меди (II):
C водородом, азотом, графитом, кремнием медь не реагирует. При контакте с водородом медь становится хрупкой (так называемая «водородная болезнь» меди) из-за растворения водорода в этом металле.
В присутствии окислителей, прежде всего кислорода, медь может реагировать с соляной кислотой и разбавленной серной кислотой, но водород при этом не выделяется:
С азотной кислотой различных концентраций медь реагирует довольно активно, при этом образуется нитрат меди (II) и выделяются различные оксиды азота. Например, с 30%-й азотной кислотой реакция меди протекает так:
С концентрированной серной кислотой медь реагирует при сильном нагревании:
Практическое значение имеет способность меди реагировать с растворами солей железа (III), причем медь переходит в раствор, а железо (III) восстанавливается до железа (II):
Этот процесс травления меди хлоридом железа (III) используют, в частности, при необходимости удалить в определенных местах слой напыленной на пластмассу меди.
Ионы меди Cu 2+ легко образуют комплексы с аммиаком, например, состава [Cu(NH3)] 2+ . При пропускании через аммиачные растворы солей меди ацетилена С2Н2 в осадок выпадает карбид (точнее, ацетиленид) меди CuC2.
Гидроксид меди Cu(OH)2 характеризуется преобладанием основных свойств. Он реагирует с кислотами с образованием соли и воды, например:
Но Сu(OH)2 реагирует и с концентрированными растворами щелочей, при этом образуются соответствующие купраты, например:
Если в медноаммиачный раствор, полученный растворением Сu(OH)2 или основного сульфата меди в аммиаке, поместить целлюлозу, то наблюдается растворение целлюлозы и образуется раствор медноаммиачного комплекса целлюлозы. Из этого раствора можно изготовить медноаммиачные волокна, которые находят применение при производстве бельевого трикотажа и различных тканей.
Одновременно сульфид меди (I) Cu2S окисляется:
Образовавшийся на этой стадии Cu2О далее реагирует с Cu2S:
Применение: медь, как полагают, — первый металл, который человек научился обрабатывать и использовать для своих нужд. Найденные в верховьях реки Тигр изделия из меди датируются десятым тысячелетием до нашей эры. Позднее широкое применение сплавов меди определило материальную культуру бронзового века (конец 4 — начало 1 тысячелетия до нашей эры) и в дальнейшем сопровождало развитие цивилизации на всех этапах. Медь и ее использовались для изготовления посуды, утвари, украшений, различных художественных изделий. Особенно велика была роль бронзы.
С 20 века главное применение меди обусловлено ее высокой электропроводимостью. Более половины добываемой меди используется в электротехнике для изготовления различных проводов, кабелей, токопроводящих частей электротехнической аппаратуры. Из-за высокой теплопроводности медь — незаменимый материал различных теплообменников и холодильной аппаратуры. Широко применяется медь в гальванотехнике — для нанесения медных покрытий, для получения тонкостенных изделий сложной формы, для изготовления клише в полиграфии и др.
Большое значение имеют медные сплавы — латуни (основная добавка цинк (Zn)), бронзы (сплавы с разными элементами, главным образом металлами — оловом (Sn), алюминием (Al), берилием (Be), свинцом (Pb), кадмием (Cd) и другими, кроме цинка (Zn) и никеля (Ni)) и медно-никелевые сплавы, в том числе мельхиор и нейзильбер. В зависимости от марки (состава) сплавы используются в самых различных областях техники как конструкционные, антидикционные, стойкие к коррозии материалы, а также как материалы с заданной электро- и теплопроводностью Так называемые монетные сплавы (медь с «алюминием (Al) и медь с никелем (Ni)) применяют для чеканки монет — «меди» и «серебра»; но медь входит в состав и настоящих монетного серебра и монетного золота.
СЕРЕБРО (лат. Argentum), Ag, химический элемент I группы периодической системы Менделеева, атомный номер 47, атомная масса 107,8682.
Свойства: металл белого цвета, ковкий, пластичный; плотность 10,5 г/см 3 , tпл 961,9 °С. Один из дефицитных элементов. Имеет наивысшую среди металлов электрическую проводимость, теплопроводность, отражательную способность. Серебро химически малоактивно, в присутствии сероводорода чернеет. Серебро обладает бактерицидными свойствами: ионы Ag + стерилизуют воду.
Распространение в природе: Серебро встречается в самородном виде, а также в виде сульфида Ag2S (аргентит)
Открытие: с еребро известно с древнейших времен.
Получение: Извлечение из сульфидной руды цианидным способом:
Химические свойства:
Соляная и разбавленная серная кислоты на него не действуют. Раствоpяют серебpо обычно в азотной кислоте, котоpая взаимодействует с ним согласно уpавнению:
Ag + 2HNO3 —> AgNO3 + NO2+ H2O
Сеpебpо обpазует один pяд солей, pаствоpы котоpых содеpжат бесцветные катионы Ag+.
Пpи действии щелочей на pаствоpы солей сеpебpа можно ожидать получения AgOH, но вместо него выпадает буpый осадок оксида сеpебpа(I):
2AgNO3 + 2NaOH —> Ag2O + 2NaNO3 + H2O
Кpоме оксида сеpебpа(I) известны оксиды Ag2O и Ag2O3.
Hитpат сеpебpа (ляпис) — AgNO3 — обpазует бесцветные пpозpачные кpисталлы, хоpошо pаствоpимые в воде. Пpименяется в пpоизводстве фотоматеpиалов, пpи изготовлении зеpкал, в гальванотехнике, в медицине.
Подобно меди, сеpебpо обладает склонностью к обpазованию комплексных соединений.
Многие неpаствоpимые в воде соединения сеpебpа (напpимеp: оксид сеpебpа(I) — Ag2O и хлоpид сеpебpа — AgCl), легко pаствоpяются в водном pаствоpе аммиака.
Реагирует с сероводородом с образованием черного сульфида серебра(I)
4Ag + H2S + O2 = 2Ag2S + 2H2O.
Этой реакцией объясняется потемнение серебряных изделий на воздухе
Серебро — благородный металл, поэтому реагирует только с кислотами _ окислителями(азотной, горячей концентрированной серной кислотой)
Применение: применяется в кинофотопромышленности, электротехнической и электронной промышленности, а также в производстве ювелирных изделий.
Комплексные цианистые соединения сеpебpа пpименяются для гальванического сеpебpения, так как пpи электpолизе pаствоpов этих солей на повеpхности изделий осаждается плотный слой мел-кокpисталлического сеpебpа.
Все соединения сеpебpа легко восстанавливаются с выделением металлического сеpебpа.
Соединения серебра:
а) оксиды серебра. Оксид дисеребра (Ag2O) представляет собой коричневато — черный порошок, малорастворимый в воде. На свету он становится черным.
Оксид серебра (AgO) — серовато — черный порошок.
Оксиды серебра используются, inter alia, в производстве аккумуляторов;
б) галогениды серебра. Хлорид серебра (AgCl) — белая масса или плотный порошок, не растворимый в воде, темнеющий на свету; его упаковывают в темноокрашенные непрозрачные контейнеры. Используется в фотографии, в производстве керамики, в медицине и для серебрения.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Соединения меди
Как и все d-элементы, соединения меди ярко окрашены.
Так же как у хрома, у меди наблюдается провал электронов — с s-орбитали на d-орбиталь
Электронное строение атома:
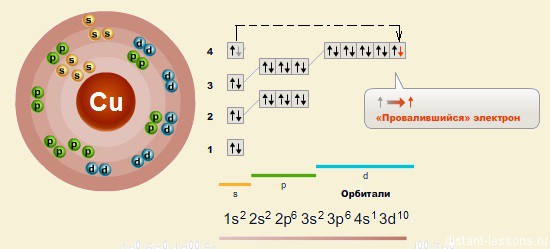
Соответственно, существуют 2 характерные степени окисления меди: +2 и +1.

Простое вещество: металл золотисто-розового цвета.
Оксиды меди: Сu2O оксид меди (I) оксид меди 1 — красно-оранжевого цвета
СuO оксид меди (II) оксид меди 2 — черного цвета.
Другие соединения меди Cu(I), кроме оксида, неустойчивы.
Соединения меди Cu(II) — во-первых, стабильны, во-вторых, голубого или зеленоватого цвета.
Почему зеленеют медные монеты? Медь в присутствии воды взаимодействует с углекислым газом воздуха, образуется СuCO3 — вещество зеленого цвета.
Еще одно окрашенное соединение меди — сульфид меди (II) — осадок черного цвета.
Медь, в отличие от других элементов, стоит в ряду напряжений после водорода, поэтому не выделяет его из кислот:
- с горячей серной кислотой: Сu + 2H2SO4 = CuSO4 + SO2 + 2H2O
- с холодной серной кислотой: Сu + H2SO4 = CuO + SO2 + H2O
- с концентрированной азотной кислотой:
Cu + 4HNO3 = Cu(NO3)2 + 4NO2 + 4H2O - с разбавленной азотной кислотой:
3Cu + 8HNO3 = 3 Cu(NO3)2 + 2NO +4 H2O
Пример задачи ЕГЭ С2 вариант 1:
Нитрат меди прокалили, полученный твёрдый осадок растворили в серной кислоте. Через раствор пропустили сероводород, полученный чёрный осадок подвергли обжигу, а твёрдый остаток растворили при нагревании в азотной кислоте.
2Сu(NO3)2 → 2CuO↓ +4 NO2↑ + O2↑
Твердый осадок — оксид меди (II).
CuO + H2S → CuS↓ + H2O
Сульфид меди (II) — осадок черного цвета.
«Подвергли обжигу» — значит, произошло взаимодействие с кислородом. Не путайте с «прокаливанием». Прокалить — нагреть, естественно, при высокой температуре.
2СuS + 3O2 = 2CuO + 2SO2
Твердый остаток — это СuO — если сульфид меди прореагировал полностью, СuO + CuS — если частично.
СuO + 2HNO3 = Cu(NO3)2 + H2O
CuS + 2HNO3 = Cu(NO3)2 + H2S
возможна так же другая реакция:
СuS + 8HNO3 = Cu(NO3)2 + SO2 + 6NO2 + 4H2O
Пример задачи ЕГЭ С2 вариант 2:
Медь растворили в концентрированной азотной кислоте, полученный газ смешали с кислородом и растворили в воде. В полученном растворе растворили оксид цинка, затем к раствору прибавили большой избыток раствора гидроксида натрия.
В результате реакции с азотной кислотой образуется Сu(NO3)2, NO2 и O2.
NO2 смешали с кислородом — значит, окислили: 2NO2 + 5O2 = 2N2O5. Cмешали с водой: N2O5 + H2O = 2HNO3.
ZnO + 2HNO3 = Zn(NO3)2 + 2H2O
Источник: distant-lessons.ru
Взаимодействие меди с кислотами
C водородом, азотом, графитом, кремнием медь не реагирует. При контакте с водородом медь становится хрупкой (так называемая «водородная болезнь» меди) из-за растворения водорода в этом металле.
В присутствии окислителей, прежде всего кислорода, медь может реагировать с соляной кислотой и разбавленной серной кислотой, но водород при этом не выделяется:
2Cu + 4HCl + O 2 = 2CuCl 2 + 2H 2 O
С азотной кислотой различных концентраций медь реагирует довольно активно, при этом образуется нитрат меди (II) и выделяются различные оксиды азота. Например, с 30%-й азотной кислотой реакция меди протекает так:
3Cu + 8HNO 3 = 3Cu(NO 3) 2 + 2NO + 4H 2 O
С концентрированной серной кислотой медь реагирует при сильном нагревании:
Cu + 2H 2 SO 4 = CuSO 4 + SO 2 + 2H 2 O
Практическое значение имеет способность меди реагировать с растворами солей железа (III), причем медь переходит в раствор, а железо (III) восстанавливается до железа (II):
2FeCl 3 + Cu = CuCl 2 + 2FeCl 2
Этот процесс травления меди хлоридом железа (III) используют, в частности, при необходимости удалить в определенных местах слой напыленной на пластмассу меди.
Ионы меди Cu 2+ легко образуют комплексы с аммиаком, например, состава 2+ . При пропускании через аммиачные растворы солей меди ацетилена С 2 Н 2 в осадок выпадает карбид (точнее, ацетиленид) меди CuC 2 .
Гидроксид меди Cu(OH) 2 характеризуется преобладанием основных свойств. Он реагирует с кислотами с образованием соли и воды, например:
Сu(OH) 2 + 2HNO 3 = Cu(NO 3) 2 + 2H 2 O
Но Сu(OH) 2 реагирует и с концентрированными растворами щелочей, при этом образуются соответствующие купраты, например:
Сu(OH) 2 + 2NaOH = Na 2
Если в медноаммиачный раствор, полученный растворением Сu(OH) 2 или основного сульфата меди в аммиаке, поместить целлюлозу, то наблюдается растворение целлюлозы и образуется раствор медноаммиачного комплекса целлюлозы.
2.2 Основный карбонат меди и его физико-химические свойства
СuCO(OH)- дигидроксид-карбонат димеди
Иногда встречается в виде зелёных, моноклинных, игольчатых, большей частью сросшихся кристаллов, но чаще всего в виде плотной или волокнистой зелёной массы. При слабом нагревании разлагается без плавления. При нагревании свыше 200˚C он чернеет и превращается в черный порошок оксида меди, одновременно выделяются пары воды и углекислый газ.
При осаждении из раствора имеет переменный состав (1-2)CuCO∙Cu(OH) (минерал малахит). Не растворяется в холодной воде, разлагается кипящей водой, кислотами; реагирует с цианидом калия, солями аммония. Переводится в среднюю соль действием CO под избыточным давлением.
2.3 Синтез малахита
1) Расчёт исходных масс веществ
CuSO∙5H 2 O+ 4NaHCO= CuCO∙Cu(OH)↓+ NaSO+ 3CO+ 11HO m(CuSO∙5H 2 O) = 5,5 г
2) Описание работы
Фарфоровая ступка с пестиком – 1,
термический стакан – 250 мл,
-
Горелов А.А. Экология. – М.: Изд-во Юрайт, 2001. – 128 с. Здорик Т.Б. Камень, рождающий металл. М.: Изд-во Просвещение, 1984. – 21, 136 с. Лебединский В.И. В удивительном мире камня. – М.: Кругосвет, 1985. — 198 с. Путолова Л.С. Самоцветы и цветные камни. – М.: Изд-во Недра, 1991. – 113, 115 — 116 с. Ферсман А.Е. Рассказы о самоцветах. – М.: изд-во Детгиз, 1952. – 74-76 с. Корнилов Н.И., Солодова Ю.П.
- Ювелирные камни. – М.: Изд-во Мир, 1982.- 84,181 с. Подчайнова В.Н., Симонова Л.Н. Аналитическая химия меди. – М.: Изд-во Наука, 1990. – 7,8-12 с. Аксёнова М., Храмов Г., Володин В. Камни мира. – М.: Аванта +, 2001 – 76,159 с. Здорик Т.Б., Матиас В.В., Тимофеев И.Н. Минералы и горные породы СССР. – М.: Изд-во Мысль, 1970. – 136 с. Лидин Р.А., Молочко В.А., Андреева.
- Химические свойства неорганических веществ. – М.: Изд-во Химия, 1997. – 289 с. Викторов С. Ласковый шелк камня // Природа. – 1990. — №4. – 136 с. Самоцветы // Куликов Б.Ф., Буканов В.В. Словарь камней-самоцветов. – Ленинград: Недра, 1989. – 62 с. Под ред. Третьякова Ю.Д. Неорганическая химия: в 3 т. – М.: Издательский центр Академия, 2007. – Т.3. Реми Г. Курс неорганической химии: в 2 т. – М.: Изд-во иностранной литературы, 1963. – Т. 2.
Детские годы Багрова-внука
Совершенствование системы адаптации персоналом в организации
Опыт 1. Взаимодействие меди с кислотами
а) Поместите в пробирку немного стружек меди и прилейте 1-2 мл H 2 SO 4 (2н). Отметьте отсутствие изменений. Прилейте в пробирку несколько капель пероксида водорода (H 2 O 2) и слегка встряхните содержимое пробирки. Отметьте изменение окраски раствора и объясните происходящее явление. Напишите уравнение реакции.
Cu + H 2 SO 4 разб. ¹
Cu + H 2 SO 4 разб. + H 2 O 2 ® CuSO 4 + H 2 O
б) Поместите в две пробирки немного медных стружек (опыт проводите под тягой). В первую пробирку налейте немного концентрированной серной кислоты и нагрейте. Что наблюдаете? Напишите уравнение реакции. Во вторую пробирку прилейте немного концентрированной азотной кислоты HNO 3 . Что наблюдаете?
Напишите уравнение реакции.
Cu + H 2 SO 4 конц. ® CuSO 4 + SO 2 + H 2 O
Cu + HNO 3 конц. ® Cu(NO 3) 2 + NO 2 + H 2 O
Cu + HNO 3 разб. ® Cu(NO 3) 2 + NO + H 2 O
Опыт 2. Получение и свойства гидроксида меди(II)
Налейте в пробирку 5-6 капель раствора соли меди(II) и добавьте такой же объём щелочи NaOH (2н). Напишите уравнение реакции, отметив цвет осадка. Разделите осадок на три пробирки. В первую пробирку прилейте 1-2 мл раствора H 2 SO 4 (2н), а во вторую — 1-2 мл раствора NaOH (2н). Что наблюдаете? Проявляет ли гидроксид меди в этих условиях кислотные свойства?
Напишите уравнения реакций. Третью пробирку с гидроксидом меди(II) нагрейте на водяной бане. Что наблюдаете? Сделайте вывод о термической устойчивости гидроксида меди(II). Напишите уравнение реакции.
CuSO 4 + NaOH ® Cu(OH) 2 + Na 2 SO 4
Cu(OH) 2 + H 2 SO 4 ® CuSO 4 + H 2 O
Cu(OH) 2 CuO + H 2 O
Опыт 3. Окислительные свойства иона меди(II)
Налейте в пробирку примерно 1 мл раствора сульфата меди(II) и добавьте немного раствора KI. Наблюдайте изменение в окраске раствора и выпадение белого осадка CuI. Добавьте несколько капель крахмала. Почему крахмал окрасился в синий цвет? Напишите уравнение реакции.
CuSO 4 + KI ® CuI + + I 2 K 2 SO 4
Опыт 4. Получение аммиаката меди. Качественная реакция на ион Cu 2+
Налейте в пробирку 2-3 капли раствора сульфата меди(II) и прилейте такое же количество раствора NH 4 OH (2н). Составьте уравнение реакции и отметьте цвет осадка сульфата гидроксомеди(II). По каплям добавляйте в пробирку концентрированный раствор NH 4 OH (25%). Наблюдайте за растворением осадка и изменением окраски раствора вследствие образования ионов 2+ . Составьте уравнение реакции.
CuSO 4 + NH 4 OH ® (CuOH) 2 SO 4 + (NH 4) 2 SO 4
(CuOH) 2 SO 4 + (NH 4) 2 SO 4 + NH 4 OH ® SO 4 + H 2 O
Опыт 1. Взаимодействие меди с кислотами — понятие и виды. Классификация и особенности категории «Опыт 1. Взаимодействие меди с кислотами» 2014, 2015-2016.
И концентрированным кислотам
В три пробирки поместить 2-3 микрошпателя порошка меди и прибавить по 5-6 капель 2 н раствора кислот: в первую соляную, во вторую — серную, в третью — азотную.
Проделать аналогичный опыт с концентрированными кислотами. С какими кислотами взаимодействует медь? Написать уравнение реакции взаимодействия меди с разбавленной азотной кислотой, считая, что при этом образуется оксид азота (II). Как изменяется цвет раствора? Почему медь не взаимодействует с соляной кислотой и с разбавленной серной кислотой?
Написать уравнение реакции взаимодействия меди с концентрированными кислотами, считая, что концентрированная азотная кислота восстанавливается медью до оксида азота (IV), а серная до оксида серы (IV).
Опыт 2. Отношение гидроксида меди (II) к кислотам и щелочам
В двух пробирках получить гидроксид меди (II). К полученным осадкам прибавить в одну пробирку 5-6 капель 2 н раствора серной кислоты, в другую столько же 2 н раствора щелочи.
Описать проделанную работу. В каком случае происходит растворение гидроксида меди (II)? Какой вывод можно сделать из этого опыта о свойствах гидроксида меди (II)?
Опыт 3. Получение малорастворимого карбоната гидроксомеди (II)
В пробирку с раствором сульфата меди (II) (2-3 капли) прибавить такое же количество раствора соды. Наблюдать выпадение зеленого осадка карбоната гидроксомеди (II) (CuOH) 2 CO 3 . Почему при взаимодействии с раствором соды не выпадает средний карбонат меди? Написать уравнение взаимодействия сульфата меди с содой при участии воды.
Опыт 4. Получение аммиачного комплекса меди (II)
В пробирку с раствором сульфата меди (II) (2-3 капли) прибавить по каплям 2 н раствор аммиака до полного растворения осадка основной соли (CuOH) 2 SO 4 , выпавшего при добавлении первых капель гидроксида аммония. Отметить окраску исходного раствора сульфата меди (II) и раствора получившегося медноаммиачного комплекса. Какие ионы обуславливают окраску раствора в первом и во втором случае? Написать уравнения реакций:
а) взаимодействия сульфата меди (II) с гидроксидом аммония с образованием осадка сульфата гидроксомеди (II).
б) растворения сульфата гидроксомеди (II) в избытке гидроксида аммония с образованием комплексных соединений.
в) уравнения диссоциации полученных комплексных соединений меди.
Опыт 5. Получение меди химическим восстановлением
Из растворов
Погрузите в раствор нитрата меди (II) предварительно очищенную наждачной бумагой и промытую водой железную пластинку. Через 1-2 мин. выньте пластинку. Напишите уравнение происходящей реакции.
Контрольные вопросы
1 В чем сходство и отличие в строении атомов элементов подгруппы меди от щелочных металлов?
2 Чем объяснить появление зеленоватого налета на изделиях из меди при длительном контакте с атмосферным воздухом?
3 Составить уравнения реакций растворения меди и серебра в концентрированной серной кислоте при нагревании?
4 Какое вещество выпадает в осадок при сливании горячих растворов нитрата меди (II) и гидроксида калия? Составить уравнения реакций в молекулярном и молеклярно-ионном видах.
5 Хлорид серебра растворим в растворах аммиака и тиосульфата натрия. Составить уравнения реакций образования комплексных соединений серебра, учитывая, что координационное число иона Аg + равно двум.
Алюминий — элемент главной подгруппы III группы. На внешнем энергетическом уровне у атома алюминия находится три электрона (s 2 р 1), поэтому в большинстве соединении он проявляет степень окисления (+3)
Алюминий — активный металл. Но при обыкновенной температуре на воздухе не изменяется, так как быстро покрывается тонким плотным слоем оксида, предохраняющим его от дальнейшего окисления. Разрушение этого слоя, например, путем амальгамирования, вызывает быстрое окисление металла. Благодаря наличию защитного слоя алюминий не вытесняет водорода из воды; но лишенный этого слоя, алюминий хорошо реагирует с водой с образованием гидроксида А1(ОН) 3 и водорода.
Алюминий хорошо растворяется в разбавленных кислотах – хлороводородной и серной, особенно при нагревании. Являясь амфотерным металлом, хорошо растворяется в щелочах с образованием гидроксо-алюманатов и водорода:
2Аl+6КОН + 6Н 2 О = 2К 3 [Аl(ОН) 6 ]+ЗН 2 .
Сильно разбавленная и холодная концентрированная азотная кислота, концентрированная серная кислота алюминий не растворяют, так как пассивируют его. Алюминий хорошо реагирует со многими неметаллами: азотом, серой, галогенами.
Алюминий образует оксид Аl 2 О 3 и гидроксид Аl(ОН)з — нерастворимые в воде вещества белого цвета, обладающие амфотерными свойствами.
Соли алюминия, образованные сильными кислотами, вследствие гидролиза имеют в растворах кислую среду. Некоторые соли — сульфиды, карбонатыв водных растворах подвергаются полному гидролизу.
ЛАБОРАТОРНАЯ РАБОТА
- Установка печи для сжигания мусора Печь для сжигания мусора 115 кирпичей Как известно, главной.
- Чайно гибридные розы посадка и уход осенью Розы чайно гибридные сорта уход →
Источник: salita-mart.ru