Сера — химический элемент № (16). Она расположена в VI А группе третьем периоде Периодической системы.
S 16 + 16 ) 2 e ) 8 e ) 6 e
На внешнем слое атома серы содержатся шесть валентных электронов. До завершения внешнего слоя не хватает двух электронов. Поэтому в соединениях с металлами и водородом сера проявляет степень окисления (–2). При взаимодействии с более электроотрицательными элементами (кислородом, галогенами) сера образует соединения, в которых её степень окисления положительная ((+4) или (+6)).
В земной коре сера встречается в самородном виде или в виде минералов и горных пород: (пирит — Fe S 2 , цинковая обманка — ZnS , свинцовый блеск — PbS , гипс — CaS O 4 ⋅ 2 H 2 O , глауберова соль — Na 2 S O 4 ⋅ 10H 2 O ).


Химия 9 класс (Урок№11 — Сера. Серовород. Сульфиды.)
Рис. (1). Самородная сера
Рис. (2). Пирит
Сера относится к макроэлементам живых организмов. Она содержится в белках. Больше всего серы в белках, которые образуют шерсть, волосы, рога. Входит она также в состав некоторых витаминов и гормонов.
Простое вещество
Сера образует несколько аллотропных модификаций. Обычно мы имеем дело с кристаллической серой, которая состоит из восьмиатомных циклических молекул.

Рис. (3). Модель молекулы серы
Молекулы образуют кристаллы разного строения, и поэтому существуют аллотропные видоизменения: ромбическая и моноклинная сера. Обе модификации представляют собой жёлтые легкоплавкие вещества. Температуры плавления их несколько различаются ((+112,8) °С и (+119,3) °С).

Рис. (4). Сера
При нагревании сера плавится, превращается в лёгкую жидкость, а затем начинает темнеть и становится вязкой. Образуется пластическая сера, состоящая из длинных линейных молекул.
В воде сера не растворяется и ею не смачивается. Поэтому порошок серы не тонет вводе, несмотря на более высокую плотность ((2,07) г/см³). Такое явление называется флотацией.
Подожжённая сера реагирует с кислородом, и образуется сернистый газ. Сера в этой реакции — восстановитель .
S 0 + O 2 0 = t S + 4 O 2 − 2 .
Окислительные свойства сера проявляет в реакциях с металлами и водородом.
С активными металлами и ртутью реагирует при комнатной температуре:
Hg 0 + S 0 = Hg + 2 S − 2 .
При нагревании сера вступает в реакцию с большинством металлов — железом, алюминием, цинком и другими, кроме золота и платины.
Свойства серы
2 Al 0 + 3 S 0 = t Al + 3 2 S − 2 3 .
В реакциях с металлами образуются сульфиды.
При повышенной температуре сера реагирует с водородом. Образуется сероводород:
H 2 0 + S 0 = t H 2 + 1 S − 2 .
Применение серы
- Используется в химической промышленности для производства серной кислоты;
- находит применение в сельском хозяйстве для обеззараживания помещений;
- входит в состав некоторых мазей;
- используется в производстве спичек и бумаги;
- с её помощью каучук превращают в резину;
- входит в состав взрывчатых веществ.
Источник: www.yaklass.ru
Сера

Типичный неметалл – сера – относится к группе халькогенов и находится в VI группе периодической таблицы Менделеева. Сера – один из жизненно важных элементов, входящих в состав живых организмов.
Строение
Сера – 16 элемент периодической таблицы, находящийся в VI группе, главной подгруппе и в третьем периоде. Формула серы – S. Относительная атомная масса – 32.
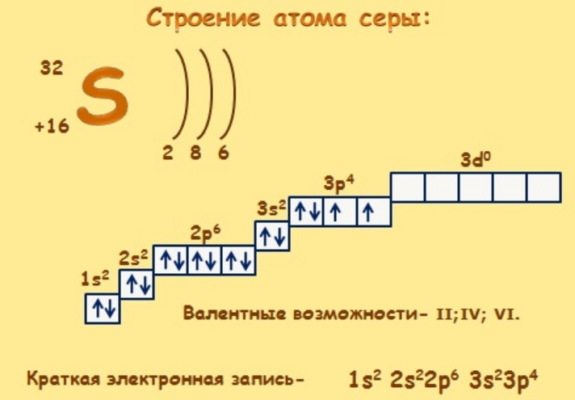
Ядро атома серы имеет положительный заряд +16. Вокруг ядра располагается 16 отрицательно заряженных электронов на трёх энергетических уровнях.
Электронное строение атома серы – 1s 2 2s 2 2p 6 3s 2 3p 4 . На внешнем энергетическом уровне находится шесть валентных электронов. До завершения р-орбитали не хватает двух электронов, поэтому степень окисления серы -2.
В соединениях проявляет себя как окислитель, отнимая электроны. Однако возможность переходить в возбуждённое состояние за счёт свободных d-орбиталей даёт элементу две дополнительные степени окисления – +4 и +6.
Известно четыре стабильных изотопа серы, находящиеся в природе. Это 32 S, 33 S, 34 S, 36 S. Кроме того, искусственно получено 20 радиоактивных изотопов серы.
Аллотропия
Сера – хрупкое кристаллическое вещество желтоватого цвета. При нагревании плавится, превращаясь в жидкость жёлтого цвета. При увеличении температуры до 200°С становится вязкой тёмно-коричневой массой, напоминающей смолу.
Основные физические свойства элемента:
- отсутствие растворимости в воде, в том числе в составе сложных веществ;
- плавучесть в воде (не смачивается);
- плохая проводимость тепла и электричества;
- хорошая растворимость в органических растворителях (феноле, бензоле, сероуглероде);
- диссоциация на атомы происходит при температуре 1500°С;
- температура кипения – 444,6°С.
Сера образует аллотропные модификации, которые отличаются физическими свойствами. Краткое описание модификаций приведено в таблице.
Вид
Формула
Температура плавления, °С
Плотность, г/см 3
Особенности
Источник: obrazovaka.ru
Сера
Сера — элемент VIa группы 3 периода периодической таблицы Д.И. Менделеева. Относится к группе халькогенов — элементов VIa группы.
Сера — S — простое вещество имеет светло-желтый цвет. Использовалась еще до нашей эры в составе священных курений при религиозных обрядах.

Основное и возбужденное состояние атома серы
Электроны s- и p-подуровня способны распариваться и переходить на d-подуровень. Как и всегда, количество валентных электронов отражает количество возможных связей у атома.
В разных электронных конфигурациях сера способна принимать валентности: II, IV и VI.

Природные соединения
- FeS2 — пирит, колчедан
- ZnS — цинковая обманка
- PbS — свинцовый блеск (галенит), Sb2S3 — сурьмяный блеск, Bi2S3 — висмутовый блеск
- HgS — киноварь
- CuFeS2 — халькопирит
- Cu2S — халькозин
- CuS — ковеллин
- BaSO4 — барит, тяжелый шпат
- CaSO4 — гипс
В местах вулканической активности встречаются залежи самородной серы.

В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H2S, SO2.
Серу можно получить разложением пирита
В лабораторных условиях серу можно получить слив растворы двух кислот: серной и сероводородной.
На воздухе сера окисляется, образуя сернистый газ — SO2. Реагирует со многими неметаллами, без нагревания — только со фтором.

При нагревании сера бурно взаимодействует со многими металлами с образованием сульфидов.
При взаимодействии с концентрированными кислотами (при длительном нагревании) сера окисляется до сернистого газа или серной кислоты.
Сера вступает в реакции диспропорционирования с щелочами.
Сера вступает в реакции с солями. Например, в кипящем водном растворе сера может реагировать с сульфитами с образованием тиосульфатов.

Сероводород — H2S
Бесцветный газ с характерным запахом тухлых яиц. Огнеопасен. Используется в химической промышленности и в лечебных целях (сероводородные ванны).

Сероводород получают в результате реакции сульфида алюминия с водой, а также взаимодействия разбавленных кислот с сульфидами.

Сероводород плохо диссоциирует в воде, является слабой кислотой. Реагирует с основными оксидами, основаниями с образованием средних и кислых солей (зависит от соотношения основания и кислоты).
KOH + H2S = KHS + H2O (гидросульфид калия, избыток кислоты)
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Сероводород — сильный восстановитель (сера в минимальной степени окисления S 2- ). Горит в кислороде синим пламенем, реагирует с кислотами.

Качественной реакцией на сероводород является реакция с солями свинца, в ходе которой образуется сульфид свинца.
Оксид серы — SO2
Сернистый газ — SO2 — при нормальных условиях бесцветный газ с характерным резким запахом (запах загорающейся спички).

В промышленных условиях сернистый газ получают обжигом пирита.
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе подобных реакций образуется сернистая кислота, распадающаяся на сернистый газ и воду.
Сернистый газ получается также в ходе реакций малоактивных металлов с серной кислотой.
С основными оксидами, основаниями образует соли сернистой кислоты — сульфиты.

Химически сернистый газ очень активен. Его восстановительные свойства продемонстрированы в реакциях ниже.
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства (понижать степень окисления).
Сернистая кислота
Слабая, нестойкая двухосновная кислота. Существует лишь в разбавленных растворах.
Диссоциирует в водном растворе ступенчато.
В реакциях с основными оксидами, основаниями образует соли — сульфиты и гидросульфиты.
H2SO3 + KOH = H2O + KHSO3 (соотношение кислота — основание, 1:1)
С сильными восстановителями сернистая кислота принимает роль окислителя.
Как и сернистый газ, сернистая кислота и ее соли обладают выраженными восстановительными свойствами.

Оксид серы VI — SO3
Является высшим оксидом серы. Бесцветная летучая жидкость с удушающим запахом. Ядовит.
В промышленности данный оксид получают, окисляя SO2 кислородом при нагревании и присутствии катализатора (оксид ванадия — Pr, V2O5).
В лабораторных условиях разложением солей серной кислоты — сульфатов.
Является кислотным оксидом, соответствует серной кислоте. При реакции с основными оксидами и основаниями образует ее соли — сульфаты и гидросульфаты. Реагирует с водой с образованием серной кислоты.
SO3 + 2KOH = K2SO4 + 2H2O (основание в избытке — средняя соль)
SO3 + KOH = KHSO4 + H2O (кислотный оксид в избытке — кислая соль)

SO3 — сильный окислитель. Чаще всего восстанавливается до SO2.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Сера
Источник: studarium.ru