По списку А, в хорошо укупоренных банках с притертой пробкой, в защищенном от света месте (на свету разлагается).
Применение
Как вяжущее и антисептическое средство в виде водных растворов до 2%; при концентрации выше 5% оказывает прижигающее действие. Применяется наружно для лечения глазных и кожных заболеваний (эрозии, язвы, трахома).
Форма выпуска — порошок (субстанция).
Исходными продуктами для получения являются белки (казеин, яичный белок, желатин и др.) и серебра нитрат. Белки подвергают гидролитическому разложению при обработке водяным паром в присутствии кислот или щелочей. Из серебра нитрата получают свежеосажденный оксид
Образующиеся при гидролизе белка лизальбиновая и протальбиновая кислоты восстанавливают серебро (I) до металлического, которое в коллоидном состоянии связывается с белком.
Полученные вещества очищают путем диализа от примесей ионом серебра, нитрат ионов, кислот и щелочей, выпаривают в вакууме при 30-40°С до образования сухого геля, измельчают.
Серебра протеинат
Описание.
В зависимости от содержания серебра лекарственные вещества отличаются по внешнему виду.
Колларгол — зеленовато-черные или синевато-черные мелкие пластинки с металлическим блеском. Растворим в воде с образованием коллоидного раствора. Золь колларгола (1:2000) имеет желтовато- или красновато-бурый оттенок, прозрачен в проходящем и слегка опалесцирует в отраженном свете.
Протаргол — коричнево-желтый или коричневый легкий порошок без запаха, слегка вяжущего и слабогорького вкуса; легко растворим в воде, нерастворим в спирте, эфире, хлороформе, гигроскопичен.
Подлинность.
Доказывают наличие белка и серебра:
1. При нагревании лекарственных средств происходит обугливание и распространяется запах жженого рога.
2. Биуретовая реакция, основанная на свойстве соединений, содержащих пептидные (амидные) связи образовывать с ионами меди (II) в щелочной среде комплексное соединение фиолетового цвета
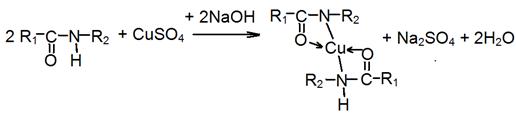
где R1 и R2 — радикалы кислот, которыми образован пептид (дипептид).
Для ее выполнения исследуемые вещества нагревают до кипения в присутствии кислоты хлористоводородной, при этом происходит гидролиз белка. Раствор фильтруют, к фильтрату добавляют натрия гидроксид и меди сульфат.
3. Для доказательства серебра его переводят в ионогенное состояние, т.к. оно прочно связано с белками и в водном растворе не ионизирует.
Для этого лекарственное вещество озоляют, остаток растворяют в кислоте азотной, фильтруют и в фильтрате катион серебра доказывают характерными реакциями; осаждением в виде труднорастворимого серебра хлорида, растворимого в растворе аммиака или реакцией окисления-восстановления («серебряного зеркала»)
3Ag + 4HNO3 → 3AgNO3 + 4NO + 2Н2О
4. Для отличия колларгола от протаргола ФС рекомендует использовать реакцию образования осадка серебролизальбиновой кислоты темно-бурого цвета, который появляется при добавлении к золю колларгола кислоты хлористоводородной; при добавлении щелочи осадок растворяется.
Как ПРОВЕРИТЬ СЕРЕБРО дома ПРОСТОЙ РАБОЧИЙ СПОСОБ Лайфхак ХРОМПИК
Испытание на чистоту.
1. Проводят испытание на отсутствие посторонних соединений серебра, для чего навеску лекарственного вещества обрабатывают спиртом и фильтруют. К фильтрату добавляют кислоту хлористоводородную — не должно наблюдаться помутнения.
2. Определяют прозрачность водных растворов в проходящем свете не должно наблюдаться нерастворившихся частиц.
3. Устанавливают потерю в массе при высушивании: для колларгола она должна быть не более 3%, протаргола-3,5%.
Количественное определение.
Тиоцианатный метод после предварительной минерализации смесью концентрированных кислот серной и азотной при кипячении в течение 5 мин (до получения бесцветного раствора). При этом белковая часть сгорает, серебро растворяется в кислоте азотной с образованием соли — серебра нитрата.
Химизм определения представлен следующими реакциями:
> t°
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Большая Энциклопедия Нефти и Газа
Количественное определение серебра производится в оставшихся 100 мл минерализата титрованием по Фоль-гарду. Для этого 100 мл минерализата осторожно нейтрализуют 25 % раствором аммиака по лакмусу, добавляют 10 мл концентрированной азотной кислоты и 2 мл насыщенного раствора железоаммонийных квасцов. [1]
Наиболее точными методами количественного определения серебра ( за исключением метода анализа сухим путем) являются: весовой метод, основанный на осаждении серебра в виде хлорида, и объемный метод, при котором серебро осаждают титрованным раствором роданида калия или аммония в присутствии железа ( III) в качестве индикатора. [2]
На малой растворимости железистосинеродистого серебра основан ряд методов количественного определения серебра . [3]
Вследствие такой большой эффективности поглощения ионов серебра СаА — цеолит может быть использован для количественного определения серебра и выделения его из смеси с другими катионами, даже из очень разбавленных растворов. [5]
Они обнаружили, что цеолит СаА проявляет отчетливо выраженную селективность по отношению к ионам серебра, и может быть использован для количественного определения серебра и выделения его из смеси с другими катионами, даже из очень разбавленных растворов. [6]
Ниже приводится краткое описание органических реактивов, вошедших в ассортимент, основные условия их применения ( по методам), а также примеры практического использования этих реактивов для количественного определения серебра в различных материалах. [7]
Способом Фольгарда пользуются для количественного определения серебра в различных сплавах после обработки их азотной кислотой. [8]
Осадок растворяют в смеси H2SO4 и Н2О2 и полученный раствор выпаривают досуха. Остаток после растворения в уксусной кислоте может быть использован для количественного определения серебра посредством и-диметиламинобензилиденроданина. [9]
История возникновения электрохимического метода анализа, описываемого в настоящей главе, несколько необычна. Метод был по существу два раза открыт и оба раза почти позабыт. Первый раз его описал Саломон1 в 1897 — 98 г. Саломон погрузил два посеребренных серебряных электрода в раствор нитрата калия, содержавший немного нитрата серебра, и установил, что сила тока, возникающего в цепи, зависит от приложенного напряжения и от концентрации нитрата серебра; в отсутствие нитрата серебра при небольшом напряжении ток через цепь не проходил. Саломон предположил, что сделанное им наблюдение можно использовать для количественного определения серебра и других металлов, титруя раствор соответствующим реактивом До прекращения тока. Он подчеркивал перспективы этого метода, который, по его мнению, должен обладать большой точностью, и рекомендовал заняться подробнее его разработкой. Однако этот призыв не нашел отклика, и лишь в 1905 г. появилась работа Нернста и Мер — риама2, которые провели кислотно-основное титрование, пользуясь двумя палладиевыми игольчатыми электродами, погруженными в раствор нитрата калия, содержащий небольшое количество соляной кислоты, и наблюдая за изменением силы тока при титровании этого раствора щелочью при определенном наложенном напряжении. [10]
История возникновения электрохимического метода анализа, описываемого в настоящей главе, несколько необычна. Метод был по существу два раза открыт и оба раза почти позабыт. Первый раз его описал Саломон1 в 1897 — 98 г. Саломон погрузил два посеребренных серебряных электрода в раствор нитрата калия, содержавший немного нитрата серебра, и установил, что сила тока, возникающего в цепи, зависит от приложенного напряжения и от концентрации нитрата серебра; в отсутствие нитрата серебра при небольшом напряжении ток через цепь не проходил. Саломон предположил, что сделанное им наблюдение можно использовать для количественного определения серебра и других металлов, титруя раствор соответствующим реактивом до прекращения тока. Он подчеркивал перспективы этого метода, который, по его мнению, должен обладать большой точностью, и рекомендовал заняться подробнее его разработкой. Однако этот призыв не нашел отклика, и лишь в 1905 г. появилась работа Нернста и Мер — риама2, которые провели кислотно-основное титрование, пользуясь двумя палладиевыми игольчатыми электродами, погруженными в раствор нитрата калия, содержащий небольшое количество соляной кислоты, и наблюдая за изменением силы тока при титровании этого раствора щелочью при определенном наложенном напряжении. [11]
История возникновения электрохимического метода анализа, описываемого в настоящей главе, несколько необычна. Метод был, по существу, два раза открыт и оба раза почти забыт. Первый раз его описал Саломон [1] в 1897 — 1898 гг.
Саломон погрузил два посеребренных серебряных электрода в раствор нитрата калия, содержавший немного нитрата серебра, и установил, что сила тока, возникающего в цепи, зависит от приложенного напряжения и от концентрации нитрата серебра; в отсутствие нитрата серебра при небольшом напряжении ток через цепь не проходил. Саломон предположил, что сделанное им наблюдение можно использовать для количественного определения серебра и других металлов, титруя раствор соответствующим реактивом до прекращения тока. Он подчеркивал перспективы этого метода, который, по его мнению, должен обладать большой точностью, и рекомендовал заняться подробнее его разработкой. Однако лишь в 1905 г. появилась работа Нернста и Мерриама [2], которые провели кислотно-основное титрование, пользуясь двумя палладиевыми игольчатыми электродами, погруженными в раствор нитрата калия, содержащий небольшое количество соляной кислоты, и наблюдая за изменением силы тока при титровании этого раствора щелочью при определенном наложенном напряжении. [12]
Источник: www.ngpedia.ru
Количественное определение
ФС Метод тиоцианатометрии. Предварительно проводят минерализацию колларгола и протаргола в колбе Кельдаля при кипячении в смеси с концентрированными серной и азотной кислотами для переведения связанного серебра в ионное состояние:

Затем образовавшиеся ионы серебра количественно определяют мeтодом тиоцианатометрии.
Метод основан на свойстве серебра нитрата количественно осаждаться аммония тиоцианатом. Вариант прямого титрования. Индикатор — железоаммонийные квасцы. Среда — азотнокислая (для предотвращения гидролиза индикатора).Титрант – раствор тиоцианата (роданида) амммония (см.AgNO3).
Стандартизация ЛВ проводится по содержанию серебра. Серебра в препарате должно быть не менее 70%, не менее 8% . fэкв(серебра ) =1
Хранение
В хорошо укупоренных банках оранжевого стекла в защищенном от света месте, чтобы не допустить разложения с образованием ионов серебра (колларгол — по списку Б).
Наружно в качестве вяжущих, антисептических, противовоспалительных средств. Колларгол применяют также в виде мазей. Применяют в виде водных растворов: глазных капель, капель для носа, растворов для промывания в урологии. В коллоидных препаратах серебра сохраняются лишь дезинфицирующие свойства серебра, а прижигающие – пропадают.
Формы выпуска
Соединения железа
ФП Железа (II) сульфат Ferri (II) sulfas (ЛH)
FeSO4 ·7Н2О Ferrous sulfate (MHH)
Растворением избытка железа восстановленного в растворе серной кислоты при нагревании до 80 0 С:
Раствор упаривают до кристаллизации и полученный железа (II) сульфат сушат при 30 0 C.
Прозрачные кристаллы светлого голубовато-зеленого цвета или кристаллический бледно-зеленый порошок. На воздухе выветривается.
Легко растворим в воде, растворим в спирте, глицерине.
Водные растворы имеют слабокислую реакцию среды, т.к. железа (II) сульфат подвергается гидролизу с выделением кислоты серной:
Химические свойства
Железа (II) сульфат проявляет: 1)восстановительные свойства, 2)вступает в реакции комплексобразования (о-фенантролин, сульфосалициловая кислота) и 3)осаждения. С раствором аммиака образует осадок железа (II) гидроксида светло-зеленого цвета, который на воздухе окисляется до железа (III) гидроксида — осадок бурого цвета:
Подлинность
На ион железа (II) ОФС
1. ФС Реакция осаждения калия гексацианоферратом (III) (калия феррицианидом). Образуется синий осадок железа (II) – гексацианоферрата (III) калия – «турнбулевая синь» в среде хлористоводородной кислоты разведенной:
2. ФС Реакция осаждения аммония сульфидом (нет в ОФС ГФ ХII). Образуется черный осадок железа (II) сульфида, растворимый в кислоте хлороводородной:
3. Фс Реакция на сульфат-ион (офс). Неофицинальные реакции
4. Реакция осаждения раствором натрия гидроксида или раствором аммиака:
Образуется светло-зеленый осадок железа (II) гидроксида, который на воздухе окисляется с образованием железа (III) гидроксида красно-коричневого цвета:
5. Со спиртовым раствором диметилглиоксима: образуется красное, нерастворимое в аммиаке соединение (очень чувствительная реакция).
Источник: studfile.net