Для объяснения ингибирующего действия серебра было предложено три основных механизма: вмешательство в перенос электрона, связывание ДНК, и взаимодействие с мембраной клетки. Формирование комплексов с сульфогидрильными группами может инактивировать ферменты поверхности клетки, и изменять процессы дыхания в мембране клетки.
Связанные с ДНК ионы серебра блокируют транскрипцию, а связанные с компонентами поверхности клетки прерывают дыхание бактерии и синтез АТФ (аденозинтрифосфата) [13]. У Candida albicans (но не у Escherichia coli) необратимое взаимодейстие ионов серебра с цистеиновым остатком в изомеразе фосфоманнозы прерывает синтез стенок клетки, что в свою очередь ведет к потере незаменимых питательных веществ [20].
Ионы серебра подавляют усвоение фосфатов, угнетают функции ДНК, ингибируют трансмембранный транспорт органических и неорганических веществ [19, 20]. Действие иона серебра на микробную клетку происходит в две стадии: 1) адсорбция; 2) активный транспорт иона в клетку.
Павел ПРИЛУЧНЫЙ на премьере «В КЛЕТКЕ-2». С 7 октября на ОККО
До 90% поглощенных ионов серебра задерживаются в мембране, метаболизм микробной клетки нарушается в результате инактивации ферментов и белков-переносчиков (пермеаз). С помощью электронной микроскопии показано, что под действием ионов серебра происходят морфологические изменения в бактериальных клетках [25]; сульфадиазин серебра также изменяет мембрану клетки бактерий Pseudomonas aeruginosa [26].
Обработанные клетки искажены по форме и имеют на поверхности пузыри. Штамм P.aeruginosa, стойкий к AgSD, не проявляет таких изменений. После обработки P.aeruginosa нитратом серебра, ни одно из этих изменений не фиксируется. Авторы предположили, что AgSD действует в зоне внешней мембраны клетки.
В работе [21] авторы выясняли природу связи серебро — полинуклеотиды на примере комплексов Ag(I) + (ДНК телячьего тимуса и РНК хлебопекарских дрожжей) в водных растворах с pH 7.1-6.6 при постоянной концентрации ДНК или РКН и различных концентрацях Ag (I). Спектроскопические результаты показали, что Ag (I) формирует с ДНК комплексы путем связывания катиона с гуанином (при низкой концентрации) и с аденином (при более высоких концентрациях), но не с боковыми фосфатными группами.
В работе [17] также изучали взаимодействие сульфадиазина серебра с изолированной ДНК. Показано, что взаимодействие идет в две конкурирующие стадии: слабая связь сульфадиазин-ДНК и сильная серебро-ДНК. Полученный комплекс отличается от того, который образуется с ДНК в присутствии нитрата серебра.
На примере P.Aeruginosa и E.Coli те же авторы показали [15] — даже не смотря на то, что добавление сульфадиазина серебра (AgSD) к чистой дезоксирибонуклеиновой кислоте (ДНК) ведет к образованию комплекса AgSD-ДНК, подобные комплексы не обнаруживаются в бактериях, обработанных AgSD. AgSD блокировал макромолекулярные синтезы в бактериях; синтез ДНК был несколько более чувствительным к этому ингибированию. Рибосомы, рибонуклеиновая кислота, и ДНК, выделенная из обработанных клеток, были абсолютно нормальны. Бактерии с дефицитом полимеразы ДНК не были более чувствительны к действию AgSD, чем их родительский штамм. Радиоактивный AgSD локализуется главным образом в цитоплазматической мембранной фракции обработанных клеток.
⚫️ T8 STONE | Продукт компании Вилави Т8 Стоун
Ионы серебра ингибируют поглощение и обмен фосфатов в Escherichia coli и взывают потерю накопленного фосфата — так же, как маннита, сукцината, глутамина и пролина [18]. Действие Ag+ блокируется тиолами и, в меньшей степени, бромидом. В присутствии N-этилмалеимида, Ag+ не вызывал утечку фосфата, но все еще ингибировал обмен внутриклеточным и внеклеточным фосфатом. Еще один механизм действия ионов серебра, особенно в низких концентрациях, представлен в [13]. Авторы показали, что низкие концентрации Ag+ вызывают массовую утечку протонов через мембрану Vibrio cholerae, которая заканчивается полной «деэнергизацией» и, с высокой степенью вероятности, смертью клетки.
Авторами [14] была исследована способность поглощать ионы Ag+, Cd+ 2 , Cu+ 2 , и La+ 3 из растворов на примере Bacillus cereus, B.subtilis, Escherichia coli и Pseudomonas aeruginosa. Поглощение Ag+ из раствора бактериями происходит очень эффективно; из 1 мМ раствора было удалено примерно 89 % общего количества, Ag+; для Cd+ 2 , Cu+ 2 и La+ 3 эти значения были на уровне 12, 29, и 27 % общего количества соответственно. Серебро, сорбировалось в виде дискретных коллоидных агломератов на поверхности клетки и иногда в цитоплазме. Микробиоцидная способность металлов менялась в том же порядке — Ag > La > Cu > Cd.
«Еще в 1919 году Заус проследил отложение серебра в теле микроорганизмов и установил, что различные бактерии фиксируют неодинаковое количество серебра в зависимости от своего размера. Так, дрожжи в разведении 1:10 5 накапливали до 5% серебра по отношению к сухому весу, а более мелкие бактерии (например, Escherichia coli) — соответственно меньше» [32]. В работе [20] количественные измерения разрушенных клеток дрожжей после центрифугирования показали, что у Candida utilis 90% Ag+ накапливается во фракции клеточных стен и мембран. Протопласты связывают ионы серебра также быстро, как и целые клетки, однако гибнут гораздо быстрее.
В работе [25] изучали олигодинамическое действие металлов — алюминия, сурьмы, висмута, кадмия, кобальта, меди, золота, железа, свинца, марганца, ртути, никеля, платины, серебра, олова, титана, и цинка на Bacillus subtilis (1 штамм), Enterobacteriaceae (26 штаммов), Legionellaceae (13 штаммов), Micrococcaceae (6 штаммов), и Pseudomonas aeruginosa (4 штамма). B.subtilis и Legionellaceae показали самую высокую восприимчивость. Восприимчивость различных бактерий к олигодинамическому действию небольшого количества металлов значительно отличается; непатогенные микрококки и стафилококки были более восприимчивы, чем S.aureus. Группа грам- отрицательных была самой стойкой.
Авторы [20] одними из первых предположили, что в основе олигодинамического действия серебра лежит механизм взаимодействия c тиоловыми группами ферментов. Для выяснения механизма действия и дезактивации соединений серебра авторы [54] исследовали способность аминокислот (например, цистеина CySH) и других соединения (например, тиогликолята натрия), содержащих тиоловые группы (-SH), нейтрализовать активность нитрата серебра против Pseudomonas aeruginosa PAOl.
Аминокислоты с дисульфидными связями также снижают активность серебра, за исключением диметилового эфира L-цистина и других аминокислот без сульфогруппы. При блокировании сульфогруппы цистеина путем реакции с йодацетамидом, образующийся комплекс CyS-ацетамид не способен нейтрализовать активность Ag+.
Химические исследования с использованием циклической вольтамперометрии продемонстрировали, что высокие координационные числа (3:1) получаются при использовании тиолсодержащих аминокислот и низкие (0-280-4) — с другими аминокислотами. Тропность Ag+ к тиоловым группам белков микробов также подтверждена методом аргентометрического титрования с 0,1М раствором нитрата серебра [20].
Как микробиологические, так и химические результаты демонстрируют, что взаимодействие Ag+ с тиоловыми группами играет существенную роль в инактивации бактерий [24, 26]. В работе [19] уточняется причина того, что протеины также снижают антибактериальную активность серебра: «Ricketts (1970) обнаружил, что катионы серебра проявляют бактерицидные свойства в воде, но не в бульоне» — катионы серебра реагирует с сульфогидрильными группами белков. С одной стороны, этот процесс и является одним из механизмов антибактериальной активности серебра; с другой стороны, растворы «Серебряных протеинов» антибактериальны только потому, что в них еще присутствует небольшое количество серебряных ионов. Серебро химически связывает скелетные и в функциональные протеины бактерий в виде органических сульфидов, а также производит структурные изменения в бактериях и взаимодействует с нуклеиновыми кислотами. Инактивация антимикробной активности серебра тиогликолятом и тиосульфатом также отмечается в работе [20].
Среди металлов серебро обладает наиболее сильным бактерицидным действием. При этом взаимодействие не самого металла, а его ионов с клетками микроорганизмов вызывает их гибель.
Выявлено, что бактерицидный эффект ионизированного серебра в 1750 раз сильнее карболовой кислоты и в 3,5 раза сильнее сулемы и хлорной извести. Причем спектр противомикробного действия серебра значительно шире многих антибиотиков и сульфаниламидов. Серебро обладает более мощным антимикробным эффектом, чем пенициллин, биомицин и другие антибиотики, и оказывает губительное действие на штаммы (разновидности) бактерий, устойчивые к антибиотикам [29].
Серебро проявляет высокую бактерицидную активность как по отношению к аэробным и анаэробным микроорганизмам (в том числе и к разновидностям, устойчивым к антибиотикам), так и к некоторым вирусам и грибам.
Исследования показали, что чувствительность разных патогенных и непатогенных организмов к серебру неодинакова. Патогенная микрофлора намного более чувствительна к ионам серебра, чем непатогенная. Поэтому серебро действует избирательно, в большей степени уничтожая вредные микроорганизмы.
Механизм действия серебра на микробную клетку заключается в том, что ионы серебра поглощаются клеточной оболочкой микроба, в результате чего его клетка остается жизнеспособной, но при этом нарушаются некоторые ее функции, например деление (бактериостатический эффект).
Таким образом доказано, что ионы серебра оказывают различное противомикробное действие — от бактерицидного (способность убивать микробы) до бактериостатического (способность препятствовать размножению микробов) [56].
Источник: studbooks.net
Ученые установили, как белковое окружение наночастиц серебра влияет на их клеточную токсичность
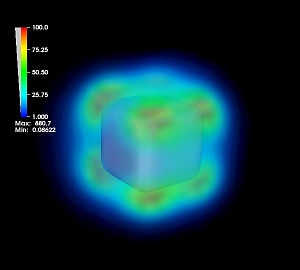
Усиление интенсивности электрического поля вблизи повехности наночастицы серебра при возбуждении плазмонного резонанса. Источник: Владимир Боченков
Старшему научному сотруднику химического факультета МГУ Владимиру Боченкову совместно с коллегами из Дании удалось расшифровать механизм взаимодействия наночастиц серебра с клетками иммунной системы. Результаты исследования опубликованы в высокорейтинговом журнале Nature Сommunications.
«В настоящее время в мире производится большое количество продукции, содержащей наночастицы серебра: антибактериальные препараты, зубная паста, лаки, краски, фильтры, упаковка, медицинские и текстильные изделия. В основе действия этой продукции лежит способность серебра при окислении растворяться с образованием ионов серебра Ag + , имеющих бактерицидные свойства. При этом имеются данные исследований in vitro, свидетельствующие о токсичности наночастиц серебра для различных органов, включая печень, мозг и легкие. В этой связи принципиально важно изучение процессов, происходящих с наночастицами серебра в биологических средах, и факторов, влияющих на их токсичность», — говорит Владимир Боченков.
В работе изучалась белковая корона — слой адсорбированных белковых молекул, формирующийся на поверхности наночастиц серебра при их попадании в биологическую среду, например, в кровь. Белковая корона маскирует наночастицы и во многом определяет их дальнейшую судьбу: скорость выведения из организма, способность проникновения в клетки определенного типа, распределение между органами и т.д.
Согласно новейшим научным исследованиям белковая корона состоит из двух слоев: жесткой короны (hard corona) — молекул белка, прочно связанных с наночастицей серебра, и мягкой короны (soft corona), состоящей из слабо связанных молекул белка, находящихся в динамическом равновесии с раствором. До настоящего времени мягкая корона была изучена очень слабо из-за экспериментальных сложностей: при отделении наночастиц от белкового раствора слабо связанные молекулы белка десорбируются (покидают частицу, оставаясь в растворе), оставляя на поверхности наночастиц только жесткую корону. Размер изучавшихся в работе наночастиц серебра составляет 50-88 нм, а диаметр белков, образующих корону — 3-7 нм. Ученым удалось исследовать наночастицы серебра с белковой короной in situ, то есть не извлекая их из биологической среды. Благодаря использованию явлению локализованного поверхностного плазмонного резонанса для зондирования среды вблизи поверхности наночастицы серебра впервые были исследованы функции мягкой короны.
«В нашей работе было показано, что корона может влиять на способность наночастицы растворяться с образованием катионов серебра Ag + , которые определяют токсический эффект. В отсутствие мягкой короны (быстро обменивающегося со средой белковым слоем) катионы серебра связываются при взаимодействии с серосодержащими аминокислотами сывороточной среды, в особенности цистеином и метионином, и осаждаются в виде нанокристаллитов Ag2S в жесткой короне», — рассказывает Владимир Боченков.
Как известно, сульфид серебра Ag2S легко образуется на поверхности серебра даже на воздухе в присутствии следов сероводорода. Сера также входит в состав многих биомолекул, содержащихся в организме человека, при реакции с которыми серебро может превращаться в сульфид. Формирование нанокриталлитов Ag2S из-за низкой растворимости снижает биодоступность ионов Ag + , сводя токсичность наночастиц серебра на нет. При достаточном количестве доступных для реакции молекул аминокислот-источников серы все потенциально токсичное серебро преобразуется в частицы нетоксичного нерастворимого сульфида. Учёные показали, что так происходит в случае отсутствия мягкой короны.
При наличии мягкой короны нанокристаллиты сульфида серебра Ag2S образуются в меньшем количестве или не образуются совсем. Ученые объясняют это тем, что слабо связанные белковые молекулы переносят ионы Ag + от наночастицы в раствор, тем самым не оставляя возможности кристаллизоваться сульфиду. Таким образом, белки мягкой короны являются транспортом для ионов серебра.