
Амфотерность – способность веществ проявлять кислотные или основные свойства в зависимости от реагента. Так, оксид алюминия, с кислотными оксидами и кислотами ведёт себя как основный оксид, а со щелочами и основными оксидами – как кислотный оксид.
Какие оксиды называют амфотерными?
К амфотерным относят в основном оксиды металлов +3 и +4 степени окисления, но также можно встретить амфотерные оксиды и в степени окисления «+2».
Таблица 1. – Примеры амфотерных оксидов в различных степенях окисления
Амфотерные оксиды. Получение, химические свойства, образование средних и комплексных солей
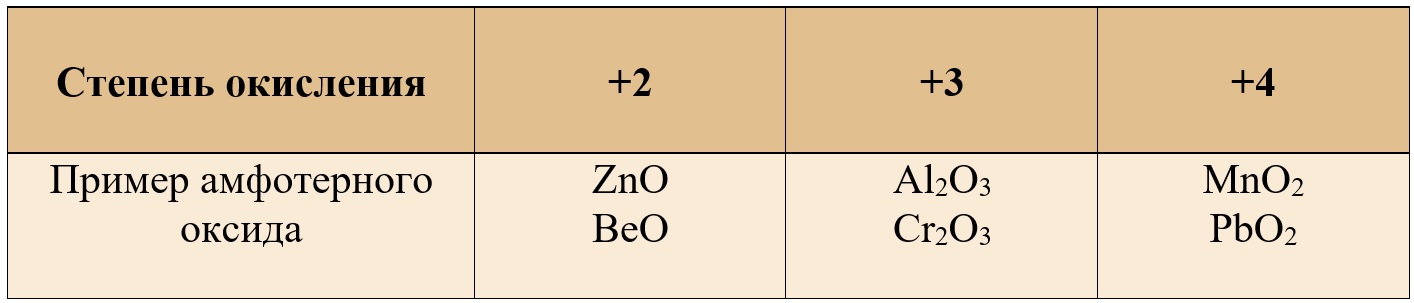
Примеры амфотерных оксидов
В таблице представлены лишь самые популярные примеры оксидов, встречающихся на ЕГЭ, многие другие оксиды при различных условиях реагируют как со щелочами, так и с кислотами.
Cream Soda & Хлеб — Плачу на техно (премьера клипа)
Подробнее о классификации оксидов можно узнать в статье Классификация оксидов
Амфотерность – способность веществ проявлять кислотные или основные свойства в зависимости от реагента. Так, оксид алюминия, с кислотными оксидами и кислотами ведёт себя как основный оксид, а со щелочами и основными оксидами – как кислотный оксид.
Химические свойства амфотерных оксидов
- Амфотерные оксиды проявляют свойств основных оксидов в реакции с кислотами:
- Амфотерные оксиды проявляют основность при реакции с кислотными оксидами:
- Амфотерные оксиды проявляют свойства кислотных оксидов при взаимодействии со щелочами (растворимыми основаниями). При этом реакция осуществима как в растворах с концентрированными щелочами, так и при сплавлении.
В растворах:
Полученную соль называют тетрагидроксоцинкат натрия
Полученную соль называют тетрагидроксоалюминат натрия.
Формула полученной соли зависит от количества воды и щелочи, вступивших в реакцию, так в избытке щелочи образуется гексагидроксоалюминат, а не тетрагидроксоалюминат:
При сплавлении:
Полученная соль называется цинкат натрия.
Полученная соль называется алюминатом калия (метаалюминат)
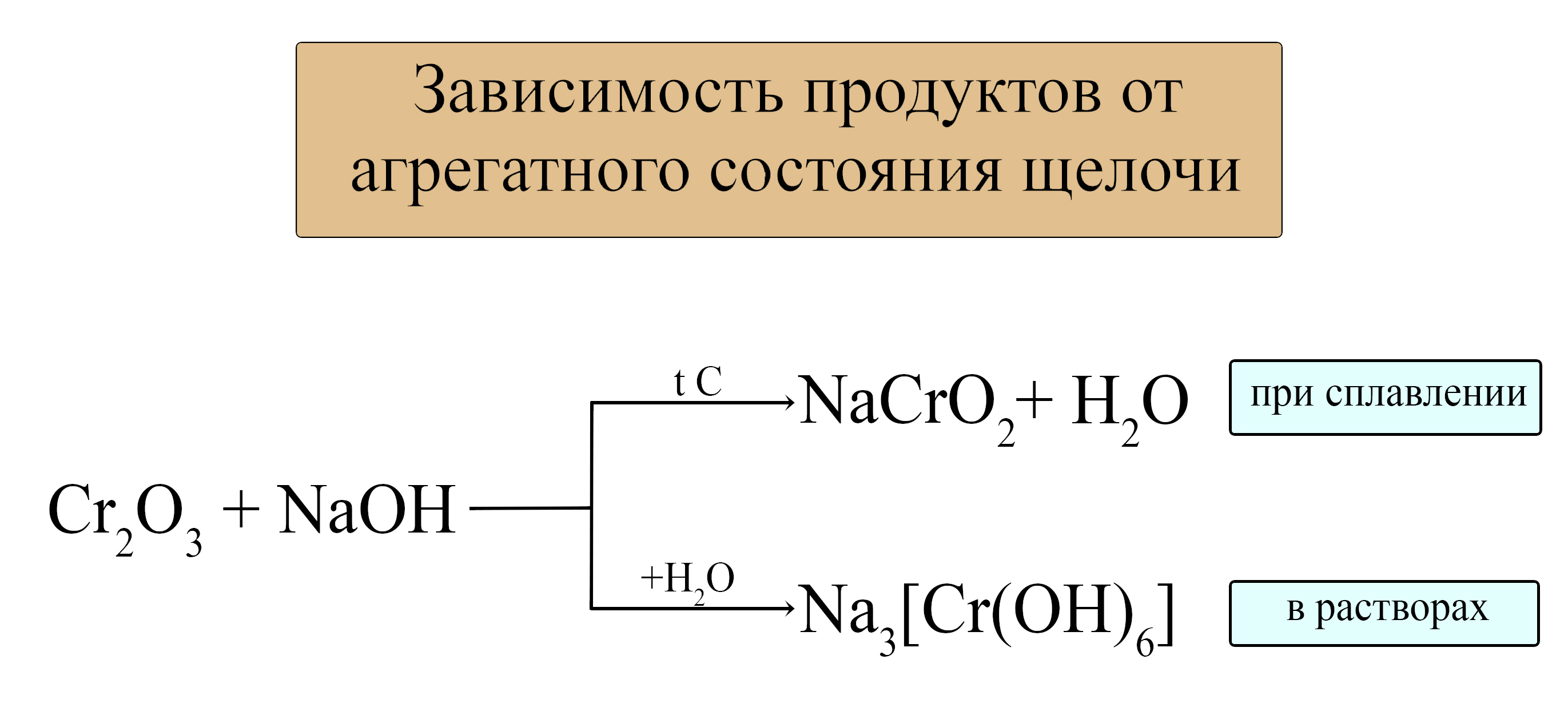
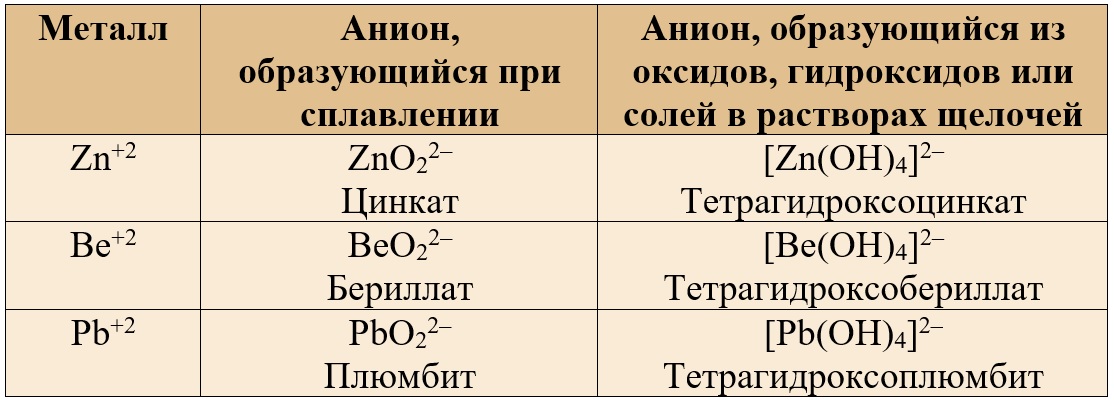
В следующих таблицах приведены некоторые средние и комплексные анионы, в состав которых входят амфотерные металлы.
Таблица 2. – Анионы, содержащие амфотерные металлы в валентности II.
Cream Soda — Никаких больше вечеринок
Таблица 3. – Анионы, содержащие амфотерные металлы в валентности III.
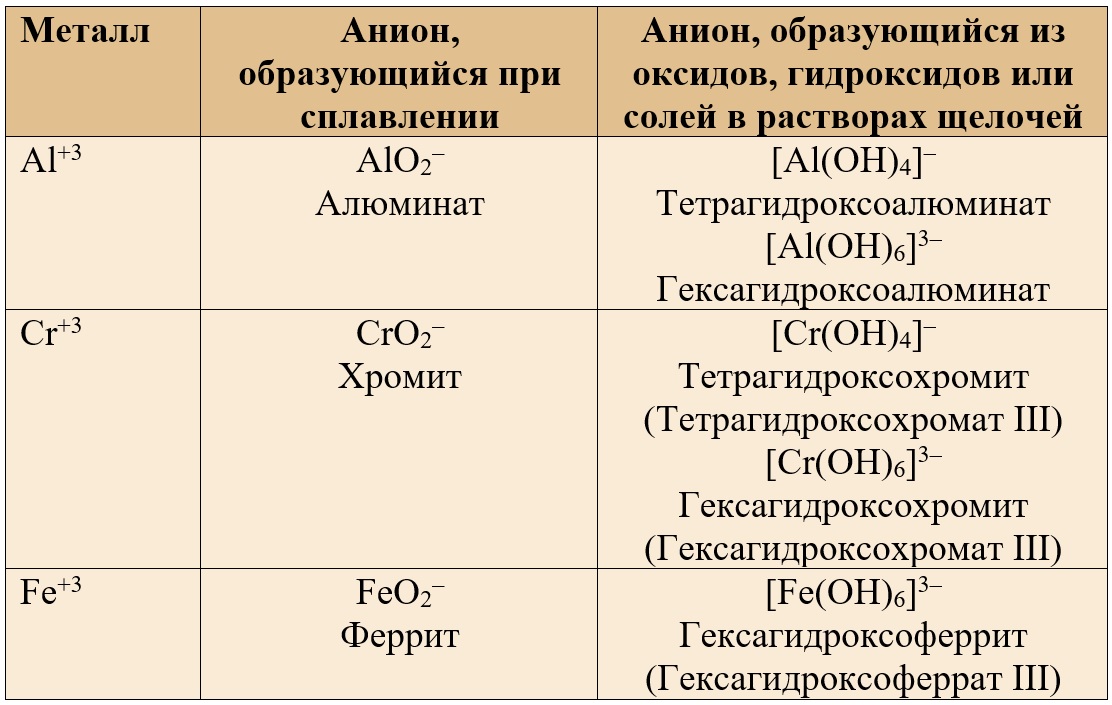
Соли с координационным числом «6» образуются в сильном избытке щелочи.
Таблица 4. – Наиболее распространенные ионы, содержащие амфотерные металлы в валентности IV.
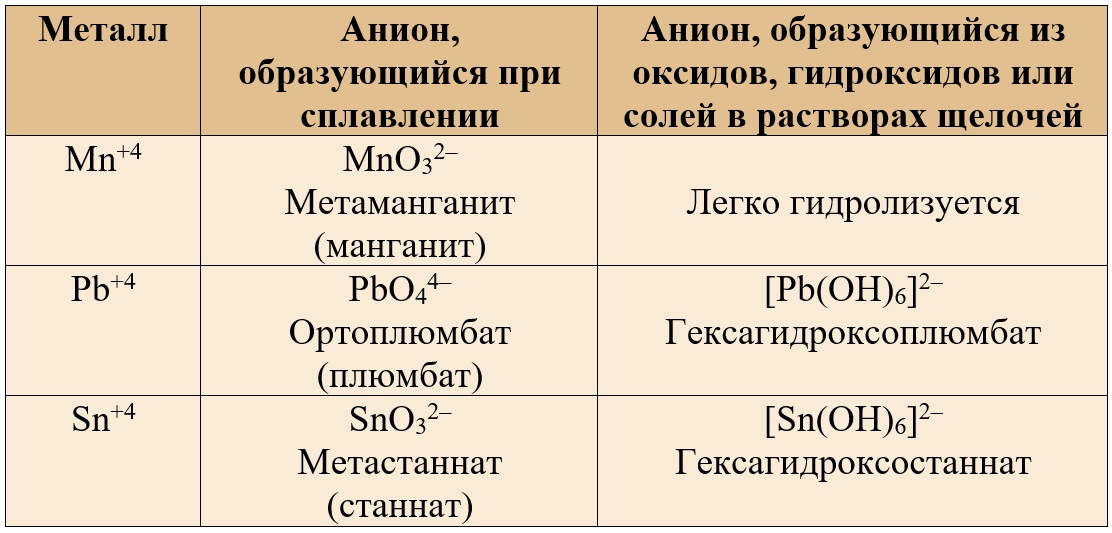
Пользуясь данными таблицами, можно назвать многие соли, например, средние соли:
KAlO2 – алюминат калия
NaAlO2 – алюминат натрия
BaZnO2 – цинкат бария
CaBeO2 – бериллат кальция
K2PbO2 – плюмбит калия, содержит свинец (II)
BaPbO2 – плюмбит бария
K4PbO4 – плюмбат (ортоплюмбат) калия, содержит свинец (IV)
KCrO2 – хромит калия
NaFeO2 – феррит натрия
И комплексные соли:
K[Al(OH)4] – тетрагидроксоалюминат калия
K3[Al(OH)6] – гексагидроксоалюминат калия
Na2[Zn(OH)4] – тетрагидроксоцинкат натрия
Ca[Zn(OH)4] – тетрагидроксоцинкат кальция
K2[Be(OH)4] – тетрагидроксобериллат калия
Ba[Be(OH)4] – тетрагидроксобериллат бария
Na2[Pb(OH)4] – тетрагидроксоплюмбит натрия
Na2[Pb(OH)6] – гексагидроксоплюмбат натрия
Ca[Sn(OH)6] – гексагидроксостаннат кальция
Na[Cr(OH)4] – тетрагидроксохромит натрия
K3[Cr(OH)6] – гексагидроксохромит калия
Ca3[Cr(OH)6] – гексагидроксохромит кальция
Na3[Fe(OH)6] – гексагидроксоферрит натрия
Как составлять формулы безводных солей?
Например, в реакции участвовал оксид свинца IV и оксид кальция:
В первую очередь необходимо знать остатки соответствующих кислот, следовательно и формулы кислот, содержащих амфотерный металл. И хоть многие из них не выделены, теоретически мы можем установить их формулы. Для амфотерных металлов в III и IV валентности можно установить орто- и мета-формулы кислот. Для металлов в II валентности выделяют только одну форму кислоты, поэтому для них не указывают уточняющую приставку «орто-» или «мета-», а вывод формулы соответствует выводу как орто- так и мета-формул кислот и их остатков у металлов в III и IV валентности.
Орто-формула соответствует гидроксиду амфотерного металла с учетом того, что в кислоте порядок элементов меняется (водород должен стоять на первом месте).
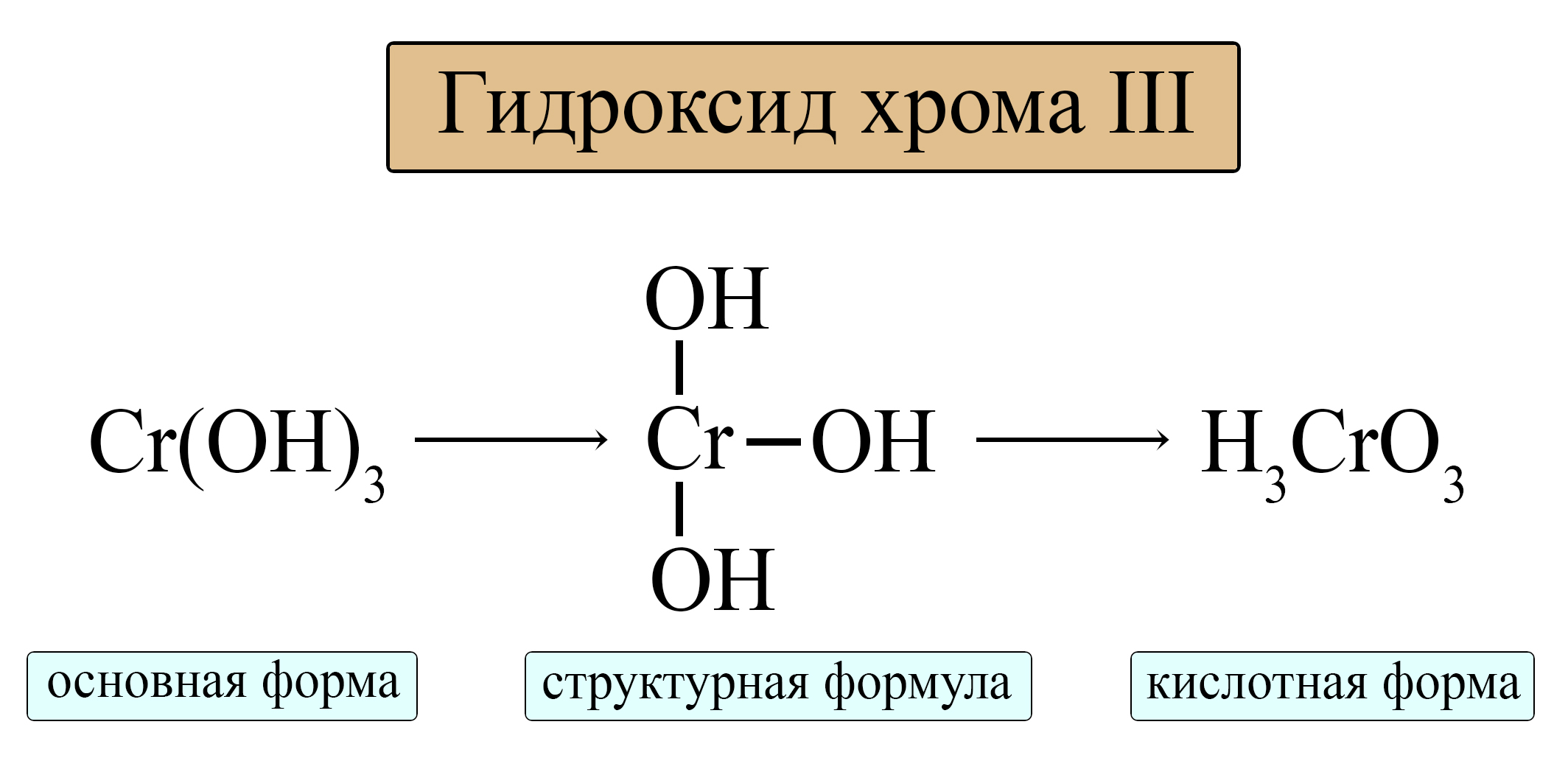
Таблица 5. – Амфотерные оксиды и кислотные остатки, соответствующие им
Для амфотерных металлов в III валентности можно выделить общую формулу орто-кислоты и орто-аниона: H3MeO3 и MeO3 3- .
Для амфотерных металлов в IV валентности можно выделить общую формулу орто-кислоты и орто-аниона: H4MeO4 и MeO4 4- .
Таким образом, в реакции оксида свинца IV и оксида кальция можно получить ортоплюмбат кальция:
PbO2 + 2CaO = Ca2PbO4 (ортоплюмбат кальция)
Для этих же металлов можно вывести мета-формулы кислот и их остатков, для этого при образовании формулы используются наименьшие значения индексов. Так, формула орто-хромистой кислоты, как и любого другого гидроксида в кислотной форме, начинается с водорода, а заканчивается кислородом, степень окисления хрома «+3» учитывается при установке индексов:
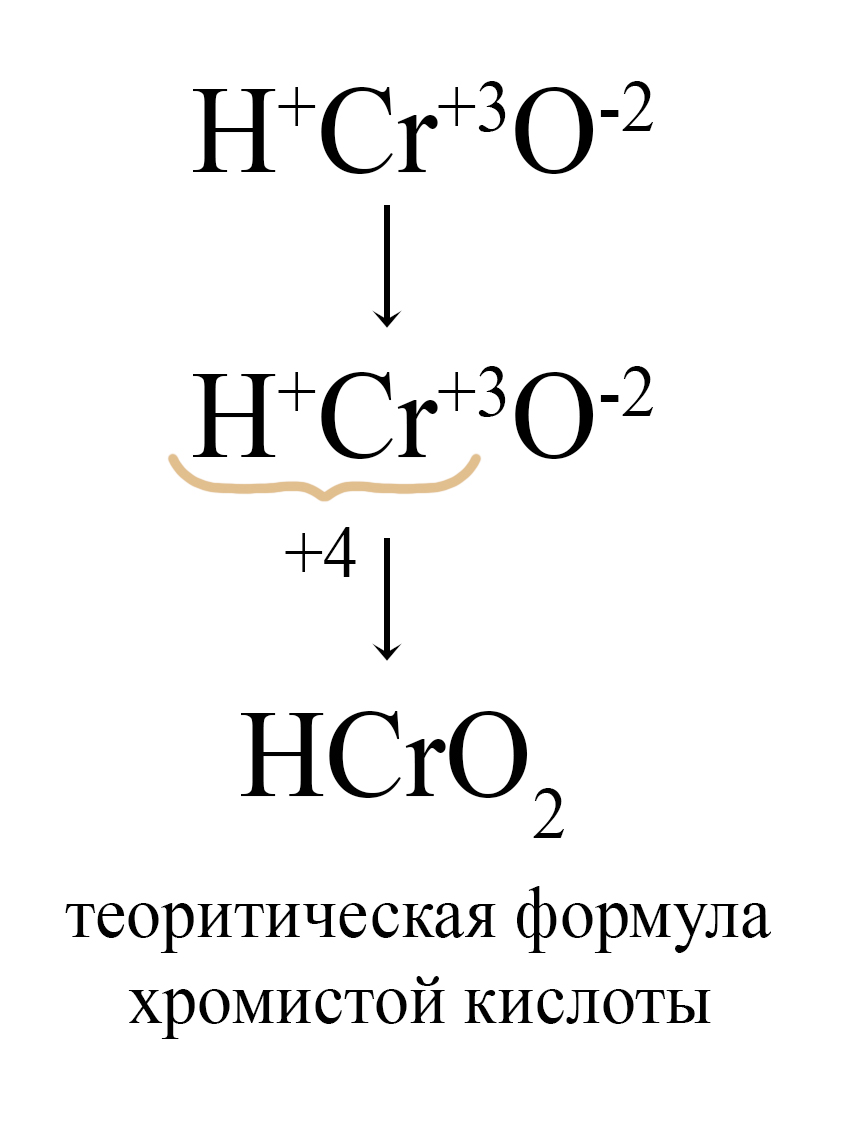
Подробнее о таком способе можно прочитать в статье Свойства кислотных оксидов
Таким образом, оксиду алюминия и оксиду свинца IV соответствуют следующие мета-формулы:
Таблица 6. – Амфотерные оксиды и кислотные остатки, соответствующие им
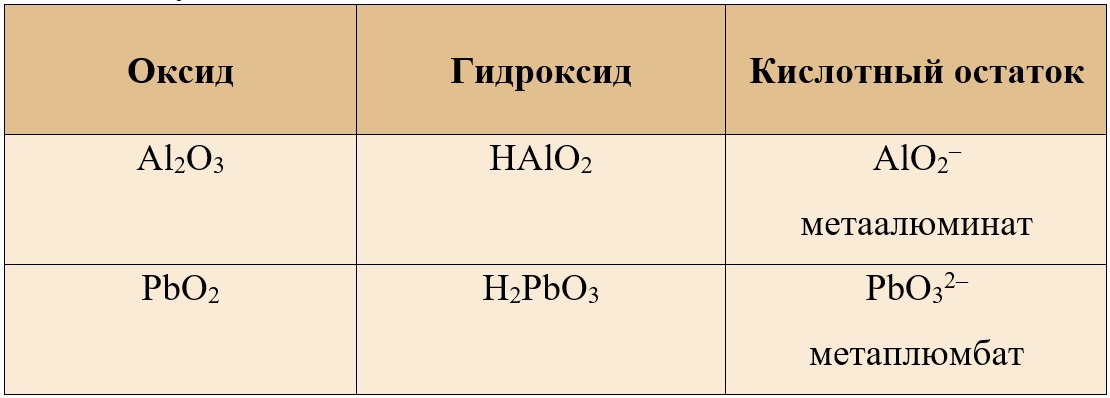
Поэтому в реакции между оксидом кальция и диоксидом свинца может образоваться и метаплюмбат кальция.
- Амфотерные оксиды проявляют свойства кислотных в реакциях с основными оксидами. Реакция происходит при сплавлении:
ZnO + CaO = CaZnO2 – цинкат кальция
Al2O3 + SrO = Sr(AlO2)2 – алюминат (метаалюминат) стронция
- Амфотерные оксиды способны вытеснять летучие оксиды из солей:
Получение амфотерных оксидов
- Термическое разложение амфотерных гидроксидов:
- Прямым взаимодействием металла с кислородом:
Данная реакция не подходит для получения оксида железа III, так как при окислении железа образуется двойной оксид Fe3O4.
- Термическим разложением нитратов. Причем, если в состав катиона входит металл с переменной степенью окисления, в продукте его степень окисления может измениться:
Оксиды хрома и железа в III валентности разлагаются без изменения степени окисления металла:
- Окислением оксидов с более низкой степенью окисления:
Источник: onlineclass.space
Как определить тип оксида?

В заданиях ЕГЭ есть такие вопросы, где требуется определить тип оксида. Прежде всего, следует запомнить четыре типа оксидов:
Основные, кислотные и амфотерные оксиды часто также объединяют в группу солеобразующих оксидов.
Не вдаваясь в теоретические подробности, изложу пошаговый алгоритм определения типа оксида.
Первое — определите: оксид металла перед вами или оксид неметалла.
Второе — установив, какой оксид металла или неметалла перед вами, определите степень окисления элемента в нем и воспользуйтесь таблицей ниже. Естественно, правила отнесения оксидов в этой таблице нужно выучить. Поначалу можно решать задания, подглядывая в нее, но ваша цель ее запомнить, так как на экзамене никаких источников информации, кроме таблицы Д.И. Менделеева, таблицы растворимости и ряда активности металлов, у вас не будет.
1) Степень окисления неметалла +1 или +2
Вывод: оксид несолеобразующий
Исключение: Cl2O не относится к несолеобразующим оксидам
1) Степень окисления металла равна +1, +2
Вывод: оксид металла основный
Исключение: BeO, ZnO, SnO и PbO не относятся к основным оксидам!!
2) Степень окисления больше либо равна +3
Вывод: оксид кислотный
Исключение: Cl2O относится к кислотным оксидам, несмотря на степень окисления хлора +1
2) Степень окисления металла +3, +4,
Вывод: оксид амфотерный.
Исключение: BeO, ZnO, SnO и PbO амфотерны, несмотря на степень окисления +2 у металлов
3) Степень окисления металла +5,+6,+7
Вывод: оксид кислотный.
Примеры:
Задание: определите тип оксида MgO.
Решение: MgO является оксидом металла, при этом степень окисления металла в нем +2. Все оксиды металлов в степени окисления +1 и +2 основны, кроме оксида бериллия или цинка.
Ответ: MgO – основный оксид.
Задание: определите тип оксида Mn2O7
Решение: Mn2O7 – оксид металла, и степень окисления металла в этом оксиде равна +7. Оксиды металлов в высоких степенях окисления (+5,+6,+7) относятся к кислотным.
Ответ: Mn2O7 – кислотный оксид
Задание: определите тип оксида Cr2O3.
Решение: Cr2O3 – оксид металла, и степень окисления металла в этом оксиде равна +3. Оксиды металлов в степенях окисления +3 и +4 относятся к амфотерным.
Ответ: Cr2O3 – амфотерный оксид.
Задание: определите тип оксида N2O.
Решение: N2O – оксид неметалла, и степень окисления неметалла в этом оксиде равна +1. Оксиды неметаллов в степенях окисления +1 и +2 относятся к несолеобразующим.
Ответ: N2O – несолеобразующий оксид.
Задание: определите тип оксида BeO.
Решение: оксид бериллия, а также оксид цинка являются исключениями. Несмотря на степень окисления металлов в них, равную +2, они амфотерны.
Ответ: BeO – амфотерный оксид.
С химическими свойствами оксидов можно ознакомиться здесь
Источник: scienceforyou.ru
Амфотерные соединения

Некоторые элементы (почти все металлы, проявляющие степени окисления +1 и +2) образуют основные оксиды и гидроксиды. Например, калий образует оксид K2O, и гидроксид KOH. Они проявляют основные свойства, например взаимодействуют с кислотами.
K2O + HCl → KCl + H2O
Некоторые элементы (большинство неметаллов и металлы со степенями окисления +5, +6, +7) образуют кислотные оксиды и гидроксиды. Кислотные гидроксиды – это кислородсодержащие кислоты, их называют гидроксидами, потому что в строении есть гидроксильная группа, например, сера образует кислотный оксид SO3 и кислотный гидроксид H2SO4 (серную кислоту):

Такие соединения проявляют кислотные свойства, например они реагируют с основаниями:
H2SO4 + 2KOH → K2SO4 + 2H2O
А есть элементы, образующие такие оксиды и гидроксиды, которые проявляют и кислотные, и основные свойства. Это явление называется амфотерностью. Таким оксидам и гидроксидам и будет приковано наше внимание в этой статье. Все амфотерные оксиды и гидроксиды — твердые вещества, нерастворимые в воде.
Для начала, как определить является ли оксид или гидроксид амфотерным? Есть правило, немного условное, но все-таки пользоваться им можно:
Амфотерные гидроксиды и оксиды образуются металлами, в степенях окисления +3 и +4, например (Al2O3, Al(OH)3, Fe2O3, Fe(OH)3)
И четыре исключения: металлы Zn, Be, Pb, Sn образуют следующие оксиды и гидроксиды: ZnO, Zn(OH)2, BeO, Be(OH)2, PbO, Pb(OH)2, SnO, Sn(OH)2, в которых проявляют степень окисления +2, но не смотря на это, эти соединения проявляют амфотерные свойства.
Свойства амфотерных соединений запомнить не сложно: они взаимодействуют с кислотами и щелочами .
- с взаимодействием с кислотами все просто, в этих реакциях амфотерные соединения ведут себя как основные:
Точно так же реагируют гидроксиды:
Источник: distant-lessons.ru