Существует 3 вида оксида меди. Отличаются они друг от друга валентностью. Соответственно, существуют одновалентный, двухвалентный и трехвалентный оксиды меди. Каждый из оксидов имеет свои химические свойства.

Статьи по теме:
- Химические свойства оксида меди
- Как получить хлорид меди
- Как получить нитрат меди
Инструкция
Оксид меди (I) — Cu2O. В природе его можно встретить в виде минерала куприта. Также известны такие его названия, как закись меди, гемиоксид меди и оксид димеди. Оксид меди (I) относится к группе амфотерных оксидов.
Химические свойства
Cu2O не реагирует с водой. Оксид меди (I) диссоциирует в минимальной степени:
Cu2O+H2O=2Cu(+)+2OH(-).
Cu2O можно перевести в раствор следующими путями:
— Окисление:
Cu2O+6HNO3=2Cu(NO3)2+3H2O+2NO2;
Реакция обмена между оксидом меди и серной кислотой
2Cu2O+8HCl+O2=4CuCl2+4H2O.
— Реакция с концентрированной соляной кислотой:
Сu2O+4HCl=2H[CuCl2]+H2O.
— Реакция между оксидом меди (I) и концентрированной щелочью:
Cu2O+2OH(-)+H2O=2[Cu(OH)2](-).
— Реакция с концентрированными растворами солей аммония:
Cu2O+2NH4(+)=2[Cu(H2O)(NH3)](+).
— Реакция с концентрированным гидратом аммиака:
Cu2O+4(NH3*H2O)=2[Cu(NH3)2]OH+3H2O.
Cu2O в водном растворе может осуществлять следующие реакции:
— Окисление кислородом до Cu(OH)2:
2Cu2O+4H2O+O2=4Cu(OH)2.
— В реакции с разбавленными галогенводородными кислотами (вместо HHal можно поставить Cl, I, Br) образуется галогениды меди:
Cu2O+2HHal=2CuHal+H2O.
— Реакция с разбавленной серной кислотой является диспропорционированием. То есть оксид меди (I) является и окислителем и восстановителем одновременно:
Cu2O+H2SO4=CuSO4+Cu+H2O.
— Реакция восстановления до Cu гидросульфитом натрия, или любыми другими типичными восстановителями:
2Cu2O+2NaHSO3=4Cu+Na2SO4+H2SO4.
Оксид меди (II) — CuO. Также известно название окись меди. В обычных школах (не специализирующихся на химии) именно его изучают. Это основной оксид, двухвалентный. В природе оксид меди (II) встречается в виде минерала мелаконита или его еще называют теноритом.
Химические свойства

Оксид меди (III) — Cu2O3 — окисел металла меди. Является сильным окислителем.
Химические свойства
— Оксид меди (III) не растворяется в воде.
— Разложение происходит при воздействии температуры:
2Cu2O3=4CuO+O2 (температура 400оС).
— В ходе реакции оксида меди (III) с хлороводородом происходит выделение хлора;
Качественная реакция на оксид меди
— При реакциях с щелочами образуются красные тетрагидроксокупраты (III) (нестойкие).
Две последние реакции довольно сложные, их использование встречается только в профилирующих учреждениях.
Обратите внимание
Чаще всего для изучения используется оксид меди (II). Два других оксида изучаются и используются в специализированных учреждениях.
Полезный совет
Оксиды меди могут вызвать раздражение глаз, кожи, дыхательных путей. Выполнение различных реакций оксидов разрешено только в специально оборудованных помещениях.
- Получение медного купороса
Совет полезен?
Статьи по теме:
- Как найти сторону квадрата, если известна его диагональ
- Как восстановить медь из её оксида
- Как доказать характер оксида
Добавить комментарий к статье
Похожие советы
- Как написать формулы оксидов, соответствующих гидроксидам
- Вреден ли оксид меди
- Неорганические вещества: примеры и свойства
- Как получить гидроксид
- Как найти длину волны
- Как окислить медь
- Как вычислить диагональ квадрата
- Физические и химические свойства гидросульфата натрия
- Как найти площадь оснований пирамиды
- Что такое макромир
- Что такое диаметр
- Как определить сульфаты железа
- Как определить формальдегид
- Как найти центральный угол
- Как определить характер оксида
- Цветет ли папоротник?
- Примеры полупроводников, типы, свойства
- Как снять ошибку
Источник: www.kakprosto.ru
Соединения меди
Как и все d-элементы, соединения меди ярко окрашены.
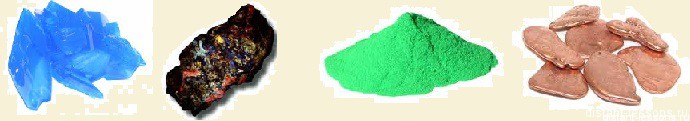
Так же как у хрома, у меди наблюдается провал электронов — с s-орбитали на d-орбиталь
Электронное строение атома:
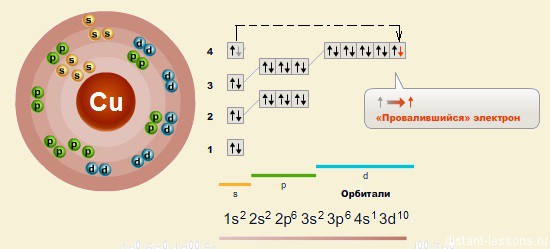
Соответственно, существуют 2 характерные степени окисления меди: +2 и +1.

Простое вещество: металл золотисто-розового цвета.
Оксиды меди: Сu2O оксид меди (I) оксид меди 1 — красно-оранжевого цвета
СuO оксид меди (II) оксид меди 2 — черного цвета.
Другие соединения меди Cu(I), кроме оксида, неустойчивы.
Соединения меди Cu(II) — во-первых, стабильны, во-вторых, голубого или зеленоватого цвета.
Почему зеленеют медные монеты? Медь в присутствии воды взаимодействует с углекислым газом воздуха, образуется СuCO3 — вещество зеленого цвета.
Еще одно окрашенное соединение меди — сульфид меди (II) — осадок черного цвета.
Медь, в отличие от других элементов, стоит в ряду напряжений после водорода, поэтому не выделяет его из кислот:
- с горячей серной кислотой: Сu + 2H2SO4 = CuSO4 + SO2 + 2H2O
- с холодной серной кислотой: Сu + H2SO4 = CuO + SO2 + H2O
- с концентрированной азотной кислотой:
Cu + 4HNO3 = Cu(NO3)2 + 4NO2 + 4H2O - с разбавленной азотной кислотой:
3Cu + 8HNO3 = 3 Cu(NO3)2 + 2NO +4 H2O
Пример задачи ЕГЭ С2 вариант 1:
Нитрат меди прокалили, полученный твёрдый осадок растворили в серной кислоте. Через раствор пропустили сероводород, полученный чёрный осадок подвергли обжигу, а твёрдый остаток растворили при нагревании в азотной кислоте.
2Сu(NO3)2 → 2CuO↓ +4 NO2↑ + O2↑
Твердый осадок — оксид меди (II).
CuO + H2S → CuS↓ + H2O
Сульфид меди (II) — осадок черного цвета.
«Подвергли обжигу» — значит, произошло взаимодействие с кислородом. Не путайте с «прокаливанием». Прокалить — нагреть, естественно, при высокой температуре.
2СuS + 3O2 = 2CuO + 2SO2
Твердый остаток — это СuO — если сульфид меди прореагировал полностью, СuO + CuS — если частично.
СuO + 2HNO3 = Cu(NO3)2 + H2O
CuS + 2HNO3 = Cu(NO3)2 + H2S
возможна так же другая реакция:
СuS + 8HNO3 = Cu(NO3)2 + SO2 + 6NO2 + 4H2O
Пример задачи ЕГЭ С2 вариант 2:
Медь растворили в концентрированной азотной кислоте, полученный газ смешали с кислородом и растворили в воде. В полученном растворе растворили оксид цинка, затем к раствору прибавили большой избыток раствора гидроксида натрия.
В результате реакции с азотной кислотой образуется Сu(NO3)2, NO2 и O2.
NO2 смешали с кислородом — значит, окислили: 2NO2 + 5O2 = 2N2O5. Cмешали с водой: N2O5 + H2O = 2HNO3.
ZnO + 2HNO3 = Zn(NO3)2 + 2H2O
Источник: distant-lessons.ru
Оксид меди (I, II, III): свойства, получение, применение
Как вам известно, в химии существует четыре класса неорганических соединений. Веществ, представляющих каждый из них, очень много, но лидирующее положение, несомненно, занимают оксиды. У одного химического элемента может быть сразу несколько разных бинарных соединений с кислородом. Такое свойство имеет и медь. У нее существует три оксида.
Давайте рассмотрим их детальнее.

Оксид меди (I)
Его формула — Cu2O. В некоторых источниках данное соединение могут называть гемиоксидом меди, оксидом димеди или закисью меди.
Свойства
Является кристаллическим веществом, имеющим коричнево-красный цвет. Этот оксид не растворяется в воде и этиловом спирте. Может плавиться, не разлагаясь, при температуре чуть больше 1240 о С. Данное вещество не взаимодействует с водой, но может переводиться в раствор, если участниками реакции с ним будут концентрированные хлоровородная кислота, щелочь, азотная кислота, гидрат аммиака, соли аммония, серная кислота.
Получение оксида меди (I)
Его можно получить, нагрев металлическую медь, или в такой среде, где кислород имеет малую концентрацию, а также в токе некоторых оксидов азота и вместе с оксидом меди (II). Кроме того, он может стать продуктом реакции термического разложения последнего. Оксид меди (I) получится и в том случае, если нагреть сульфид меди (I) в токе кислорода. Есть и другие, более сложные способы его получения (например, восстановление одного из гидроксидов меди, ионный обмен любой соли одновалентной меди с щелочью и т.п.), но их практикуют только в лабораториях.
Применение
Нужен в качестве пигмента, когда окрашивают керамику, стекло; компонента красок, которые защищают подводную часть судна от обрастания. Используется также как фунгицид. Без него не обходятся и меднозакисные вентили.

Оксид меди (II)
Его формула — CuO. Во многих источниках может встречаться под названием окиси меди.
Свойства
Это высший оксид меди. Вещество имеет вид черных кристаллов, которые почти не растворяются в воде. Взаимодействует с кислотой и при этой реакции образует соответствующую соль двухвалентной меди, а также воду. При его сплавлении с щелочью продукты реакции представлены купратами. Разложение оксида меди (II) происходит при температуре около 1100 о С. Аммиак, монооксид углерода, водород и уголь способны извлекать из этого соединения металлическую медь.
Получение
Его можно получить при нагревании металлической меди в воздушной среде при одном условии — температура нагревания должна быть ниже 1100 о С. Также оксид меди (II) может получиться, если нагреть карбонат, нитрат, двухвалентный гидроксид меди.
Применение
С помощью данного оксида окрашивают в зеленый или синий цвет эмаль и стекло, а также производят медно-рубиновую разновидность последнего. В лаборатории этим оксидом обнаруживают восстановительные свойства веществ.

Оксид меди (III)
Его формула — Cu2O3. Имеет традиционное название, которое звучит, наверное, немного необычно — окисел медь.
Свойства
Имеет вид красных кристаллов, не растворяющихся в воде. Разложение этого вещества происходит при температуре 400 о С, продукты данной реакции — оксид меди (II) и кислород.
Получение
Его можно получить, окисляя двухвалентный гидроксид меди с помощью пероксидисульфата калия. Необходимое условие реакции — щелочная среда, в которой она должна происходить.
Применение
Данное вещество само по себе не используется. В науке и промышленности более широкое распространение находят продукты его разложения — оксид меди (II) и кислород.
Вот и все оксиды меди. Их несколько из-за того, что медь имеет переменную валентность. Существуют и другие элементы, у которых есть по несколько оксидов, но о них поговорим в другой раз.
Источник: www.syl.ru
