Описать физические свойства серебра по следующим пунктам: 1. В каком агрегатном состоянии — газообразном, жидком или твёрдом — находится вещество при данных условиях?
2. Какого цвета вещество? Имеет ли оно блеск?
3. Имеет ли вещество запах?
4. Какова твёрдость вещества по относительной шкале твёрдости, которой ещё называют шкалой Мооса?
5. Проявляет ли вещество пластичность, хрупкость, эластичность?
6. Растворяется ли вещество в воде?
7. Какова температура плавления и температура кипения вещества?
8. Какова плотность вещества?
9. Обладает ли вещество тепло- и электропроводностью?
Источник: 0tvet.com
1 Агрегатное состояние минералов, что называется кристаллическим и аморфным веществом? Примеры
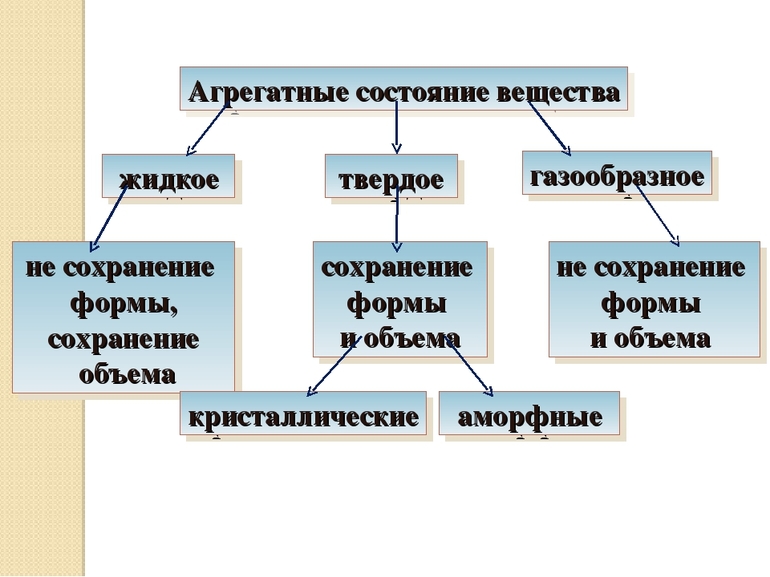
Согласно существующим трем агрегатным состояниям вещества различают минералы твердые, жидкие и газообразные.
При атмосферном давлении в условиях комнатной температуры большинство минералов находится в твердом состоянии и плавится при высоких температурах, тогда как ртуть в этих условиях существует в жидком виде, а сероводород и углекислота в газообразном состоянии.
Конденсат Бозе — Эйнштейна: пятое агрегатное состояние вещества
Большинство твердых минералов представлено кристаллическими веществами, т. е. веществами, обладающими кристаллической структурой. Каждое кристаллическое вещество имеет определенную температуру плавления, при которой изменение агрегатного состояния вещества происходит с поглощением тепла. Они анизотропные, т.е. разные физические свойства по разным направлениям.
Твердые химически чистые вещества, характеризующиеся беспорядочной структурой, т. е. отсутствием закономерного расположения атомов, носят название аморфных (стеклообразных) тел. Они принадлежат к числу изотропных веществ, т. е. обладающих по всем направлениям одинаковыми физическими свойствами.
Аморфные вещества часто получаются при затвердевании расплавленных вязких масс, особенно когда охлаждение расплава происходит очень быстро. Переход аморфных веществ в кристаллические массы может произойти лишь при продолжительном выдерживании их в размягченном состоянии при температуре, близкой к точке плавления.
Примеры кристаллических: галит, кварц, топаз, ортоклаз
Аморфные: опал, лимонит.
2. Определение кристалла. Что понимается под симметрией, элементами симметрии кристалла?
Кристаллы – твёрдые тела, имеющие многогранную форму, а слагающие их частицы (атомы, молекулы, ионы) располагаются закономерно.
Симметрия – правильная повторяемость элементов ограничения при выполнении симметричных операций.
Элементы симметрии – вспомогательные геометрические образы, которые позволяют выявить симметрию кристаллов. Симметричные операции – это повороты и отражение кристаллов относительно элементов симметрии.
Элементы симметрии – ось симметрии, центр симметрии, плоскость симметрии.
Ось симметрии – прямая линия, при вращении вокруг которой повторяются равные части фигуры, то есть она самосовмещается
Центр симметрии – точка внутри кристалла, по обе стороны от которой на равных расстояниях находятся одинаковые элементы ограниченности (грани,ребра,вершины).
Плоскость симметрии – это воображаемая плоскость, которая делит фигуру на две симметричные части.
3. Классификация кристаллов. Какие известны сингонии? Охарактеризуйте их.
Сингония – совокупность видов симметрии, связанная общим признаком. Всего существует 7 видов сингоний, которые входят в состав трех категорий. Низшая ( нет осей симметрии высшего порядка) – триклинная, моноклинная, ромбическая. Средняя (наличие одной оси симметрии высшего порядка) – тригональная, тетрагональная, гексагональная. Высшая ( наличие нескольких осей симметрии высшего порядка) – кубическая.
1)Триклинная – нет ни осей, ни плоскостей симметрии, может быть только центр симметрии С
2) Моноклинная – оси и плоскости симметрии имеются в единственном числе (Л2Р или Л2РС)
3) Ромбическая – сумма осей и плоскостей симметрии равна 3 или 6 (Л22Р, 3Л2РС)
4)Тригональная – наличие одной оси высшего порядка Л3
5) Тетрагональная – наличие одной оси высшего порядка Л4
6) Гексагональная – наличие одной оси высшего порядка Л6
7) Кубическая – наличие нескольких осей симметрии высшего порядка – 4Л3
Источник: studfile.net
Агрегатное состояние вещества — виды и условия перехода
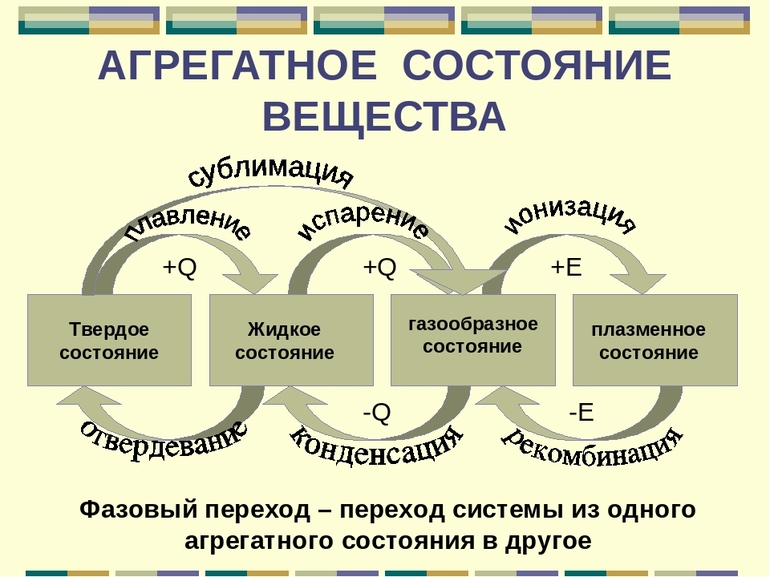
Любой химический элемент или соединение в зависимости от внешних условий может принимать разные формы, которые называются агрегатным состоянием вещества. Поскольку при переходе из одного состояния в другое изменяются структурные связи между молекулами, атомами или ионами, то этот процесс изучается в физической химии.

Общие понятия
- твердое;
- жидкое;
- газообразное.
Переход вещества из одного АС в другое называется фазовым и сопровождается скачкообразным изменением его физических и химических свойств — плотности, растворимости, кинетической и потенциальной энергии частиц и др. Всего существует шесть процессов, вызывающих изменение агрегатного состояния вещества:
- Плавление — преобразование твердого тела в жидкое (таяние льда).
- Обратный процесс — кристаллизация или затвердение (морозные узоры на стекле).
- Парообразование — переход вещества из жидкого АС в газообразное. Частные случаи — испарение происходит только с поверхности жидкости; кипение, при котором жидкость превращается в пар по всему объему.
- Обратный процесс — конденсация.
- Сублимация или возгонка — переход из твердого АС сразу в газообразное без жидкой стадии.
- Десублимация — обратное преобразование.
Сублимированию в той или иной мере подвержены все твердые тела, но в основном количество частиц, покинувших тело, настолько мало, что процесс практически незаметен. Примеры явной сублимации — графит и сухой лед (оксид углерода). Даже сильное нагревание не приводит их в жидкое состояние, а постепенно превращает в газ. Запахи твердых тел тоже обусловлены возгонкой — отрываясь от поверхности, молекулы скапливаются в пары, обладающие ароматом (камфара, нафталин). Молекулы некоторых органических веществ, например, белков, настолько большие, что не позволяют им принять газообразную форму.
Твердые тела
При нормальных условиях находятся в стабильной форме и сохраняют свой объем. По внутреннему строению и свойствам разделяются на кристаллические и аморфные. Первые отличаются строго упорядоченным положением частиц, между которыми установлены сильные взаимосвязи — ковалентные полярные и неполярные, ионные, металлические. Тип взаимодействия определяет физические свойства твердого тела. Это, как правило, металлы и их оксиды, обладающие хорошей тепло- и электропроводностью, прочные и упругие.
Свойства аморфных тел близки к жидкостным, так как их молекулы передвигаются между хаотично расположенными условными центрами. К ним относятся разнообразные смолы, пластмассы, стекло и другие неметаллы. Нагревание кристаллических веществ приводит к нарушению упорядоченного расположения частиц, увеличению расстояний между ними и рекристаллизации. При определенной температуре, которая называется температурой плавления, перестройка молекул приводит к превращению твердого тела в жидкость. Количество теплоты, которое нужно, чтобы расплавить некоторую массу вещества, вычисляют по формуле: Q = km, где k — удельная теплота плавления этого вещества, m — его масса.
Молекулярная кинетическая энергия остается неизменной, поэтому дальнейшее нагревание вещества не приводит к повышению его температуры до тех пор, пока все оно не превратится в жидкость. Если продолжать нагрев, то с поверхности расплавленного металла начнется испарение — беспорядочный отрыв отдельных молекул, который является началом перехода в газообразное состояние. При кристаллизации, начинающейся при снижении температуры, остывающее тело само отдает тепло в атмосферу.

Опытным путем установлено, что температуры плавления и кристаллизации у каждого металла равны друг другу, а их точно известное значение отличает кристаллические тела от аморфных. В отличие от металлов, аморфные вещества не плавятся, а размягчаются. Например, стекло при нагревании сначала становится мягким, его легко согнуть или растянуть.
Дальнейшее повышение температуры приводит к тому, что оно под действием силы тяжести растекается по сосуду, который занимает. Эта масса, поначалу очень густая, постепенно приобретает консистенцию воды. Таким образом процесс перехода аморфного тела в жидкое происходит не при фиксированной температуре, как у кристаллических тел, а растягивается на все время нагревания.
Изменение жидкостей

Жидкости — это тела, занимающие весь объем, в котором находятся, образующие поверхность, но не способные удерживать упругую форму. Для них свойственно сильное межмолекулярное взаимодействие и низкая сжимаемость, что определяет их положение между газообразным и твердым АС. Жидкости изотропны, текучи и обладают удельным весом, сравнимым с тем же показателем у твердых тел.
Правильное расположение внутренних частиц распространяется на небольшие области — они не только колеблются вокруг узлов так называемой квазикристаллической решетки, но и могут перескакивать между ними. Получается сложная траектория — колебания вокруг центра, перемещающегося в пространстве. Этим объясняется текучесть тел в жидком АС. Если понизить температуру до границ кристаллизации, то различные тепловые свойства жидкостей приблизятся к показателям твердых тел.
Процесс парообразования
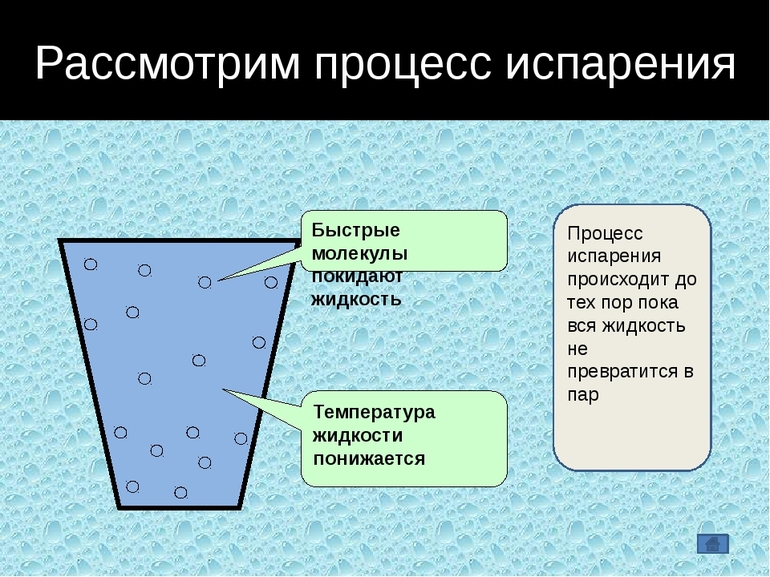
Некоторые молекулы жидкости могут преодолеть силы поверхностного натяжения и перейти в парообразную форму, чем объясняется явление испарения, происходящее при любой температуре. Когда она повышается, процесс становится интенсивней и распространяется на весь объем. Появляется все больше пузырьков насыщенного пара, прорывающихся из глубины на поверхность.
При температуре кипения, имеющей определенное значение для каждого жидкого тела, давление пара внутри пузырьков превышает атмосферное, и начинается интенсивный переход жидкости в газообразное АС. При пониженном атмосферном давлении температура кипения той же жидкости становится ниже.
Динамическое равновесие

Когда жидкость находится в открытой емкости, то ее количество обязательно уменьшится вследствие испарения. Но если сосуд закрыть, то этого не произойдет. Сначала начнется процесс испарения и продолжится до тех пор, пока число покинувших жидкость молекул не станет равно возвратившимся назад из паров.
Можно сказать, что замкнутая система придет в динамическое (подвижное) равновесие, так как процесс обмена молекул будет продолжаться и дальше, т. е. испарение и конденсация в замкнутой системе происходят одновременно и компенсируют друг друга. Пар, который находится в таком равновесии с соответствующей жидкостью, называется насыщенным. Изменение внутренней энергии вещества определяется по формуле: ΔU = ± mr, где m — масса тела, r — удельная теплота парообразования.
Динамическое равновесие у разных жидкостей наступает при разной плотности пара. Это зависит от силы межмолекулярного взаимодействия. Если они велики как, например, у ртути, то только незначительное число самых быстрых молекул может покидать поверхность жидкости, а равновесие наступает при малой плотности пара. У летучих жидкостей молекулы разлетаются очень быстро, поэтому нужна высокая плотность для наступления равновесия.
Газообразное состояние
При этом АС частицы химических элементов и их соединений связаны друг с другом слабо или не связаны вообще и заполняют весь предоставленный объем. Такое состояние вещества широко распространено в природе: воздушные массы атмосферы; скопления газов под землей; газообразная материя, растворенная в водах Мирового океана.
Все газы отличаются следующими свойствами:
- равномерно заполняют весь предоставленный объем, при этом не создавая поверхность;
- имеют малую плотность при высокой скорости диффузии;
- сравнительно легко сжимаются.

Эти характеристики определяются большими расстояниями между молекулами и их притяжением друг к другу. Газообразное АС веществ можно рассматривать, как перегретый или ненасыщенный пар. При сверхвысоких температурах газ частично или полностью ионизируется, при этом сохраняя общую электрическую нейтральность, потому что плотности отрицательных и положительных зарядов находятся примерно на одном уровне.
Так образуется плазма, которую некоторые ученые рассматривают, как четвертый вид АС вещества. В ней взаимодействие происходит между ионами и свободными электронами с помощью электрических сил, действующих на большом расстоянии. Вещества, которые при нормальных условиях являются газами, самопроизвольно переходить в жидкое состояние не могут.
Увеличение давления и понижение температуры приводит к уменьшению расстояний между молекулами и увеличению силы взаимодействия до такой степени, что вещество из газообразного состояния переходит в жидкое, т. е. изменяет свое АС. Этот процесс называется сжижением и характеризуется критической температурой. Она определяется в точке, после которой превращение газа в жидкость невозможно ни при каком давлении.
Для каждого газообразного вещества значение этой температуры свое. Оно бывает примерно равно комнатной, как у аммиака, хлора и углекислого газа, тогда для сжижения достаточно воздействовать на газ только давлением. У водорода и гелия, например, критическая температура намного ниже комнатной. Перед сжижением их сначала охлаждают до температуры чуть ниже критической, а затем доводят до жидкого АС повышенным давлением.
Сравнительная таблица
Различие между твердыми материалами, жидкостями и газами объясняется внутренними процессами, зависящими от агрегатного состояния вещества. В таблице приведены характерные для каждого класса особенности.
| Состояние вещества | Расположение и характер движения частиц | Энергия взаимодействия | Физические свойства |
| Твердое | Расстояния между частицами, колеблющимися около положения равновесия, сопоставимы с их размерами. | Потенциальная энергия превышает кинетическую. Взаимодействие между частицами сильное. | Сохраняют собственную форму и объем. Имеют точную температуру кристаллизации и плавления. Обладают твердостью, прочностью и упругостью. |
| Жидкое | Частицы расположены вплотную и сохраняют близкий порядок упорядоченности. Могут перескакивать из одного положения равновесия в другой. | Модуль кинетической энергии почти равен потенциальной. | Сохраняют объем, но не форму. Закипают при определенной температуре. Текучи, почти не поддаются сжатию. |
| Газообразное | Частицы расположены хаотично на расстояниях, сильно превышающих их собственные размеры. Хаотичное движение частиц с довольно большими скоростями приводит к постоянным столкновениям между ними. | Кинетическая энергия по модулю намного превышает потенциальную. Легко заполняют весь предоставленный объем и сжимаются. | Принимают форму тех предметов, в которых находятся. |
Можно отметить, что переход вещества из одного АС в другое зависит от соотношения потенциальной и кинетической энергии его частиц.
Область применения

Способность металлов плавиться и поддаваться обработке в жидком состоянии широко применяется в черной и цветной металлургии. В технологиях получения соли и других химических соединений используется процесс выпаривания, при котором нужное вещество получается после испарения жидкости. В разных областях промышленности и техники распространено применение жидких газов.
Инертные газы используются в осветительных приборах, жидкий кислород — в медицине в качестве средства анестезии, при сварке металлов в смеси с ацетиленом.
Жидкий водород — это ракетное топливо, а оксид серы уничтожает плесень. В рефрижераторах и промышленных холодильниках применяют жидкий аммиак, кроме того, сжиженные газы удобней транспортировать.
Источник: nauka.club