

⚡ Условие + 37% решения:
Cоставьте схемы электролизов раствора AgNO3, протекающих на угольном и растворимом серебряном анодах. В чём будет заключаться различие? Определите массу серебра, выделившегося на катоде при пропускании тока силой 100 А в течение 30 мин через раствор AgNO3?
Решение: Схема электролиза раствора AgNO3 на угольном аноде 20 На катоде будут разряжаться катионы серебра. На аноде будут окисляться молекулы воды. (-) Катод: (+) Анод: Ag+ + ē → Ag 2Н2О — 4ē → О2 + 4Н+ 4NO3 — Общая реакция электролиза нитрата серебра 4AgNO3 + 2Н2О = 4Ag + 4HNO3+ O2↑ Схема электролиза раствора AgNO3 на серебряном аноде На катоде будут разряжаться катионы серебра. При использовании серебряного анода окислению подвергается материал анода — серебро, в результате чего анод будет растворяться. (-) Катод: (+) Анод: Ag+ + ē → Ag Ag — ē → Ag+ NO3 —
Эксперимент с грязным раствором (золотой и молибденовый катод)
Готовые задачи по химии которые сегодня купили:
- Используя ионно-электронный метод, закончите уравнения окислительно-восстановительных реакций в кислой и щелочной средах.
- Сравните степени гидролиза гипохлорита калия и нитрита калия, в водных растворах с молярной концентрации 0,01 моль/дм3 .
- Сколько граммов цианида калия и воды необходимо взять для приготовления 0,3 дм3 раствора с молярной концентрацией 0,2 моль/дм3 и плотностью 1,012 г/см3 ?
- Составьте схемы электролиза растворов веществ (на угольных анодах): PtCl2; Sn(NO3)2.
- Составьте схемы электролиза растворов веществ (на угольных анодах): KOH; CuCl2.
- В 100 см3 насыщенного раствора иодида свинца(II) содержится 0,0208 г ионов свинца Pb2+.
- Для реакции: 2SO2(г) + O2(г) 2SO3(г) а) определите направление процесса при стандартных условиях; б) напишите выражение константы равновесия Кс; в) укажите, как нужно изменить температуру, давление и концентрации веществ для смещения равновесия вправо.
- Рассчитайте тепловой эффект Н , изменение энтропии S и изменение энергии Гиббса G реакции: CH4(г) + 2O2(г) = CO2(г) + 2H2O(г)
- Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии: а) Изогнутая пластина из углеродистой стали в сухом хлороводороде при Т>300К; б) В качестве протектора для защиты от коррозии стальных изделий используют марганец.
- Составьте по два молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Fe3+ + 3OH– = Fe(OH)3 б) H+ + NO2 – = HNO2 в) Cu2+ + S 2– = CuS





















































Снимаю золото зарядкой для телефона!!!/Проще простого/Электролиз золота/
Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
Источник: lfirmal.com
Катод и анод
Иногда требуется подключить к источнику питания постоянного тока электроды какого-либо прибора или элемента. Их присоединяют, соблюдая полярность. Катод и анод – так называются проводники (электроды) устройства, с помощью которых выполняется это подключение. Однозначного понятия этих двух терминов нет. Их различают в зависимости от того, в каких химических и физических процессах применяют эти обозначения.
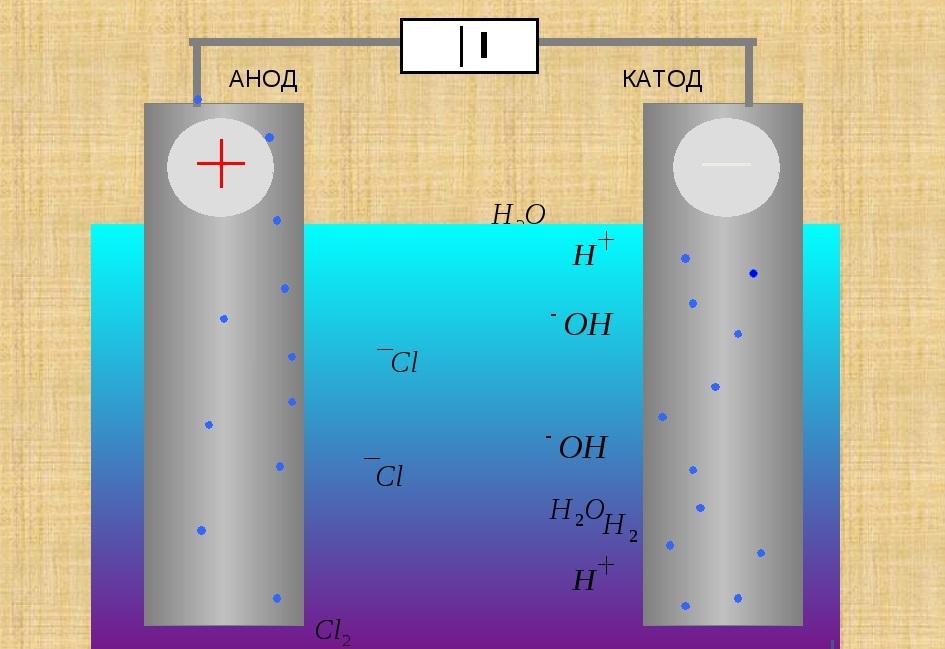
Анод и катод
Понятие катода и анода
В электрической технике вывод, присоединяемый к положительной клемме источника питания (ИП), называют анодом (А). Электрод, присоединённый к минсовому выводу ИП, – катодом (К). В переводе с греческого языка анод – «восхождение, движение вверх», катод – «нисхождение, движение вниз». С этими названиями можно встретиться в таких разделах физики и химии, как:
- гальванические источники питания;
- электролиз и гальванотехника;
- полупроводники и вакуумная электроника.
Кроме того, этими терминами обозначаются выводы элементов на схемах и знаки их заряда.
Обозначение в электрохимии и цветной металлургии
Понятие анодов в электролитических процессах применимо в отношении положительно заряженных электродов. Электролиз, с помощью которого выделяются или очищаются различные химические элементы, – это влияние электрического тока на электролит. Электролитом выступают растворы солей или кислот. Другим электродом, участвующим в этой реакции, выступает катод.
Анод на аккумуляторе и в других приборах, процессы на аноде и знак анода

Анод на аккумуляторе и в других приборах, процессы на аноде и знак анода.
Поделиться в:




Анод – это электрод некоторого прибора, в который втекает электрический ток (в его конвенциональном понимании как поток положительных зарядов), в противоположность катоду из которого он вытекает.
Анод на аккумуляторе, гальваническом элементе, в диоде и в других приборах. Анод при электролизе водного и иного раствора. Процессы на аноде:
Анод (др.-греч. ἄνοδος – «движение вверх») – это электрод некоторого прибора, в который втекает электрический ток (в его конвенциональном понимании как поток положительных зарядов), в противоположность катоду из которого он вытекает.
Анод в электрохимии (при электролизе) – это электрод, на котором происходят реакции окисления. Например, при электролитическом рафинировании металлов ( меди , никеля , цинка и пр.) либо при нанесении на поверхность изделия слоя металла электрохимическим способом на аноде происходит разрушение (растворение) анода, в результате которого металл с примесями растворяется и осаждается в очищенном виде на катоде или на поверхности изделия, выступающего в качестве катода.
Основное распространение получили аноды из цинка , никеля , меди (среди которых отдельно выделяют медно-фосфористые, марки АМФ), кадмия , бронзы, олова , сплава свинца и сурьмы, серебра , золота и платины . Аноды из недрагоценных металлов применяются для повышения коррозионной стойкости, повышения эстетических свойств предметов и др. целей. Аноды из драгоценных металлов применяются гальваническим производством для повышения электропроводности изделий и др.
Анод в вакуумных электронных приборах – это электрод, который притягивает к себе летящие электроны, испущенные катодом вследствие термоэлектронной эмиссии. В электронных лампах и рентгеновских трубках конструкция анода такова, что он полностью поглощает электроны. А в электронно-лучевых приборах анод является элементом электронной пушки. Он поглощает лишь часть летящих электронов, формируя после себя электронный луч.
Термоэлектронная эмиссия – это явление выхода электронов из твёрдого тела, металла или карбидов или боридов переходных металлов в свободное пространство, обычно в вакуум или разрежённый газ при нагреве его до высокой температуры. Заметная эмиссия электронов наблюдается при нагреве чистых металлов только до температур свыше 900 К.
Анод в полупроводниковом приборе (диоде, тиристоре) – это электрод, подключенный к положительному полюсу источника тока, когда при приложении прямого напряжения прибор открыт (то есть имеет маленькое сопротивление и через прибор течёт прямой ток).
Анод химического источника тока (в аккумуляторе и ином гальваническом элементе) в соответствии с ГОСТ 15596-82 «Источники тока химические . Термины и определения (с Изменением № 1)» – это электрод химического источника тока, на котором протекают окислительные процессы.
Знак анода:
В литературе встречается различное обозначение знака анода: «+» или «−», что определяется, в частности, особенностями рассматриваемых процессов.
В электрохимии принято считать, что катод — электрод, на котором происходит процесс восстановления, а анод – тот, где протекает окисление. При работе электролизера (например, при рафинировании меди, никеля, цинка) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла , это катод (т.е. имеет знак «−»). На другом электроде обеспечивается недостаток электронов (положительный заряд) и окисление металла , это анод (т.е. имеет знак «+»).
Наоборот, при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет уже анод (знак «−»). Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод (знак «+»).
В соответствии с таким толкованием, для аккумулятора анод и катод меняются местами в зависимости от направления тока внутри аккумулятора .
Гальванический элемент – это химический источник тока, состоящий из электродов и электролита, заключенных в один сосуд, предназначенный для разового или многократного разряда. Гальваническая батарея, в свою очередь, – это химический источник тока, состоящий из двух или более гальванических элементов, соединенных между собой электрически для совместного производства электрической энергии.
Аккумулятор – это гальванический элемент, предназначенный для многократного разряда за счет восстановления емкости путем заряда электрическим током. Аккумуляторная батарея, в свою очередь, это электрически соединенные между собой аккумуляторы , оснащенные выводами и заключенные, как правило, в одном корпусе
В соответствии с ГОСТ 15596-82 «Источники тока химические. Термины и определения (с Изменением № 1)» отрицательный электрод химического источника тока – это электрод, который при разряде химического источника тока является анодом (знак «−»); положительный электрод химического источника тока – это, который при разряде химического источника тока является катодом (знак «+»). Химический источник тока – это устройство, в котором химическая энергия заложенных в нем активных веществ непосредственно преобразуется в электрическую энергию при протекании электрохимических реакций.
В электротехнике катод – это отрицательный электрод (знак «−»), а анод – положительный электрод (знак «+»). В электротехнике за направление электрического тока принято считать направление движения положительных зарядов. Электрический ток течёт от анода к катоду, электроны, соответственно, наоборот, от «−» к «+».
Источник: xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai