Сульфид серебра (Ag2S) представляет собой плотное неорганическое твердое вещество черного цвета. Давайте посмотрим, как он реагирует с азотной кислотой (HNO3) через эту статью.
Азотная кислота (HNO3) является весьма коррозионный минеральная кислота. Азотную кислоту в основном получают реакцией диоксида азота с водой. Это основной агент, используемый в реакции нитрования и синтезе многих органических соединений. Реакция между азотной кислотой и сульфидом серебра протекает очень быстро.
Эта статья предоставит подробные сведения о взаимодействии HNO3 с Ag2S.
Что является продуктом HNO3 и Аг2S
Реакция сульфида серебра с азотной кислотой дает нитрат серебра, оксид азота, твердую серу и воду. Твердый сульфид серебра (Ag2S) растворяется в азотной кислоте. Сбалансированная химическая реакция для этой реакции:
Какой тип реакции HNO?3 и Аг2S
Реакция азотной кислоты (HNO3) с сульфидом серебра (Ag2S) представляет собой реакцию окислительно-восстановительного типа.
АФФИНАЖ СЕРЕБРА БЕЗ КИСЛОТ.
Как сбалансировать HNO3 и Аг2S
- Общую химическую реакцию можно представить в виде:
- Ag2С + ННО3 → AgNO3 + НЕТ + С + Н2O
- Теперь определяем количество элементов с каждой стороны.
- Есть 2Ag, 1S, 1H, 1N и 3O на стороне реагента и Ag, 1S, 2H, 2N и 5O на стороне продукта.
- Включив соответствующие коэффициенты с обеих сторон, мы получим следующее сбалансированное химическое уравнение.
- Ag2С + 4ННО3 → 2AgNO3 + 2НО + С + 2Н2O
HNO3 + Аг2S титрование
HNO3 + Аг2S не представляют никакой реакции титрования. HNO3 является сильной кислотой, но Ag2S не является ни сильным, ни слабым основанием, поскольку представляет собой сульфид металла. Поэтому титрование этой реакции невозможно.
HNO3 + Аг2S чистое ионное уравнение
- Сбалансированное молекулярное уравнение
- Ag2С + 4ННО3 → 2AgNO3 + 2НО + С + 2Н2O
- Затем напишите (s, l, aq, g) для каждой молекулы.
- Ag2S(S) + 4ХНО3 (л) → 2AgNO3 (ы) + 2НО(Г) + S(S) + 2H2O(S)
- Теперь о разложении сильных электролитов на ионы.
- 2Аг + + S 2- + 4H + + 4НО3 – → 2Аг + + 2НО3 – + 2НО + С + 2Н2O
- После разрыва вычеркнем общие ионы с обеих сторон, получим результирующее ионное уравнение следующего вида:
- Окончательное чистое ионное уравнение:
- S 2- + 4H + + 2НО3 – → 2НО + С + 2Н2O
HNO3 + Аг2S сопряженных пар
- Сопряженное основание для HNO3 нет3 – .
- Сопряженная кислота для HNO3 это Н + .
- Сопряженное основание для Ag2С есть С 2- .
- Сопряженная кислота для Ag2S представляет собой Ag + .
HNO3 + Аг2S межмолекулярные силы
- Азотная кислота является сильной кислотой, и существует большая электроотрицательная разница между H и NO.3. Следовательно, ННО3 полярная молекула.
- Межмолекулярное взаимодействие в HNO3 молекула диполь-дипольных взаимодействий и дисперсионных взаимодействий.
- Лондонские дисперсионные силы происходит, когда электроны в HNO3 + Аг2Их притягивают друг к другу их мимолетные и беспорядочные заряды.
HNO3 + Аг2S энтальпия реакции
HNO3 + Аг2Энтальпия реакции S составляет около (-309.69). Информация об энтальпии следующая:
Очистка серебренных контактов перекисью водорода.
- Энтальпия образования HNO3= -207.36 кДж/моль.
- Энтальпия образования Ag2S = -31.8 кДж/моль.
- Энтальпия образования AgNO3 = -124.39 кДж/моль.
- Энтальпия образования NO = 90.25 кДж/моль.
- Энтальпия образования H2O = -241.8 кДж/моль.
- Энтальпия образования S = 0.33 кДж/моль.
- Энтальпия реакции равна (-31.8 + 4(-207.36))-(2(-124.39)+2×90.25+0.33+2(-241.8))
HNO3 + Аг2S буферный раствор
HNO3 + Аг2S не является буферным раствором, потому что для буферного раствора должна быть слабая кислота или основание, но HNO3 является сильной кислотой, поэтому буферный раствор невозможен.
HNO3 + Аг2S полная реакция
HNO3 + Аг2S является полной реакцией, поскольку все моли реагента HNO3 и Аг2S полностью преобразуются и потребляются продуктом при равновесие.
HNO3 + Аг2S экзотермическая или эндотермическая реакция

HNO3 + Аг2S – экзотермическая реакция. Энтальпия образования отрицательна, что означает, что при образовании этой связи выделяется некоторое количество тепла. График экзотермической реакции выглядит следующим образом.
HNO3 + Аг2S окислительно-восстановительная реакция
HNO3 + Аг2S представляет собой окислительно-восстановительную реакцию, т. е. реакцию окислительно-восстановительного типа. В этой реакции Ag2S — восстановитель. Он отдает 2 электрона в процессе реакции. HNO3 является сильным окислителем и в процессе реакции восстанавливается, образуя стабильные продукты.
HNO3 + Аг2S реакция осаждения
Реакция HNO3 + Аг2S представляет собой осадочную реакцию. В результате этой реакции образуется желтое твердое вещество серы. Продукт серы, образующийся в этой реакции, является осадком для этой реакции и нерастворим в воде.
HNO3 + Аг2S обратимая или необратимая реакция
Реакция HNO3 + Аг2S – необратимый тип реакции. Оксид азота, образующийся в этой реакции, находится в газообразном состоянии и высвобождается в виде продукта, что делает эту реакцию необратимой. Равновесие в этой реакции не может быть сдвинуто назад.
HNO3 + Аг2S реакция смещения
Реакция HNO3 + Аг2S – реакция замещения. Здесь С 2- ионы Ag2S заменяется NO3 – ионов, что делает это реакцией замещения.
Заключение
Дымящаяся азотная кислота растворяет осадок сульфида серебра с образованием нитрата серебра, оксида азота и серы в качестве продукта. Сера, нерастворимая в воде, легко отделяется. Это экзотермическая окислительно-восстановительная реакция. А продукты, полученные в результате этой реакции, находят большое применение в синтетической промышленности.
Источник: ru.lambdageeks.com
Гидроксид серебра это основание или кислота
Оксид серебра (I) Ag2O – буро-черные кристаллы с кубической кристаллической решеткой, плотность 7,14 г/см 3 , при 300°С разлагается.
Имеет выраженные основные свойства. В воде плохо растворяется, но придает ей слабощелочную реакцию:
При нагревании до 300°С разлагается на кислород и серебро:
С щелочами не взаимодействует, в водных растворах аммиака образует гидроксид диамминсеребра (I):
В разбавленной серной кислоте растворяется, образуя сульфат серебра (I):
Проявляет окислительные свойства, особенно по отношению к некоторым органическим веществам:
Оксид серебра (I) получают осторожным нагреванием гидроксида серебра:
Гидроксид серебра (I) AgOH не выделен в индивидуальном виде, это неустойчивое соединение, из растворов не образуется. При взаимодействии солей серебра (I) с щелочами в растворе образуется гидратированный оксид Ag2O·nH2O.
6.8. Обнаружение ионов серебра (I)
Ионы серебра (I) в растворе можно обнаружить при приливании раствора, содержащего хлорид-ионы :
наблюдается выпадение характерного белого творожистого осадка.
Гидроксид серебра
| Гидроксид серебра | |
| Систематическое наименование | Гидроксид серебра |
| Традиционные названия | Гидроокись серебра |
| Химическая формула | AgOH |
| Состояние (ст. усл.) | белый аморфный осадок |
| Молярная масса | 124,88 г/моль |
| Энтальпия образования (ст. усл.) | -124,36 кДж/моль |
Гидроксид серебра — неорганическое соединение, гидроокись металла серебра с формулой AgOH, белый аморфный осадок, не растворяется в воде.
Получение
Физические свойства
Гидроксид серебра образует белый аморфный осадок.
Химические свойства
Проявляет амфотерные свойства:
- реагирует с кислотообразующими окислами, например, поглощает углекислый газ:

- реагирует с сульфидамищелочных металлов с образованием аргенатов Ag2O•3Na2O и Ag2O•2Na2O
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М .: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М .: Мир, 1972. — Т. 2. — 871 с.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Wikimedia Foundation . 2010 .
Смотреть что такое «Гидроксид серебра» в других словарях:
Гидроксид марганца(II) — Общие Систематическое наименование Гидроксид марганца(II) Традиционные названия Гидроокись марганца Химическая формула Mn(OH)2 Физические свойства … Википедия
Гидроксид хрома(II) — Общие Систематическое наименование Гидроксид хрома(II) Традиционные названия гидроокись хрома Химическая формула Сr(OH)2 Физические свойства … Википедия
Гидроксид хрома(III) — Гидроксид хрома (III) сложное неорганическое вещество с химической формулой Cr(OH)3. Описание Гидроксид хрома (III) амфотерный гидроксид. Серо зеленого цвета, разлагается при нагревании, теряя воду и образуя зеленый метагидроксид CrO(OH). Не… … Википедия
Бихромат серебра — Общие Систематическое наименование Бихромат серебра Традиционные названия Хромовокислое серебро Химическая формула Ag2Cr2O7 Физические свойства … Википедия
Хромат серебра — Общие Систематическое наименование Хромат серебра Традиционные названия Хромовокислое серебро Химическая формула Ag2CrO4 Физические свойства … Википедия
Оксид серебра(I) — У этого термина существуют и другие значения, см. Оксид серебра. Оксид серебра(I) … Википедия
Перманганат серебра — Общие Систематическое наименование Перманганат серебра Традиционные названия Марганцовокислое серебро Химическая формула AgMnO4 Физические свойства … Википедия
Фульминат серебра — Общие Систематическое наименование Фульминат серебра(I) Традиционные названия Гремучее серебро Химическая формула AgCNO Эмпирическая формула AgCNO Физические свойства … Википедия
Нитрат серебра(I) — Под вечный гул вертящихся колес. Нитрат серебра … Википедия
Ацетиленид серебра — Общие … Википедия
Гидроксид серебра
| Гидроксид серебра | |
| Гидроокись серебра | |
| AgOH | |
| AgOH | |
| белый аморфный осадок | |
| 124,88 г/моль | |
| Энтальпия | |
| -124,36 кДж/моль | |
| 12258-15-0 | |
| 10129950 | |
Гидроксид серебра — неорганическое соединение, гидроксид серебра с формулой AgOH, белый аморфный осадок, разлагается в воде. Проявляет амфотерные свойства. Вещество неустойчиво и при его получении в водной среде при помощи реакций обмена гидролизуется водой до оксида серебра I. Однако в безводном метаноле или этаноле гидроксид серебра устойчив.
Иногда под гидроксидом серебра имеют ввиду смесь оксида с водой: ½Ag2O+½H2O
AgNO3 + KOH → −50oC AgOH↓ + KNO3
- Осторожное добавление раствора аммиака к раствору соли серебра I:
Химические свойства
Проявляет амфотерные свойства:
- реагирует с кислотными оксидами, например, поглощает углекислый газ:
- реагирует с концентрированным раствором аммиака, образуя аммиачный комплекс:
- реагирует с сульфидами щелочных металлов с образованием аргенатов Ag2O•3Na2O и Ag2O•2Na2O
Источник: ollimpia.ru
Классификация кислот

Кислоты ‒ это вещества, способные в растворах отдавать катион (протон) водорода.
Примеры диссоциации кислот:
Если пока понятие диссоциации неизвестно, легче ориентироваться по общим формулам кислот:
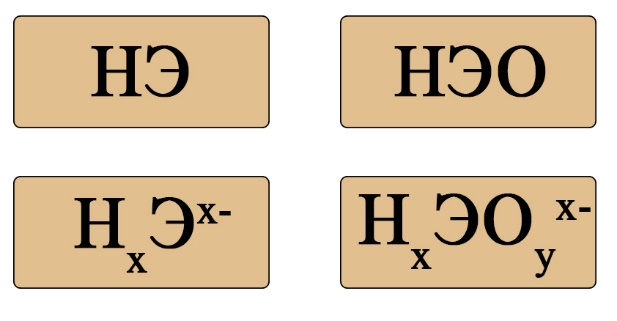
Важен не только состав, но и последовательность. На первом месте должен стоять водород, за ним – элемент, если в составе есть кислород, то он должен стоять последним. Например, HCl – кислота (соответствует формуле HЭ), H2S – тоже кислота (на первом месте водород, на втором — сера), а вот NH3 несмотря на то, что состоит из водорода и элемента, не является кислотой, это легко определить по последовательности: в этой формуле сначала стоит элемент, а за ним – водород (иногда, чтобы запутать сдающего, составитель может написать не NH3, а H3N, Вы должны помнить, что NH3 (аммиак), PH3(фосфин), AsH3 (арсин), CH4 (метан) – не являются кислотами, так как в воде либо не диссоциируют, либо диссоциируют без образования протона водорода. H2SO4 – является кислотой, так как формула имеет порядок элементов «водород → элемент → кислород», а NaOH, тоже состоящая из элемента, кислорода и водорода – кислотой не является, так как тут последовательность будет такова: «элемент → кислород → водород».
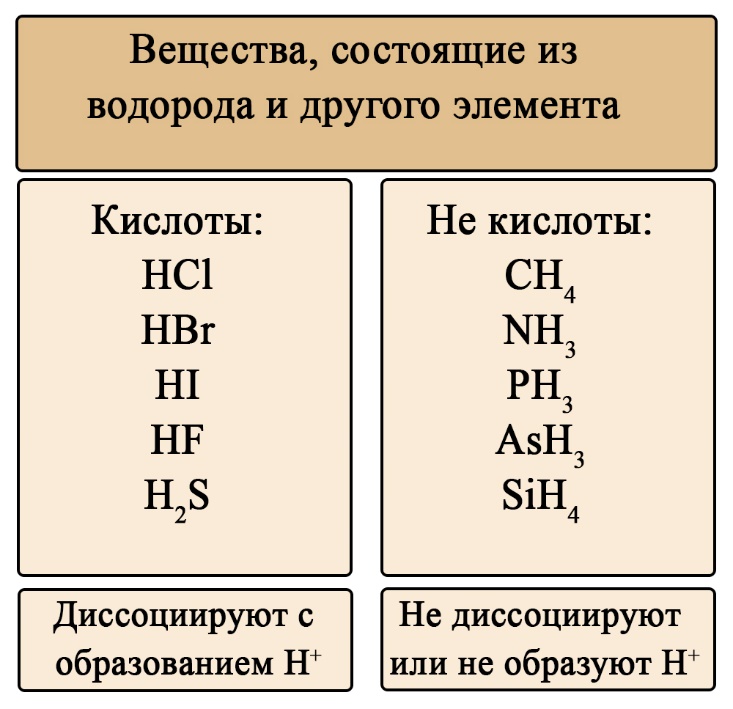
Классификация кислот по составу
Кислоты можно разделить на кислородсодержащие и бескислородные. Не трудно догадаться, что бескислородные не содержат атомов кислорода, а кислородсодержащие — содержат. Кислородсодержащие кислоты образованы соответствующими оксидами, а бескислородные образованы прямым взаимодействием простых веществ.
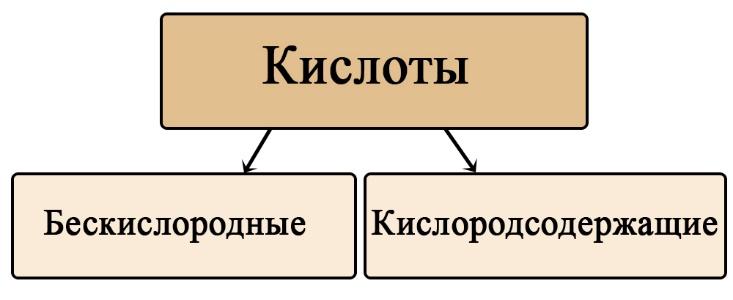
Таб. Примеры бескислородных и кислородсодержащих кислот, образованных одним и тем же неметаллом
Бескислородные
Кислородсодержащие
Источник: onlineclass.space