В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. Вещество при заданных условиях может находиться в одном из трех агрегатных состояний: твердом, жидком или газообразном. Свойства вещества зависят также от характера химической связи между образующими его частицами — молекулами, атомами или ионами. По типу связи различают вещества молекулярного и немолекулярного строения.
Вещества, состоящие из молекул, называются молекулярными веществами. Связи между молекулами в таких веществах очень слабые, намного слабее, чем между атомами внутри молекулы, и уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость и далее в газ (возгонка йода). Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы.
К молекулярным веществам относятся вещества с атомной структурой ($C, Si, Li, Na, K, Cu, Fe, W$), среди них есть металлы и неметаллы.
Рассмотрим физические свойства щелочных металлов. Относительно малая прочность связи между атомами обуславливает низкую механическую прочность: щелочные металлы мягкие, легко режутся ножом.
Вещества молекулярного и немолекулярного строения. Самоподготовка к ЕГЭ и ЦТ по химии
Большие размеры атомов приводят к малой плотности щелочных металлов: литий, натрий и калий даже легче воды. В группе щелочных металлов температуры кипения и плавления понижаются с увеличением порядкового номера элемента, т.к. размеры атомов увеличиваются, и ослабевают связи.
К веществам немолекулярного строения относятся ионные соединения. Таким строением обладает большинство соединений металлов с неметаллами: все соли ($NaCl, K_2SO_4$), некоторые гидриды ($LiH$) и оксиды ($CaO, MgO, FeO$), основания ($NaOH, KOH$). Ионные (немолекулярные) вещества имеют высокие температуры плавления и кипения.
Кристаллические решетки
Вещество, как известно, может существовать в трех агрегатных состояниях: газообразном, жидком и твердом.
Твердые вещества: аморфные и кристаллические.
Рассмотрим, как влияют особенности химических связей на свойства твердых веществ. Твердые вещества делятся на кристаллические и аморфные.
Аморфные вещества не имеют четкой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находятся пластилин и различные смолы.
Кристаллические вещества характеризуются правильным расположением тех частиц, из которых они состоят: атомов, молекул и ионов — в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки, в которых размещены частицы кристалла, называют узлами решетки.
В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионные кристаллические решетки.
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы $Na^, Cl^$, так и сложные $SO_4^, ОН^–$. Следовательно, ионными кристаллическими решетками обладают соли, некоторые оксиды и гидроксиды металлов.
Вещества молекулярного и немолекулярного строения | химия
Например, кристалл хлорида натрия состоит из чередующихся положительных ионов $Na^+$ и отрицательных $Cl^–$, образующих решетку в форме куба. Связи между ионами в таком кристалле очень устойчивы. Поэтому вещества с ионной решеткой отличаются сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
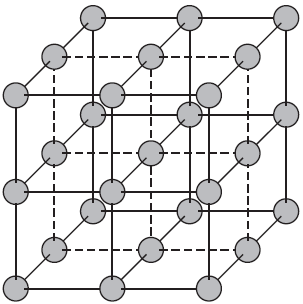
Атомные кристаллические решетки.
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентными связями. Примером веществ с таким типом кристаллических решеток может служить алмаз — одно из аллотропных видоизменений углерода.
Большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (например, у алмаза она выше $3500°С$), они прочны и тверды, практически нерастворимы.
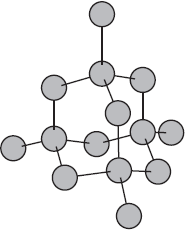
Молекулярные кристаллические решетки.
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы. Химические связи в этих молекулах могут быть и полярными ($HCl, H_2O$), и неполярными ($N_2, O_2$). Несмотря на то, что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, летучи. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).

Металлические кристаллические решетки.
Вещества с металлической связью имеют металлические кристаллические решетки. В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны «в общее пользование»). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.
Источник: examer.ru
Серебро молекулярное строение или немолекулярное
Ключевые слова конспекта: строение веществ, кристаллические решетки, электроотрицательность.
Молекулярное и немолекулярное строение веществ
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. Вещества при заданных условиях могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном. Свойства веществ зависят также и от характера химической связи между частицами, которые их образуют — молекулами, атомами и ионами. По типу связи различают вещества молекулярного и немолекулярного строения.
Вещества, которые состоят из молекул, называются молекулярными. Связи между молекулами в таких веществах очень слабые, значительно слабее, чем между атомами в середине молекулы. Уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость, а затем в газ (сублимация газа). Температура плавления и кипения веществ, которые состоят из молекул, повышается с увеличением молекулярной массы. К молекулярным веществам относятся вещества с атомной структурой (C, Si, Li, Na, K, Cu, Fe, W), среди них имеются металлы и неметаллы.
Простые вещества — неметаллы могут иметь молекулярное и атомное строение. Молекулярное строение при н. у. имеют газы (H2, N2, F2, Cl2, O3) либо твердые вещества (I2, P4, S8), а также единственная жидкость (Br2). Все эти вещества имеют молекулярное строение и обладают летучестью. В твердом состоянии они легкоплавкие и могут сублимироваться. Температуры кипения и плавления низкие.
К веществам немолекулярного строения относятся ионные соединения. Такие структуры имеют большинство соединений металлов с неметаллами: все соли (NaCl, K2SO4), некоторые гидриды (LiH) и оксиды (CaO, MgO, FeO), основания (NaOH, KOH). Ионные (немолекулярные) вещества имеют высокие температуры плавления и кипения.
Кристаллические решетки
Твердые вещества принято делить на кристаллические и аморфные.
Аморфные вещества не имеют четкой структуры, в них не существует закономерного расположения отдельных частиц. Следовательно, аморфные вещества не имеют и четкой температуры плавления. При нагревании они постепенно размягчаются и переходят в текучее состояние. К аморфным веществам относится большинство органических веществ (воск, стекло, полиэтилен, парафин, пластилин, смолы).
Кристаллические вещества характеризуются структурированным, упорядоченным расположением составляющих их частиц в строго определенных точках пространства, расположенных на определенном расстоянии друг от друга. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки расположения частиц, составляющих кристаллическую решетку, называют узлами решетки.

Тип кристаллической решетки определяется видом частиц, расположенных в ее узлах, и характером связи между этими частицами. Различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
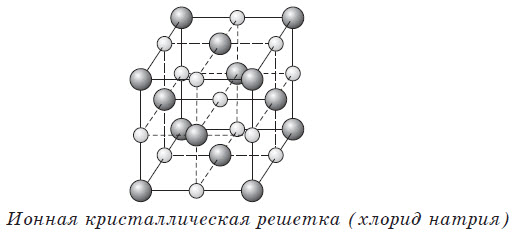
Ионные кристаллические решетки в своих узлах содержат ионы. Их образуют вещества с ионной связью, которая связывает как простые (Na + , Cl – ), так и сложные (OH – ) ионы. Таким образом, ионные кристаллические решетки имеют соли, некоторые оксиды и гидроксиды металлов. Например, кристалл NaCl состоит из перемежающихся положительных ионов Na + и отрицательных Cl – , которые образуют решетку куба. Связи в таком кристалле прочные, вещества с такой решеткой имеют высокую прочность и твердость, они тугоплавкие.
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены прочными ковалентными связями. Примером вещества с таким типом кристаллической решетки может быть алмаз — аллотропное видоизменение углерода.

Молекулярными называют кристаллические решетки, в узлах которых расположены молекулы. Химические связи у этих молекул могут быть как полярными (HCl, H2O), так и неполярными (N2, O2).

Несмотря на то, что атомы в молекулах связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного взаимодействия. Вещества с молекулярным типом решеток имеют низкую прочность, низкие температуры плавления, они летучи. Молекулярные кристаллические решетки имеют большинство органических соединений (нафталин, глюкоза, сахар).

Вещества с металлической связью имеют металлические кристаллические решетки. В узлах таких решеток расположены атомы и ионы (атомы металла переходят в ионы и отдают внешние электроны в общее пользование). Такая внутренняя структура металла определяет его характерные свойства: ковкость, пластичность, электро- и теплопроводность, металлический блеск.
Электроотрицательность
В основе образования химических связей лежит явление электроотрицателъности. В ходе химических взаимодействий одни атомы отдают электроны, другие их присоединяют.
Электроотрицательность — это условная величина, характеризующая относительную способность атома приобретать отрицательный заряд.
Фактически электроотрицательность выражает способность атома оттягивать к себе общие электронные пары, участвующие в образовании химической связи.
Электроотрицательность атома определяет характер его свойств: сильнее всего металлические свойства проявляются у элементов, атомы которых легко отдают электроны, а неметаллические — соответственно у элементов, атомы которых легко их присоединяют.
Абсолютные значения электроотрицательности элементов выражаются числами, затрудняющими их практическое применение для вычислений, поэтому в химии используют значения относительной электроотрицателъности. Условно за единицу принимают значение электроотрицательности лития (Li).
Чем меньше значение относительной элетроотрицательности, тем ярче выражены металлические свойства элемента. У всех металлов в периодической системе значение относительной электроотрицательности, как правило, меньше 2. У неметаллов это значение, как правило, превышает 2.
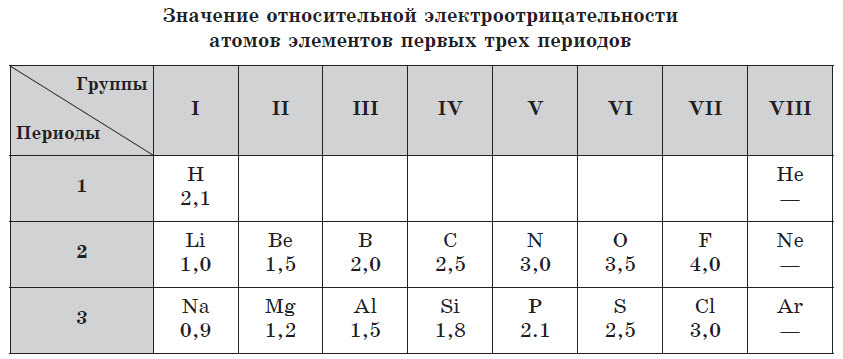
Электроотрицательность элементов также изменяется периодически: в периодах возрастает слева направо, а в главных подгруппах — снизу вверх.
При образовании химических связей электроны переходят или смещаются к атомам элементов, которые обладают большей электроотрицательностью.
Конспект урока «Строение веществ. Электроотрицательность».
Источник: uchitel.pro