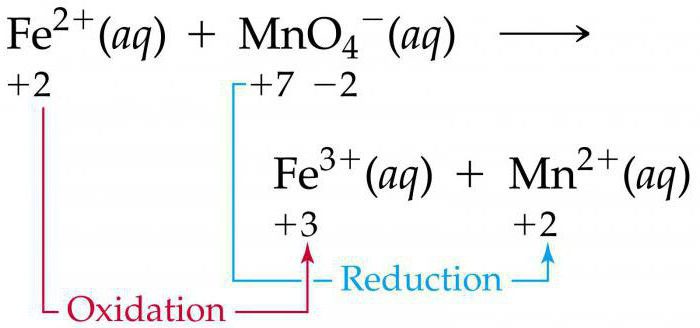
Что такое ОВР? Химия состоит из множества разделов, один из них рассматривает взаимодействия веществ, в результате которых у элементов (веществ) меняются показатели их степеней окисления. Рассмотрим основные термины, связанные с данной проблемой, приведем примеры взаимодействий.
Основные определения
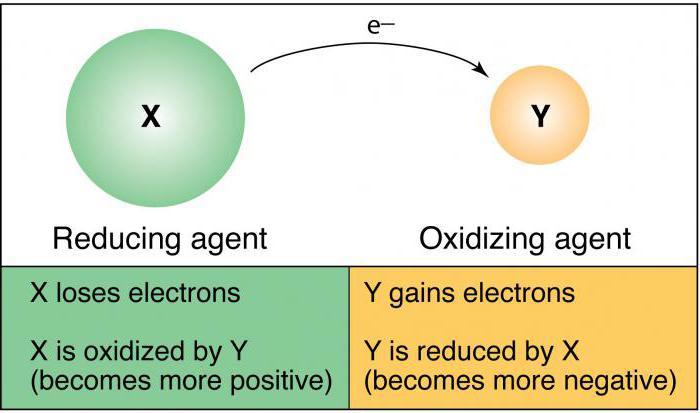
В школьной программе рассматривается метод ОВР. Химия базируется на составлении баланса между количеством отданных (принятых) электронов. Окислителем является ион или атом, принимающий в процессе взаимодействия отрицательные частицы. Процесс, который при этом происходит, называется восстановлением. Восстановителем считают атомы или ионы, которые лишаются своих электронов, окисляясь при этом.

Значимость ОВР
Какое значение имеют ОВР? Химия располагает множеством примеров, когда данные превращения приводили к негативным последствиям. Например, до сих пор ученые не установили истинную причину разрушения статуи Колосса Родосского. Химики убеждены в том, что именно коррозия, которая является ОВР, стала причиной разрушения уникального памятника. В организме живых существ данные превращения обеспечивают обменные процессы.
Окислительно восстановительные реакции
Алгоритм разбора
Как правильно разбирать реакции ОВР? Химия школьного курса основывается на составлении электронного баланса между окислителем и восстановителем. Остановимся подробнее на последовательности действий школьников. Сначала необходимо поставить степени окисления у всех элементов, имеющихся в реакции. Для того чтобы успешно справиться с поставленной задачей, важно знать правила.
Далее необходимо выявить те вещества, в которых после взаимодействия значения степеней окисления изменились.
При составлении электронного баланса, с помощью знака «плюс» показывают число принятых частиц, а «минусом» показывают количество отданных электронов. Между ними определяется наименьшее общее кратное, затем вычисляются индексы. Завершающим этапом будет расстановка коэффициентов в ОВР. Химия неорганических и органических веществ тесно связана с данным типом взаимодействий, к тому же задания предлагаются школьникам на выпускных испытаниях в 9 и 11 классах.
Первый пример
Разве ОВР — химия? Как решать такие задания? Данный вопрос является актуальным для ребят, которые выбрали предмет в качестве выпускного экзамена. На примере взаимодействия оксида железа (3) и угарного газа (оксида углерода (2)) рассмотрим последовательность действий.

Итак, дана схема Fe2O3 + CO → Fe + CO2, ее нужно рассмотреть как ОВР. ЕГЭ (химия) в 11 классе предполагает самостоятельное дополнение школьниками схемы недостающими веществами, но мы начнем с более простого задания, в котором уже даны все участники процесса. Как проверить, что это ОВР? Химия отвечает на этот вопрос посредством степеней окисления. Так как железо превращается из +3 в простое вещество с нулевым показателем степени окисления, а углерод повышает ее с +2 до +4, процесс является ОВР.
Окислительно-восстановительные свойства 4-х валентного церия
Баланс данного задания имеет следующий вид:
Наименьшее общее кратное составляет 6. Железо является окислителем, угарный газ проявляет восстановительную способность. В готовом виде процесс имеет вид:
Fe2O3 + 3CO → 2Fe + 3CO2
Второй пример
ОВР в органической химии рассматривается по такому же алгоритму, есть только некоторые отличия в расстановке степеней окисления. Одно из заданий ЕГЭ посвящено вопросам, связанным с расстановкой коэффициентов в ОВР. Для успешного выполнения данного задания сначала школьники должны подумать, какие недостающие вещества им нужно вписать, и только после этого переходить к алгоритму разбора ОВР.

Например, с помощью электронного баланса необходимо составить уравнение:
PH3 + AgNO3 +… = Ag + HNO3
Для начала выявим, какое вещество пропущено в левой части данного взаимодействия. С учетом того, что серебро проявляет окислительные свойства, а фосфор будет восстановителем, недостающим веществом станет вода.
При составлении электронного баланса, получаем следующий вид:
P(-3) отдает 8 электронов = P(+5) 1
Ag(+) принимает электрон = Ag(0) 8
При расстановке коэффициентов, получаем запись процесса:
PH3 + 8 AgNO3 + 4H2O = 8Ag + 8HNO3 + H3PO4
PH3 — восстановитель, AgNO3 — окислитель
Третий пример
Воспользовавшись методом электронного баланса, решите уравнение:
Cr2 (SO4) 3 +…+ NaOH = Na2CrO4 + NaBr +…+ H2O
В данной схеме пропущено два вещества, поэтому сначала восстановим пробелы. Хром в данном процессе меняет степень окисления с +3 на +6, следовательно, им проявляются окислительные характеристики. Восстановитель в задании упущен, поэтому его функцию будет выполнять молекулярный бром. Среди продуктов реакции должна быть соль натрия, ею будет сульфат.
Электронный баланс для данного превращения имеет вид:
2Cr(+3) — 6e = 2Cr(+6) 1
Br2(0) + 2e = 2Br — 3
При расстановке в схеме коэффициентов учитываем, что атом натрия находится в составе нескольких веществ, поэтому его необходимо суммировать:
Cr2(SO4) 3+3 Br2 + 16NaOH = 2Na2CrO4 + 6 NaBr + 3Na2 SO4 + 8H2O
- Cr2(SO4) 3 является окислителем;
- Br2 выступает в роли восстановителя.
Четвертый пример
Воспользовавшись электронным балансом, решите уравнение:
KMnO4 + H2S + H2SO4 = S+ Mn SO4 +…+…
В задании есть два пропуска, причем оба вещества являются продуктами взаимодействия. Учитывая, что в данной схеме в качестве окислителя выступает марганец, а восстановительные свойства характерны для серы, степени окисления в пропущенных веществах остаются неизменными. Ими будет сульфат калия и вода.

Электронный баланс данного процесса:
Mn(+7) забирает 5 e = Mn(+2) 2
S(-2) отдает 2e = S(0) 5
Конечный вариант предлагаемой схемы ОВР имеет следующий вид:
2KMnO4 + 5H2S + 3H2SO4 = 5S + 2MnSO4 + 8H2O + K 2SO4
Перманганат калия проявляет окислительные свойства, сероводород является восстановителем.
Пятый пример
Заполните пропуски, расставьте коэффициенты в предложенной схеме превращений:
KMnO4 + H2SO4 + KBr = MnSO4 + Br2 +…+…
В данном взаимодействии окислительные параметры демонстрирует марганец, входящий в состав марганцовки. Бром, входящий в бромид калия, является восстановителем. Следовательно, среди продуктов реакции должны быть такие вещества, в которых не наблюдается изменений степеней окисления. Недостающими веществами будут выступать вода и сульфат калия. Процесс передачи электронов:
Mn(+7) принимает 5e = Mn(+2) 2
2Br(-) отдает 2e = Br2(0) 5
Расставим полученные коэффициенты в предложенную схему, получим следующее уравнение:
2KMnO4 + 8H2SO4 + 10KBr = 2MnSO4 + 5Br2 + 8H2O + 6K2SO4
- Перманганат калия — окислитель.
- Бромид калия — восстановитель.
Шестой пример
Воспользовавшись электронным балансом, поставьте коэффициенты в предложенной схеме превращений:
Пропуски веществ даны в правой части. Чтобы выявить продукты, определяем окислитель и восстановитель. В левой части берется сильная кислота, поэтому в продуктах будет вода. Вторым пропущенным соединением будет являться фосфорная кислота.

Электронный баланс имеет вид:
P(0) отдает 5e = P(+5) 1
N(+5) принимает e = N(+4) 5
Приступаем к расстановке коэффициентов в уравнении:
P + 5HNO3 = 5NO2 + H2O + H3PO4
- Фосфор — восстановитель.
- Азотная кислота — окислитель.
Заключение
Разбор окислительных и восстановительных процессов методом электронного баланса является одним из тех заданий, которые вызывают серьезные проблемы у выпускников девятого и одиннадцатого классов. Именно поэтому важно отработать алгоритм действий, чтобы ребята успешно выполняли задания данного типа. Среди типичных ошибок, которые допускаются ребятами, выделим неправильную расстановку степеней окисления у элементов в сложных веществах.
Также довольно много проблем возникает при определении количества принятых и отданных атомами (ионами) электронов. Ребята неправильно определяют окислитель и восстановитель, допускают ошибки при расстановке коэффициентов в схеме уравнения. Задания, связанные с ОВР, считаются сложными, поэтому предполагают отработку порядка действий во внеурочной деятельности.
Источник: www.syl.ru
Окислительно-восстановительные реакции
9.1. Дайте оценку восстановительных свойств Zn и окислительно-восстановительных свойств его ионов в зависимости от его рН среды (используйте справочные характеристики).
Цинк – сильный восстановитель. На реакции цинка и ионами меди основана работа химического элемента Даниеля. Нормальный электродный потенциал цинка — 0.7618 В. как восстановитель цинк используют в многих химических процессах, например, он используется при восстановлении органических веществ, и т.п.
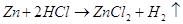
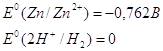
Также цинк может восстанавливать металлы менее активные чем он сам в нейтральной среде. Он восстанавливает металлы от хрома (-0,74 В) до серебра (0,79 В). Это его свойство часто используют для изготовления гальванических элементов.
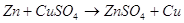
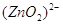
В щелочной среде цинк окисляется до иона , он также может восстанавливать водород из воды, восстанавливает многие неорганические соли, кислородные соединения.
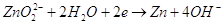
Нормальный электродный потенциал электрода равен для реакции: -1,216 В, это значит, что цинк может восстанавливать в щелочной среде все соединения с более положительным потенциалом, это будут кислородные соединения хрома, марганца, олова, свинца и т.п.
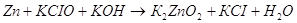
Приведенное выше уравнение будет примеров взаимодействия цинка в щелочной среде.

9.2. Составьте уравнения 3-х окислительно-восстановительных реакций ( с использованием вещества содержащего ионы данного металла) при рН>7, рН=7, рН
Предварительно рассчитайте Е 0 химической реакции, используя метод электронно-ионного баланса.
Для указанных уравнений запишем окислительно-восстановительные уравнения реакций. Сначала рассмотрим эти уравнения и решим их с помощью электронного баланса.
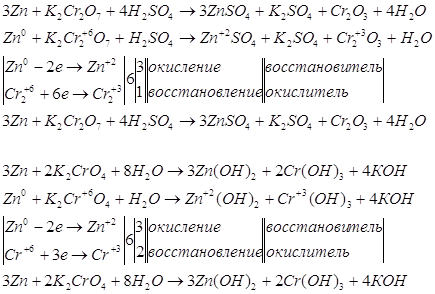
Запишем уравнения электронно-ионного баланса.
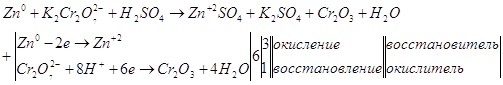

Запишем полученное уравнение в молекулярном виде:
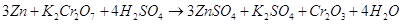
Рассчитаем Е 0 химической реакции.
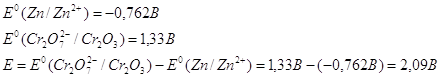
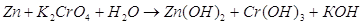
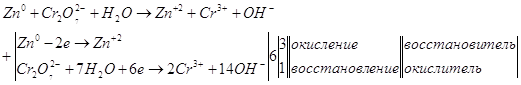
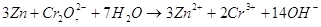
Запишем полученное уравнение в молекулярном виде:
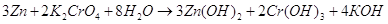
Рассчитаем Е 0 химической реакции.
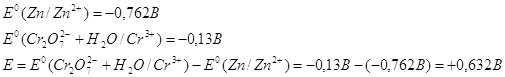
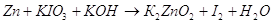
Составим уравнения ионно-электронного баланса.
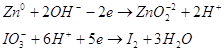
Просуммируем полученные полу реакции.
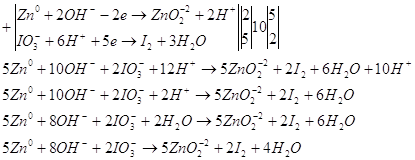
Запишем уравнение в молекулярном виде.
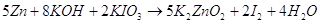
Рассчитаем Е 0 химической реакции.
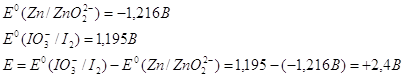
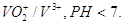
10.3. Составьте и опишите схему гальванического элемента из металлического электрода данного металла и электродной системы С,
Гальванический элемент состоит из катода и анода. Одним из электродов в нашем случае будет цинковый электрод, другим электродом будет инертный угольный электрод.
Запишем схему электрода.
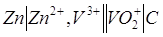
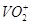
Гальванический элемент состоит из цинковой пластины опущенной в раствор соли, что содержит ионы V 3+ и H + . поскольку РН
Цинковая пластинка в гальваническом элементе легко отдает свои катионы в раствор, тогда она будет окислятся.
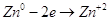
Каждый ион цинка, переходя в раствор, оставляет на пластинке два электрона. Из-за этого пластинка получит отрицательный заряд. На угольном электроде будут проходить процессы восстановления:
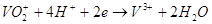
Если цепь замкнуть, то в гальваническом элементе возникнет электрический ток. Электроны из места, где плотность отрицательного заряда высока, будут переходить в место с меньшей плотностью отрицательного заряда.
В целом химическую реакцию. Которая происходит в гальваническом элементе можно записать так: 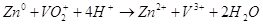 . В молекулярном виде уравнение будет иметь такой вид:
. В молекулярном виде уравнение будет иметь такой вид: 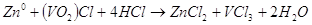 .
.
Важной характеристикой любого гальванического элемента будет его ЭРС. Она равна: 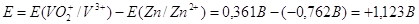 , если округлить полученное значение ЭРС, то мы получим:
, если округлить полученное значение ЭРС, то мы получим: 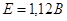 . При вычислении ЭРС мы не учитывали влияния концентрации ионов на величину потенциала, а приведенные значения точны только для ситуации, когда концентрации веществ равны нулю. Поэтому значение ЭРС в реальных гальванических элементах будет несколько другим. Также надо отметить, что чаще используется медно-цинковые гальванические элементы, которые более дешевы чем элементы с использованием ванадия.
. При вычислении ЭРС мы не учитывали влияния концентрации ионов на величину потенциала, а приведенные значения точны только для ситуации, когда концентрации веществ равны нулю. Поэтому значение ЭРС в реальных гальванических элементах будет несколько другим. Также надо отметить, что чаще используется медно-цинковые гальванические элементы, которые более дешевы чем элементы с использованием ванадия.
Источник: kazedu.com
Восстановительными свойствами обладают. Окислительно-восстановительные свойства
Окислительно-восстановительные свойства отдельных атомов, а также ионов являются важным вопросом современной химии. Данный материал помогает объяснять активность элементов и веществ, проводить детальное сравнение химических свойств у разных атомов.

Что такое окислитель
Многие задачи по химии, включая тестовые вопросы единого государственного экзамена в 11 классе, и ОГЭ в 9 классе, связаны с данным понятием. Окислителем считают атомы либо ионы, которые в процессе химического взаимодействия принимают электроны от другого иона либо атома. Если анализировать окислительные свойства атомов, нужна периодическая система Менделеева.
В периодах, располагающихся в таблице слева направо, окислительная способность атомов возрастает, то есть меняется аналогично неметаллическим свойствам. В основных подгруппах подобный параметр уменьшается сверху вниз. Среди самых сильных простых веществ, обладающих окислительной способностью, лидирует фтор. Такой термин, как «электроотрицательность», то есть возможность атома принимать в случае химического взаимодействия электроны, можно считать синонимом окислительных свойств. Среди сложных веществ, которые состоят из двух и больше химических элементов, яркими окислителями можно считать: перманганат калия, хлорат калия, озон.

Что такое восстановитель
Восстановительные свойства атомов характерны для простых веществ, проявляющих металлические свойства. В таблице Менделеева в периодах металлические свойства слева направо ослабевают, а в основных подгруппах (вертикально) они усиливаются. Суть восстановления в отдаче электронов, которые располагаются на внешнем энергетическом уровне. Чем большее количество электронных оболочек (уровней), тем легче отдать во время химического взаимодействия «лишние» электроны.
Отличными восстановительными свойствами обладают активные (щелочные, щелочно-земельные) металлы. Кроме того, веществ, проявляющих подобные параметры, выделим оксид серы (6), угарный газ. Для того чтобы приобрести максимальную степень окисления, данные соединения вынуждены проявлять восстановительные свойства.
Процесс окисления
Если во время химического взаимодействия атом либо ион отдает электроны иному атому (иону), идет речь о процессе окисления. Для анализа того, как меняются восстановительные свойства и окислительная способность, потребуется таблица элементов Менделеева, а также знание современных законов физики.

Процесс восстановления
Восстановительные процессы предполагают принятие ионами либо атомами электронов от других атомов (ионов) во время непосредственного химического взаимодействия. Отличными восстановителями являются нитриты, сульфиты щелочных металлов. Восстановительные свойства в системе элементов меняются аналогично металлическим свойствам простых веществ.
Алгоритм разбора ОВР
Для того чтобы в готовой химической реакции учащийся мог расставить коэффициенты, необходимо воспользоваться специальным алгоритмом. Окислительно-восстановительные свойства помогают решать и разнообразные расчетные задачи в аналитической, органической, общей химии. Предлагаем порядок разбора любой реакции:
- Сначала важно определить у каждого имеющегося элемента степень окисления, используя правила.
- Далее определяют те атомы либо ионы, которые поменяли свою степень окисления, будут участвовать в реакции.
- Знаками «минус» и «плюс» указывают число отданных и принятых в ходе химической реакции свободных электронов.
- Далее между числом всех электронов определяется минимальное общее кратное, то есть целое число, которое без остатка делится на принятые и отданные электроны.
- Затем его делят на электроны, участвовавшие в химической реакции.
- Далее определяем, какие именно ионы либо атомы восстановительными свойствами обладают, а также определяют окислители.
- На завершающем этапе ставят коэффициенты в уравнении.
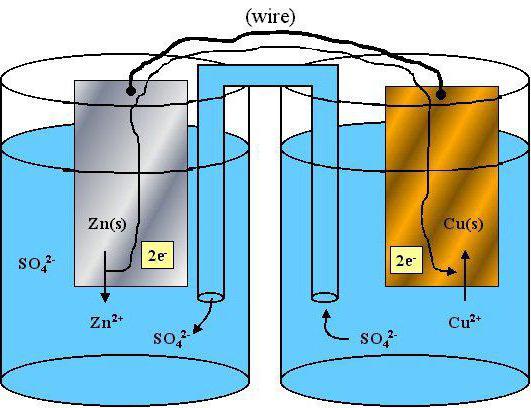
Применяя способ электронного баланса, расставим коэффициенты в данной схеме реакции:
NaMnO4 + сероводород + серная кислота= S + Mn SO4 +…+…
Алгоритм решения поставленной задачи
Выясним, какие именно должны после взаимодействия образоваться вещества. Так как в реакции уже есть окислитель (им будет марганец) и определен восстановитель (им будет сера), образуются вещества, в которых уже не меняются степени окисления. Так как основная реакция протекала между солью и сильной кислородсодержащей кислотой, то одним из конечных веществ станет вода, а вторым — соль натрия, точнее, сульфат натрия.
Составим теперь схему отдачи и принятия электронов:
— Mn +7 берет 5 e= Mn +2.
Вторая часть схемы:
— S -2 отдает2e= S 0
Ставим в исходную реакцию коэффициенты, не забывая при этом суммировать все атомы серы в частях уравнения.
Разбор ОВР с участием перекиси водорода
Применяя алгоритм разбора ОВР, можно составить уравнение протекающей реакции:
перекись водорода + серная кислота + пермагнанат калия = Mn SO4 + кислород + …+…
Степени окисления изменили ион кислорода (в перекиси водорода) и катион марганца в перманганате калия. То есть восстановитель, а также окислитель у нас присутствуют.
Определим, что за вещества еще могут получиться после взаимодействия. Одно из них будет водой, что вполне очевидно, представлена реакция между кислотой и солью. Калий не образовал нового вещества, вторым продуктом станет соль калия, а именно сульфат, так как реакция шла с серной кислотой.
2O – отдает 2 электрона и превращается в O 2 0 5
Mn +7 принимает 5 электронов и становится ионом Mn +2 2
Пример разбора ОВР с участием хромата калия
Используя способ электронного баланса, составим уравнение с коэффициентами:
Степени окисления поменяли железо (в хлориде железа II) и ион хрома в бихромате калия.
Теперь постараемся выяснить, какие еще вещества образуются. Одно может быть солью. Поскольку калий не образовал никакого соединения, следовательно, вторым продуктом будет соль калия, точнее, хлорид, ведь реакция проходила с соляной кислотой.
Fe +2 отдает e = Fe +3 6 восстановитель,
2Cr +6 принимает 6 e = 2Cr +3 1 окислитель.
Поставим коэффициенты в начальную реакцию:

Пример разбора ОВР с участием иодида калия
Вооружившись правилами, составим уравнение:
перманганат калия + серная кислота + иодид калия. сульфат марганца + йод +…+…
Степени окисления изменили марганец и йод. То есть восстановитель и окислитель присутствуют.
Теперь выясним,что в итоге у нас образуется. Соединение будет у калия, то есть получим сульфат калия.
Восстановительные процессы протекают у ионов йода.
Составим схему передачи электронов:
— Mn +7 принимает 5 e = Mn +2 2 является окислителем,
— 2I — отдает 2 e = I2 0 5 является восстановителем.
Расставляем коэффициенты в начальную реакцию, не забываем при этом суммировать все атомы серы в данном уравнении.
Пример разбора ОВР с участием сульфита натрия
Используя классический метод, составим для схемы уравнение:
— серная кислота + KMnO4 + сульфит натрия. сульфат натрия + сульфат марганца +…+…
После взаимодействия получим соль натрия, воду.
— Mn +7 принимает 5 e= Mn +2 2,
— S +4 отдает 2 e = S +6 5.
Расставляем коэффициенты в рассматриваемую реакцию, не забываем складывать атомы серы при расстановке коэффициентов.
Пример разбора ОВР с участием азота
Выполним следующее задание. Пользуясь алгоритмом, составим полное уравнение реакции:
Проанализируем, какое вещество еще образуется. Так как реакция проходила между сильным окислителем и солью, значит, веществом будет вода.
Покажем изменение числа электронов:
— Mn +2 отдает 5 e = Mn +7 2 проявляет свойства восстановителя,
— Pb +4 принимает 2 e = Pb +2 5 окислителем.
3. Расставляем коэффициенты в исходную реакцию, обязательно складываем весь азот, имеющийся в левой части исходного уравнения:
В данной реакции не проявляются восстановительные свойства азота.
Второй образец окислительно-восстановительной реакции с азотом:
Zn + серная кислота + HNO3= ZnSO4 + NO+…
— Zn 0 отдает 2 e = Zn +2 3 будет восстановителем,
N +5 принимает 3 e = N +2 2 является окислителем.
Расставляем коэффициенты в заданную реакцию:
Значимость окислительно-восстановительных реакций
Самые известные восстановительные реакции — фотосинтез, характерный для растений. Как изменяются восстановительные свойства? Процесс происходит в биосфере, приводит к повышению энергии с помощью внешнего источника. Именно эту энергию и использует для своих нужд человечество.
Среди примеров окислительных и восстановительных реакций, связанных с химическими элементами, особое значение имеют превращения соединений азота, углерода, кислорода. Благодаря фотосинтезу земная атмосфера имеет такой состав, который необходим для развития живых организмов. Благодаря фотосинтезу не увеличивается количество углекислого газа в воздушной оболочке, поверхность Земли не перегревается. Растение не только развивается с помощью окислительно-восстановительной реакции, но и образует такие нужные для человека вещества, как кислород, глюкоза. Без данной химической реакции невозможен полноценный круговорот веществ в природе, а также существование органической жизни.
Практическое применение ОВР
Для того чтобы сохранить поверхность металла, необходимо знать, что восстановительными свойствами обладают активные металлы, поэтому можно покрывать поверхность слоем более активного элемента, замедляя при этом процесс химической коррозии. Благодаря наличию окислительно-восстановительных свойств осуществляется очистка и дезинфекция питьевой воды. Ни одну задачу нельзя решить, не расставив правильно в уравнении коэффициенты. Для того чтобы избежать ошибок, важно иметь представление обо всех окислительно-восстановительных параметрах.
Защита от химической коррозии
Особую проблему для жизни и деятельности человека представляет коррозия. В результате данного химического превращения происходит разрушение металла, теряют свои эксплуатационные характеристики детали автомобиля, станков. Для того чтобы исправить подобную проблему, используется протекторная защита, покрытие металла слоем лака либо краски, применение антикоррозионных сплавов. Например, железная поверхность покрывается слоем активного металла — алюминия.
Заключение
Разнообразные восстановительные реакции происходят и в организме человека, обеспечивают нормальную работу пищеварительной системы. Такие основные процессы жизнедеятельности, как брожение, гниение, дыхание, также связаны с восстановительными свойствами. Обладают подобными возможностями все живые существа на нашей планете.
Без реакций с отдачей и принятием электронов невозможна добыча полезных ископаемых, промышленное производство аммиака, щелочей, кислот. В аналитической химии все методы объемного анализа основаны именно на окислительно-восстановительных процессах. Борьба с таким неприятным явлением, как химическая коррозия, также основывается на знании этих процессов.
Источник: fb.ru