Электролитический металлический порошок – это металлический порошок, полученный электролизом растворов или расплавов соединений металлов. Электролиз представляет собой своеобразный процесс восстановления, осуществляемый не с помощью восстановителей, а за счет использования энергии электрического тока. К преимуществам этого процесса относят универсальность, высокую чистоту получаемых металлических порошков и их хорошие технологические свойства. Недостатки электролиза – большая энергоемкость, низкая производительность, необходимость утилизации большого количества жидких отходов производства.
Электролитическое получение порошков заключается в разложении водных растворов соединений выделяемого металла или его бескислородных расплавленных солей при пропускании через них постоянного электрического тока и последующей разрядке соответствующих ионов металла на катоде. Используемые при электролизе растворы или расплавы солей называют электролитами и относят к проводникам второго рода. Сам процесс электрохимического превращения происходит на границе электрод (анод или катод) – электролит (раствор или расплав). Источник электрического тока играет роль своеобразного «насоса», перекачивающего ионы с одного полюса электроцепи на другой.
Электролиз расплавов и растворов (солей, кислот и щелочей)
Источником ионов выделяемого металла служат, как правило, анод и/или электролит, в составе которого находится растворимое (расплавленное) соединение соответствующего металла. В случае, когда используют нерастворимые аноды, источником выделяемого металла является только электролит.
Ионы в электролите в отсутствие электрического поля движутся хаотично. При наложении электрического поля движение ионов становится более упорядоченным: положительно заряженные ионы (катионы) приближаются к катоду, а отрицательно заряженные ионы (анионы) – к аноду.
Электролиз является одновременно и рафинированием, так как при некотором напряжении на катоде будут (преимущественно) выделяться только катионы определенного металла. В соответствии с величиной напряжения, требуемого для выделения на катоде, металлы образуют «ряд напряжений». Например: цинк, железо, олово, медь, серебро, золото. Чем левее находится металл в этом ряду, тем он более электроотрицателен или менее благороден, более активен (по отношению к кислороду кислотам, щелочам и пр.) и тем большее напряжение требуется для его выделения на катоде.
В равновесных условиях (при фиксированном напряжении), пока на катоде выделяется какой-либо металл ионы более электроотрицательных по отношению к нему элементов разряжаться не будут. Однако в реальных условиях в переносе зарядов наряду с ионами выделяемого металла участвуют и ионы более электроотрицательных элементов. А это приводит к их выделению на катоде. Как правило, этот процесс сопровождается повышением напряжения на катоде («перенапряжением»).
Чем больше сродство металла к кислороду, тем труднее его выделить из водного раствора. Поэтому такие металлы, как алюминий, магний, цирконий, титан и прочие, получают путем электролиза расплавленных солей соответствующего металла.
Электролиз расплавов и растворов солей.Теория для задания 22 ЕГЭ по химии
В соответствии с законом Фарадея, количество катодного осадка, выделившегося при электролизе, пропорционально силе тока, времени его прохождения через электролит и электрохимическому эквиваленту, т.е. количеству металла, выделяемого за один ампер-час. Однако реально получаемые при электролизе количества осадка всегда меньше, чем рассчитанные. Это объясняется тем, что в процессе электролиза происходит совместный разряд на катоде ионов нескольких элементов (как правило, двух-трех), частичное растворение выделенного металла и пр.
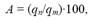
Кроме того, возможна и утечка тока через дефекты электроизоляции. Для оценки степени несовпадения расчетных и реально полученных количеств осадка используют такой показатель, как выход по току, %: где qn – масса вещества (осадка), реально выделившаяся при прохождении определенного количества электричества через электролит; qm – масса вещества (осадка), которая должна была бы выделиться.
На свойства получаемых порошков оказывают влияние следующие факторы технологического процесса.
Плотность тока. Плотность тока связывает силу тока с суммарной рабочей поверхностью катодов (катодная плотность тока) или анодов (анодная плотность тока), находящихся в ванне электролизера: i = I/S, где i – плотность тока, А/м 2 ; I – сила тока на ванне, A; S – суммарная рабочая поверхность катодов или анодов соответственно, м 2 .
Как правило, катодная и анодная плотности тока в электролизере не совпадают, так как практически всегда не совпадают суммарные рабочие поверхности катодов и анодов. Выделение металла на катоде начинается в центрах первичной кристаллизации.
При большей плотности тока в ванне на единице площади катода разряжается больше ионов, т.е. на катоде создается больше первичных центров кристаллизации. В связи с этим при низкой концентрации катионов в электролите скорость роста каждого из подобных центров уменьшается. Это приводит к получению более мелких (дисперсных) осадков.
Однако при большой плотности тока высоко и напряжение на ванне, что обуславливает выделение на катоде побочных элементов (а не только атомов получаемого металла) и снижению выхода по току. С повышением катодной плотности тока растет и анодная плотность тока, в результате чего на аноде начинается более интенсивная разрядка анионов кислорода (при электролизе водных растворов), хлора или фтора (при электролизе расплавов). Это может привести к проявлению анодного эффекта: электролит как бы отделяется от электрода прослойкой газа и в ней возникает искрение. Выделение металла на катоде практически прекращается. Поэтому необходимо подбирать такие плотности тока, которые позволят избежать появления анодного эффекта.
Плотность тока можно корректировать либо за счет изменения токовых нагрузок на ванне, либо путем изменения суммарной рабочей поверхности катодов (количества катодов).
Концентрация ионов выделяемого металла. Повышение концентрации выделяемых ионов (при низкой плотности тока) создает благоприятные условия для активного питания сравнительно небольшого количества центров, в результате чего формируется плотный осадок. Для образования порошкообразного (рыхлого) осадка нужна пониженная концентрация ионов металла в электролите. Однако при слишком малой концентрации ионы металла перенесут лишь небольшую долю электроэнергии, в связи с чем в процесс электропереноса будут вовлекаться и другие катионы, например водорода, что приведет к снижению выхода по току.
Температура электролита. Повышение температуры увеличивает скорость перемещения ионов и ускоряет их диффузионную подвижность. Это компенсирует обеднение приэлектродной области электролита катионами.
Стабильное «питание» центров кристаллизации способствует укрупнению порошков, но одновременно с этим возрастает и интенсивность химического взаимодействия выделяемого металла с электролитом. Это приводит к растворению катодного осадка и снижению выхода по току. Кроме того, увеличивается испарение электролита, что обуславливает ухудшение условий труда. Поэтому электролиз водных растворов ведут при температуре электролита не выше 60 °С, а электролиз расплавов – при температуре, которая должна быть выше температуры плавления электролита (при сохранении электролитом требуемой относительно достаточной жидкотекучести), но ниже температуры плавления выделяемого металла.
Кислотность электролита. Повышение содержания в электролите ионов водорода может привести к их бурному выделению на катоде. Это, с одной стороны, способствует разрыхлению (измельчению) порошка, но, с другой стороны, обуславливает существенное уменьшение выхода по току и возрастание расхода энергии. Кроме того, повышенная кислотность электролита приводит к растворению части металла, выделившегося на катоде.
Межэлектродное расстояние. Увеличение расстояния между электродами (при постоянном напряжении на ванне) способствует повышению электросопротивления электролита. При этом падает сила тока на ванне, уменьшается его катодная плотность, что обуславливает получение более крупных порошков. Одновременно снижается относительное количество растворяющегося в электролите катодного осадка и увеличивается выход по току. Однако при чрезмерном увеличении межэлектродного расстояния возрастает количество выделяемого тепла, что может привести к перегреву электролита и уменьшению выхода по току за счет растворения части катодного осадка.
При слишком малом расстоянии между электродами может произойти короткое замыкание, напряжение на ванне упадет до нуля, и выделение порошка на катоде прекратится, хотя сила тока в ней будет такой же, как и в нормально работающих ваннах.
Длительность наращивания слоя порошка на катоде. В процессе роста частиц порошка значительно увеличивается их суммарная поверхность (особенно у рыхлых осадков), а следовательно, возрастает и суммарная поверхность самих катодов. Это, в свою очередь, приводит к снижению плотности тока и образованию на катоде более крупных частиц (на катоде может сформироваться губка или даже плотная корка). Несвоевременное удаление порошка может стать причиной короткого замыкания электродов через разросшийся катодный осадок.
Циркуляция электролита. В процессе электролиза может произойти частичное расслаивание электролита вследствие различной плотности его составляющих (при электролизе расплавов), обеднение (обогащение) прикатодного (прианодного) пространство катионами (анионами), а также изменение заданной температуры раствора (расплава). Для предотвращения этих нежелательных явлений проводят выравнивание концентрации электролита с помощью системы непрерывной замкнутой циркуляции.
Наличие газообразных и органических примесей. В процессе электролиза в электролите присутствует растворенный кислород, пероксид водорода, а также другие окислители, вызывающие окисление поверхности катода. В результате окисления поверхность катода становится более развитой, что способствует образованию рыхлых осадков. Присутствующие в электролите органические примеси и поверхностно-активные вещества адсорбируются на поверхности растущих граней кристаллов и препятствуют их дальнейшему росту, что также приводит к получению более рыхлых осадков.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Электролиз
Если в раствор или расплав электролита опустить электроды и пропустить постоянный электрический ток, то ионы будут двигаться направленно: катионы к катоду (отрицательно заряженному электроду), анионы к аноду (положительно заряженному электроду).
На катоде катионы принимают электроны и восстанавливаются, на аноде анионы отдают электроны и окисляются. Этот процесс называют электролизом.
Электролиз — это окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита.
Электролиз расплавленных солей
Рассмотрим процесс электролиза расплава хлорида натрия. В расплаве идет процесс термической диссоциации:
Под действием электрического тока катионы $Na^$ движутся к катоду и принимают от него электроны:
Анионы $Cl^$ движутся к аноду и отдают электроны:
Суммарное уравнение процессов:
На катоде образуется металлический натрий, на аноде — газообразный хлор.
Главное, что вы должны помнить: в процессе электролиза за счет электрической энергии осуществляется химическая реакция, которая самопроизвольно идти не может.
Электролиз водных растворов электролитов
Более сложный случай — электролиз растворов электролитов.
В растворе соли, кроме ионов металла и кислотного остатка, присутствуют молекулы воды. Поэтому при рассмотрении процессов на электродах необходимо учитывать их участие в электролизе.
Для определения продуктов электролиза водных растворов электролитов существуют следующие правила:
1. Процесс на катоде зависит не от материала, из которого сделан катод, а от положения металла (катиона электролита) в электрохимическом ряду напряжений, при этом если:
1.1. Катион электролита расположен в ряду напряжений в начале ряда по $Al$ включительно, то на катоде идет процесс восстановления воды (выделяется водород $Н_2↑$). Катионы металла не восстанавливаются, они остаются в растворе.
1.2. Катион электролита находится в ряду напряжений между алюминием и водородом, то на катоде восстанавливаются одновременно и ионы металла, и молекулы воды.
1.3. Катион электролита находится в ряду напряжений после водорода, то на катоде восстанавливаются катионы металла.
1.4. В растворе содержатся катионы разных металлов, то сначала восстанавливается катион металла, стоящий в ряду напряжений правее.
Катодные процессы
| $Li K Ca Na Mg Al$ $Li^ K^ Ca^ Na^ Mg^ Al^$ |
$Mn Zn Fe Ni Sn Pb$ $Mn^ Zn^ Fe^ Ni^ Sn^ Pb^$ |
$H_2$ $2H^$ |
$Cu Hg Ag Pt Au$ $Cu^ Hg_2^ Ag^ Pt^ Au^$ |
| Восстанавливается вода: $2H_2O+2ē=H_2↑+2OH^;$ $M^$ не восстанавливается |
Восстанавливаются катионы металла и вода: $M^+nē=M^0$ $2H_2O+2ē=H_2↑+2OH^$ |
Восстанавливаются катионы металла: $M^+nē=M^0$ | |
| $nē→$ Усиление окислительных свойств катионов (способности принимать электроны) |
|||
2. Процесс на аноде зависит от материала анода и от природы аниона.
Анодные процессы
| Кислотный остаток $Ас^$ | Анод | |
| Растворимый | Нерастворимый | |
| Бескислородный | Окисление металла анода $M^−nē=M^$ анод раствор |
Окисление аниона (кроме $F^$) $Ac^−mē=Ac^0$ |
| Кислородсодержащий | В кислотной и нейтральной средах: $2H_2O−4ē=O_2↑+4H^$ В щелочной среде: $4OH^−4ē=O_2↑+4H^$ |
|
2.1. Если анод растворяется (железо, цинк, медь, серебро и все металлы, которые окисляются в процессе электролиза), то окисляется металл анода, несмотря на природу аниона.
2.2. Если анод не растворяется (его называют инертным — графит, золото, платина), то:
а) при электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идет процесс окисления аниона;
б) при электролизе растворов солей кислородсодержащих кислот и фторидов на аноде идет процесс окисления воды (выделяется $О_2↑$). Анионы не окисляются, они остаются в растворе;
в) анионы по их способности окисляться располагаются в следующем порядке:

Попробуем применить эти правила в конкретных ситуациях.
Рассмотрим электролиз раствора хлорида натрия в случае, если анод нерастворимый и если анод растворимый.
1) Анод нерастворимый (например, графитовый).
В растворе идет процесс электролитической диссоциации:
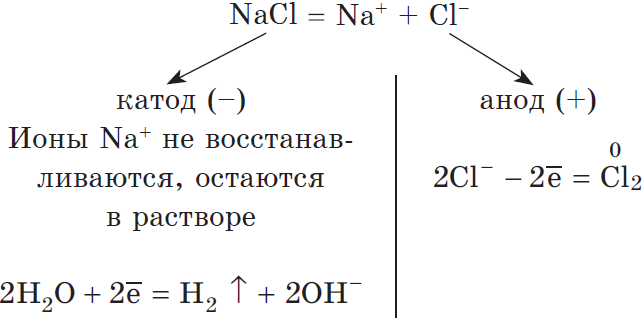
Учитывая присутствие ионов $Na^$ в растворе, составляем молекулярное уравнение:
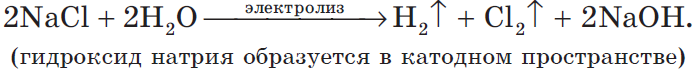
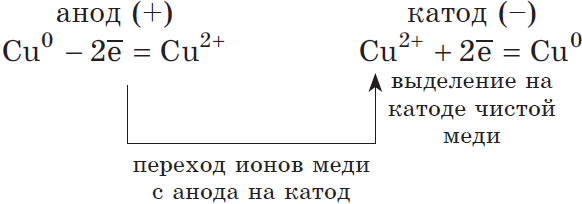
2) Анод растворимый (например, медный):
Если анод растворимый, то металл анода будет окисляться:
Катионы $Cu^$ в ряду напряжений стоят после ($Н^$), по этому они и будут восстанавливаться на катоде.
Концентрация $NaCl$ в растворе не меняется.
Рассмотрим электролиз раствора сульфата меди (II) на нерастворимом аноде:
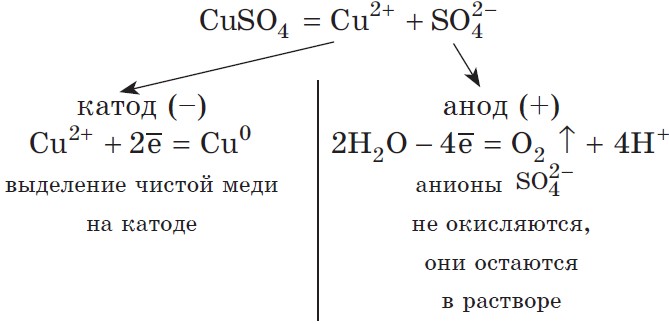
Суммарное ионное уравнение:
Суммарное молекулярное уравнение с учетом присутствия анионов $SO_4^$ в растворе:
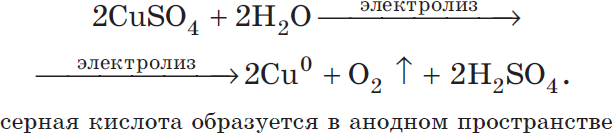
Рассмотрим электролиз раствора гидроксида калия на нерастворимом аноде:
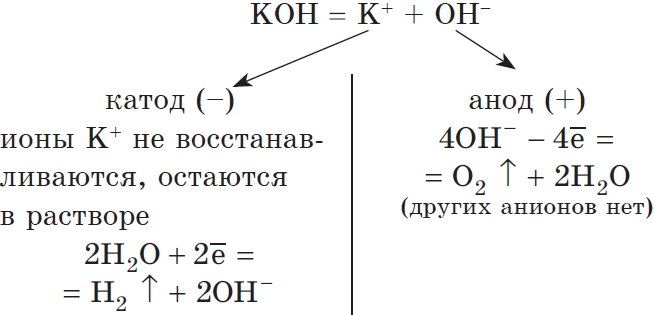
Суммарное ионное уравнение:
Суммарное молекулярное уравнение:
В данном случае, оказывается, идет только электролиз воды. Аналогичный результат получим и в случае электролиза растворов $H_2SO_4, NaNO_3, K_2SO_4$ и др.
Электролиз расплавов и растворов веществ широко используется в промышленности:
- Для получения металлов (алюминий, магний, натрий, кадмий получают только электролизом).
- Для получения водорода, галогенов, щелочей.
- Для очистки металлов — рафинирования (очистку меди, никеля, свинца проводят электрохимическим методом).
- Для защиты металлов от коррозии (хрома, никеля, меди, серебра, золота) — гальваностегия.
- Для получения металлических копий, пластинок — гальванопластика.
Источник: examer.ru
Серебро получают электролизом раствора или расплава
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
ГДЗ Химия 11 класc Габриелян О.С. Остроумов И.Г. Сладков С.А. §15 Электролиз расплавов и растворов. Практическое применение электролиза ОТВЕТЫ
Красным цветом даются ответы , а фиолетовым ― объяснения.
Задание 2
Охарактеризуйте практическое применение электролиза.
Основные направления промышленного применения электролиза:
― получение активных металлов (IА- и IIА-групп, а также алюминия) ;
― получение активных неметаллов (галогенов, водорода, кислорода) ;
― гальванопластика ― получение металлических копии с металлического или неметаллического оригинала;
― гальваностегия ― нанесение металлических или декоративных покрытии на изделия (главным образом металлические) ― золочение, серебрение, никелирование, хромирование и др;
― рафинирование ― очистка от посторонних примесей цветных металлов.
Задание 3
Какие металлы и неметаллы ― простые вещества можно получить только с помощью электролиза? Щелочные металлы, поскольку среди простых веществ они являются самыми сильными восстановителями, и неметал фтор, который является самым электроотрицательным элементом, следовательно, в природе не существует веществ способных окислить фторид-анионы F — .
Задание 4
Почему самый распространённый металл в земной коре ― алюминий ― был получен сравнительно поздно? Почему первоначально алюминий стоил дорого? Как удалось удешевить его производство? Алюминий был получен сравнительно поздно из-за невозможности получить его из растворов соли электролизом, из-за того что алюминий ― активный металл, сразу вступал в реакцию с водой, а также невозможностью получить алюминий из расплавов соли, т. к. многие соли алюминия разлагаются при достижении температуры плавления, в виду этого соль алюминия превращалась в оксид алюминия, который имел очень высокую температуру плавления (2044°C).
Впервые алюминий был получен из хлорида алюминия с помощью калия, который был получен с помощью электролиза расплава гидроксида калия.
Задание 5
Сравните процессы гидролиза и электролиза. Гидролиз ― процесс разложения исходных веществ при взаимодействии с водой с образованием новых соединений, не является ОВР. Электролиз ― окислительно-восстановительный процесс, протекающий на электродах при пропускании постоянного электрического тока через растворы или расплавы электролитов.
Задание 6
Назовите продукты электролиза раствора и расплава хлорида цинка; раствора нитрата цинка.
Продукты электролиза раствора и расплава хлорида цинка: цинк и хлор.
Раствор: CuCl2 эл.т. ⟶ Cu + Cl2
Расплав: CuCl2 эл.т. ⟶ Cu + Cl2
Продукты электролиза раствора нитрата цинка: цинк, азотная кислота, кислород.
Раствор: 2Zn(NO3)2 + 2H2O эл.т. ⟶ 2Zn + 4HNO3 + O2
Задание 10
Какие изделия, используемые в быту, на ваш взгляд, были изготовлены с применением гальванопластики и гальваностегии?
С помощью гальванопластики изготовлены: точные копии небольших скульптур и ювелирных изделий, копии виниловых грампластинок.
С помощью гальваностегии изготовлены хромированные изделия: смесители, решетки автомобильных радиаторов, автомобильные диски, полотенцесушители и др.
- Габриелян и др. Химия 11 класc 2019
- 2021-11-19
Источник: gdz.cool