ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Периодическая система химических элементов
Универсальная таблица растворимости
кислот, солей и оснований в воде
Коллекция таблиц к урокам по химии
Информационные и справочноинструктивные
- Главная

- для Ученика

- ЕГЭ: теория

- Для Ученика

- Теория для подготовки к ЕГЭ
Химические свойства водорода и галогенов
Химические свойства водорода
Атом водорода имеет электронную формулу внешнего (и единственного) электронного уровня 1s 1 . С одной стороны, по наличию одного электрона на внешнем электронном уровне атом водорода похож на атомы щелочных металлов. Однако, ему, так же как и галогенам не хватает до заполнения внешнего электронного уровня всего одного электрона, поскольку на первом электронном уровне может располагаться не более 2-х электронов. Выходит, что водород можно поместить одновременно как в первую, так и в предпоследнюю (седьмую) группу таблицы Менделеева, что иногда и делается в различных вариантах периодической системы:
Эксперимент серебро и перекись водорода (гидроперит)

С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
8. КАКИЕ МЕТАЛЛЫ РЕАГИРУЮТ С ВОДОЙ/ Нужно знать/ ЕГЭ химия 2020
с неметаллами
Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
Химические свойства галогенов
Галогенами называют химические элементы VIIA группы (F, Cl, Br, I, At), а также образуемые ими простые вещества. Здесь и далее по тексту, если не сказано иное, под галогенами будут пониматься именно простые вещества.
Все галогены имеют молекулярное строение, что обусловливает низкие температуры плавления и кипения данных веществ. Молекулы галогенов двухатомны, т.е. их формулу можно записать в общем виде как Hal2.
Галоген
Физические свойства
Следует отметить такое специфическое физическое свойство йода, как его способность к сублимации или, иначе говоря, возгонке. Возгонкой, называют явление, при котором вещество, находящееся в твердом состоянии, при нагревании не плавится, а, минуя жидкую фазу, сразу же переходит в газообразное состояние.
Электронное строение внешнего энергетического уровня атома любого галогена имеет вид ns 2 np 5 , где n – номер периода таблицы Менделеева, в котором расположен галоген. Как можно заметить, до восьмиэлектронной внешней оболочки атомам галогенов не хватает всего одного электрона. Из этого логично предположить преимущественно окисляющие свойства свободных галогенов, что подтверждается и на практике. Как известно, электроотрицательность неметаллов при движении вниз по подгруппе снижается, в связи с чем активность галогенов уменьшается в ряду:
Взаимодействие галогенов с простыми веществами
Все галогены являются высокоактивными веществами и реагируют с большинством простых веществ. Однако, следует отметить, что фтор из-за своей чрезвычайно высокой реакционной способности может реагировать даже с теми простыми веществами, с которыми не могут реагировать остальные галогены. К таким простым веществам относятся кислород, углерод (алмаз), азот, платина, золото и некоторые благородные газы (ксенон и криптон). Т.е. фактически, фтор не реагирует лишь с некоторыми благородными газами.
Остальные галогены, т.е. хлор, бром и йод, также являются активными веществами, однако менее активными, чем фтор. Они реагируют практически со всеми простыми веществами, кроме кислорода, азота, углерода в виде алмаза, платины, золота и благородных газов.
Взаимодействие галогенов с неметаллами
водородом
При взаимодействии всех галогенов с водородом образуются галогеноводороды с общей формулой HHal. При этом, реакция фтора с водородом начинается самопроизвольно даже в темноте и протекает со взрывом в соответствии с уравнением:
Реакция хлора с водородом может быть инициирована интенсивным ультрафиолетовым облучением или нагреванием. Также протекает со взрывом:
Бром и йод реагируют с водородом только при нагревании и при этом, реакция с йодом является обратимой:
фосфором
Взаимодействие фтора с фосфором приводит к окислению фосфора до высшей степени окисления (+5). При этом происходит образование пентафторида фосфора:
При взаимодействии хлора и брома с фосфором возможно получение галогенидов фосфора как в степени окисления + 3, так и в степени окисления +5, что зависит от пропорций реагирующих веществ:
При этом в случае белого фосфора в атмосфере фтора, хлора или жидком броме реакция начинается самопроизвольно.
Взаимодействие же фосфора с йодом может привести к образованию только триодида фосфора из-за существенно меньшей, чем у остальных галогенов окисляющей способности:
серой
Фтор окисляет серу до высшей степени окисления +6, образуя гексафторид серы:
Хлор и бром реагируют с серой, образуя соединения, содержащие серу в крайне не свойственных ей степенях окисления +1 и +2. Данные взаимодействия являются весьма специфичными, и для сдачи ЕГЭ по химии умение записывать уравнения этих взаимодействий не обязательно. Поэтому три нижеследующих уравнения даны скорее для ознакомления:
Взаимодействие галогенов с металлами
Как уже было сказано выше, фтор способен реагировать со всеми металлами, даже такими малоактивными как платина и золото:
Остальные галогены реагируют со всеми металлами кроме платины и золота:
Более активные галогены, т.е. химические элементы которых расположены выше в таблице Менделеева, способны вытеснять менее активные галогены из образуемых ими галогеноводородных кислот и галогенидов металлов:
Аналогичным образом, бром вытесняет серу из растворов сульфидов и сероводорода:
Хлор является более сильным окислителем и окисляет сероводород в его водном растворе не до серы, а до серной кислоты:
Взаимодействие галогенов с водой
Вода горит во фторе синим пламенем в соответствии с уравнением реакции:
Бром и хлор реагируют с водой иначе, чем фтор. Если фтор выступал в роли окислителя, то хлор и бром диспропорционируют в воде, образуя смесь кислот. При этом реакции обратимы:
Взаимодействие йода с водой протекает в настолько ничтожно малой степени, что им можно пренебречь и считать, что реакция не протекает вовсе.
Взаимодействие галогенов с растворами щелочей
Фтор при взаимодействии с водным раствором щелочи опять же выступает в роли окислителя:
Умение записывать данное уравнение не требуется для сдачи ЕГЭ. Достаточно знать факт о возможности такого взаимодействия и окислительной роли фтора в этой реакции.
В отличие от фтора, остальные галогены в растворах щелочей диспропорционируют, то есть одновременно и повышают и понижают свою степень окисления. При этом, в случае хлора и брома в зависимости от температуры возможно протекание по двум разным направлениям. В частности, на холоду реакции протекают следующим образом:
а при нагревании:
Йод реагирует с щелочами исключительно по второму варианту, т.е. с образованием йодата, т.к. гипоиодит не устойчив не только при нагревании, но также при обычной температуре и даже на холоду:
Источник: kardaeva.ru
Водород


0,050 – приблизительный радиус атома водорода, 2,1 – электроотрицательность по шкале Полинга
В некоторых периодических системах можно наблюдать, что водород располагается как в первой, так и в седьмой группе. К первой группе водород относят из-за наличия у него всего одного валентного электрона на внешнем электронном уровне. Это обуславливает существование катионов водорода H + (протонов водорода), которые образуются аналогично катионам металлов IА-группы.
Окисление атома лития и образование катиона лития
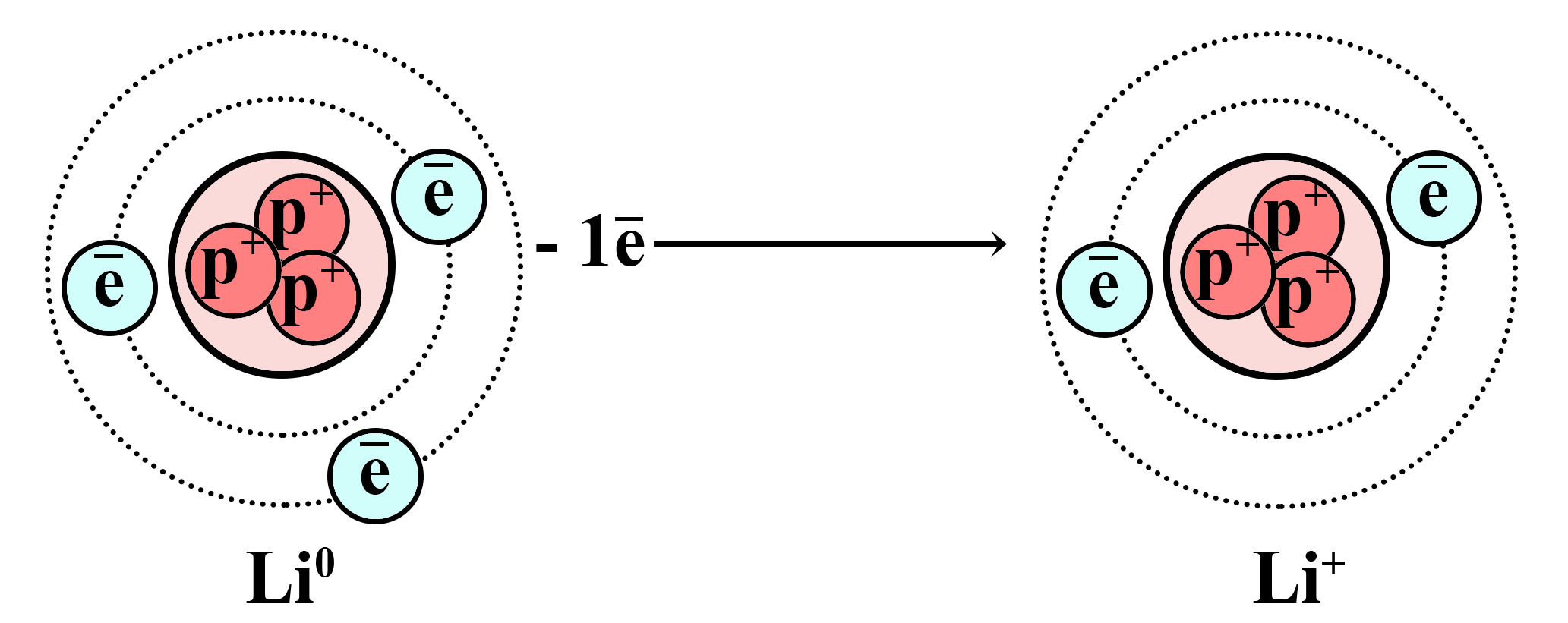
Отдав один электрон внешнего слоя, литий превращается в катион
Окисление атома водорода и образование катиона (протона) водорода
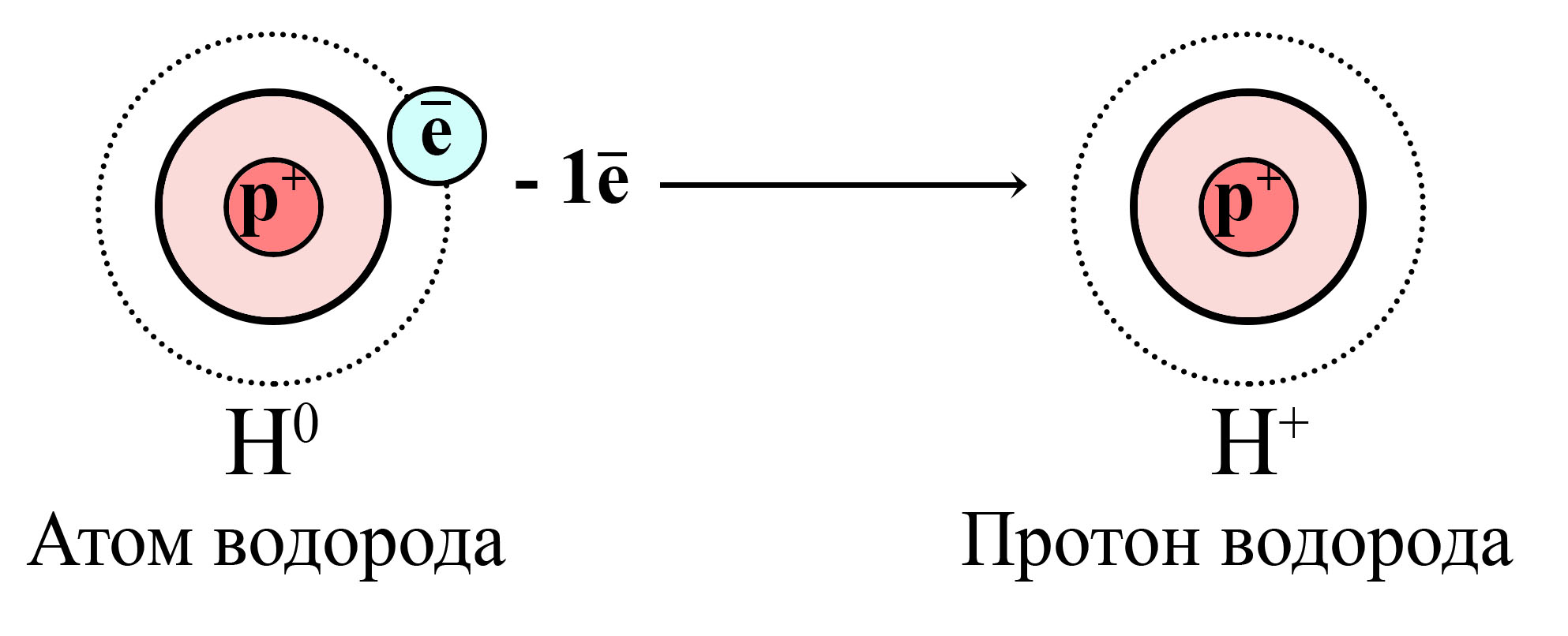
Атом водорода отдает свой единственный электрон, от атома остается только протон
Однако не стоит относить водород к полным аналогам щелочных металлов: в отличие от них, валентный электрон водорода прочнее связан с ядром, так как между ядром и электроном нет других электронных слоёв. Это значит, что есть только силы притяжения положительного ядра к отрицательному валентному электрону, а силы отталкивания между электронами нет. Поэтому положительное ядро водорода может притягивать чужие электроны, а свой единственный электрон не обеспечивает значительной силы отталкивания чужих электронов. Благодаря этому водород может выступать не только в роли восстановителя, отдавая электрон, но и в роли окислителя, образуя гидрид-ион H ‒ (принимая электрон) подобно тому, как это делают элементы VIIА-группы. У галогенов на внешнем электронном слое семь валентных электронов, до «идеала» недостает всего одного, поэтому они хорошие окислители (стремятся притянуть чужие электроны).
Восстановление атома фтора до фторид-иона
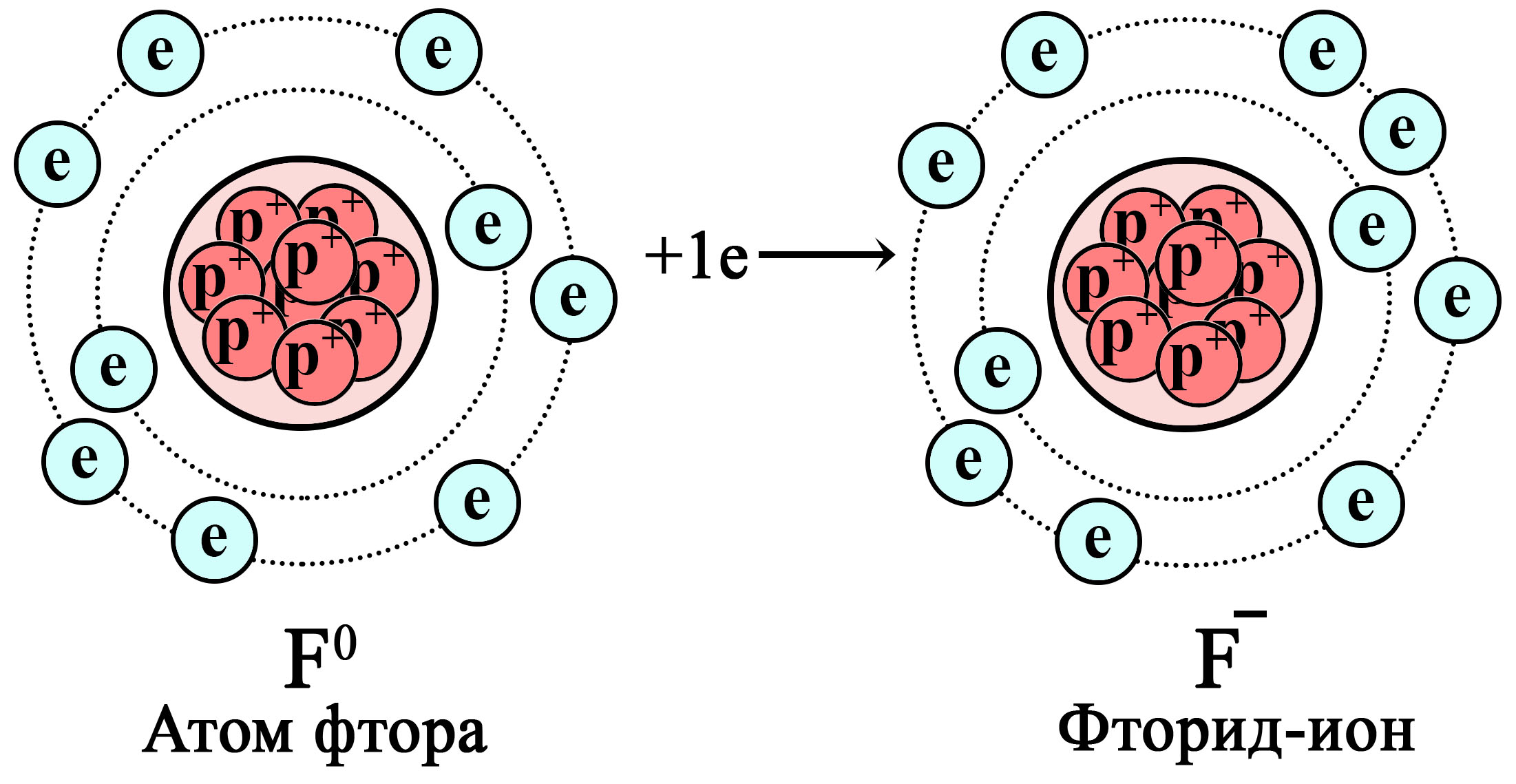
Атом фтора притягивает дополнительный электрон, становясь фторид-ионом
Внешний уровень водорода является еще и первым (ближайшим к ядру), на котором максимально помещается два электрона. До завершения этого уровня атому водорода требуется принять всего один электрон, это роднит его с галогенами. Этим и обосновано расположение водорода в ПС в VIIА-группе. Получая один электрон, водород приобретает конфигурацию благородного газа (гелия).
Водороду не хватает одного электрона до завершенного электронного уровня
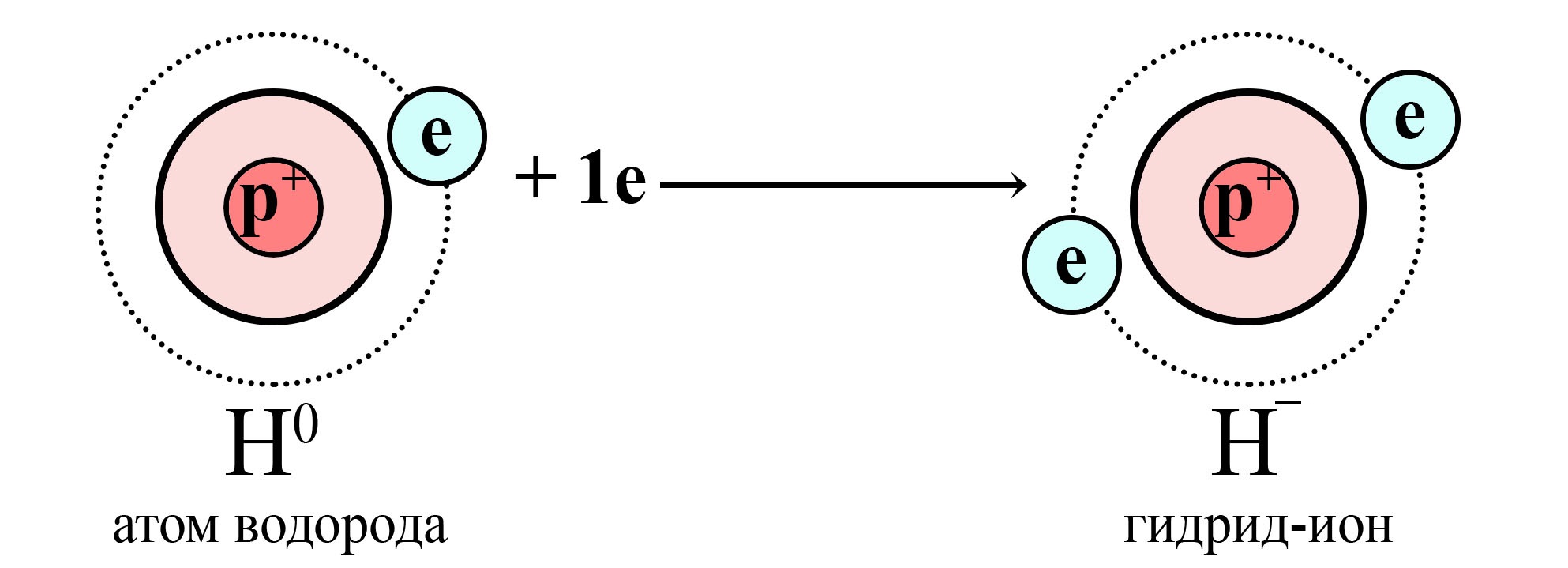
Атом водорода получает электрон от сильного восстановителя и становится гидрид-ионом
Таким образом, водород можно рассматривать как элемент первой группы, так как его электронная конфигурация может быть выражена как ns 1 (это совпадает с электронной конфигурацией внешнего уровня всех щелочных металлов) и как элемент седьмой группы, так как до завершения внешнего электронного уровня не хватает всего одного электрона.
Задание в формате ЕГЭ с ответом:
Водород имеет конфигурацию благородного газа в следующих соединениях:
Пояснение: Водород приобретает конфигурацию благородного газа, превращаясь в гидрид-ион. Гидриды образуются при взаимодействии водорода с активными металлами (металлами IА-группы и кальцием, стронцием, барием).
Химические свойства водорода
Водород проявляет восстановительные свойства при взаимодействии с неметаллами.
Молекулярный водород состоит из двух атомов, между которых образуется одна, но очень прочная σ-связь, что обеспечивает устойчивость молекулы. Поэтому при нормальных условиях водород малоактивен. Но при нагревании, облучении или использовании катализаторов водород реагирует с большинством неметаллов, а также со щелочными и щелочноземельными металлами.
В качестве катализатора используется платина или никель. Водород, растворяясь в этих металлах переходит из молекулярного в более активное атомарное состояние.
Платина используется как катализатор в реакциях гидрирования
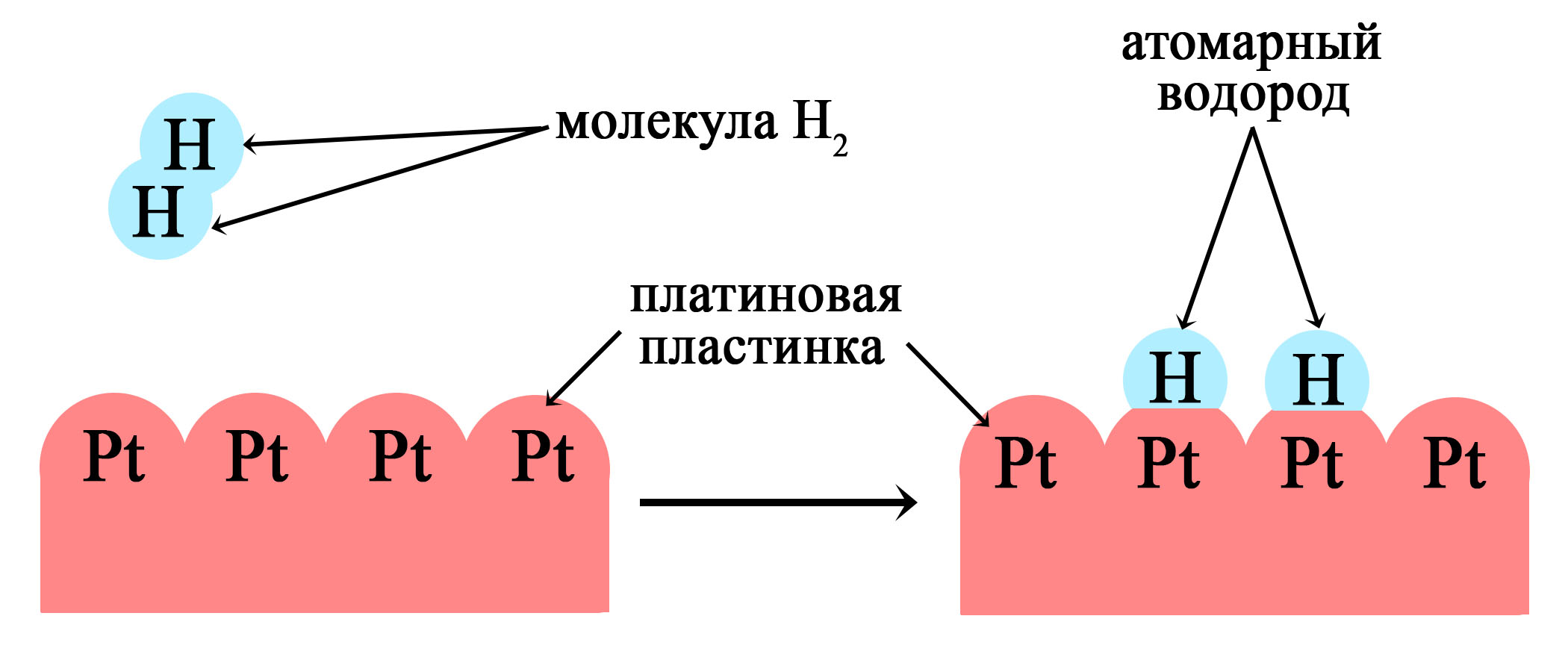
При растворении водорода в металлах он становится атомарным, более химически активным
- Взаимодействие водорода с галогенами (с элементамиVIIА-подгруппы).
При комнатной температуре водород реагирует только со фтором:
Полученный фтороводород – прозрачный газ с резким запахом, при растворении в воде образует слабую плавиковую кислоту.
При облучении реагирует с бромом и хлором:
Образовавшийся бромоводород и хлороводород – газы, образующие при растворении сильные кислоты.
При нагревании водород реагирует с йодом:
Образовавшийся йодоводород – газ, при растворении которого в воде образуется очень сильная кислота.
Кислотные свойства водородных соединений увеличивается в ПС (Периодической системе) слева-направо и сверху-вниз. Поэтому плавиковая кислота слабая, а йодоводородная – сильная.
Пример задания из КИМ ЕГЭ:
Установите последовательность веществ в порядке увеличения кислотности этих соединений:
Реакция с чистым кислородом происходит при 400º, с кислородом на воздухе – при 600º, но если использовать платиновый катализатор, то реакция между водородом и кислородом происходит при комнатной температуре:
Данная реакция сопровождается выделением большого количества теплоты, поэтому может быть использована в целях получения энергии в двигателях.
Смесь двух объёмов водорода и одного объёма кислорода называется гремучим газом, она крайне взрывоопасна.
С бором, кремнием и фосфором водород непосредственно не реагирует.
- Взаимодействие водорода с металлами.
Водород проявляет окислительные свойства в реакция со щелочными и щелочноземельными металлами. Принимает от металла один электрон и превращается в гидрид-ион:
Задание по образцу ФИПИ:
Из предложенного перечня металлов выберите три, с которыми водород может взаимодействовать:
Попробуйте решить задание ЕГЭ:
Из предложенного перечня выберете три вещества, с которыми водород не реагирует.
Запишите в поле ответа номера выбранных веществ.
- Взаимодействие со сложными веществами
Водород используют для восстановления металлов из их оксидов. Таким образом получают средние и малоактивные металлы (в основном металлы побочных подгрупп):
Если металл в оксиде может иметь более низкую промежуточную степень окисления, то восстановление происходит не полностью:
Так как в условиях недостатка водорода восстанавливается не весь оксид железа III, в продукте может образоваться не оксид железа II, а смесь оксида железа II и III (закись-окись железа).
Также неполно восстанавливается и оксид свинца IV.
Для полного восстановления требуется большой избыток водорода.
Железная окалина имеет в своем составе два оксида – FeO и Fe2O3, которые в сумме записывают как Fe3O4 (закись-окись железа). Входящий в состав оксид железа III – более сильный окислитель, за счет него окалина реагирует с водородом.
Закись-окись марганца, входящая в состав минерала гаусманита, является двойным оксидом (MnO·Mn2O3) с общей формулой Mn3O4 восстанавливается аналогично:
Водород не восстанавливает металл из оксида:
Подобным образом восстанавливаются галогениды:
С оксидами и галогенидами активных металлов водород не реагирует.
При 1000ºС водород может восстановить сульфат до сульфида:
Водород восстанавливает не только металлы, но и некоторые неметаллы из их оксидов:
Восстановление также может происходить не полностью:
Физические свойства
Водород является газом без цвета и запаха, не имеет вкуса. Это самый легкий газ, его не может удержать земная атмосфера и свободный водород выходит в космос. В земной атмосфере водород остаётся в связанном виде, то есть в составе более тяжелых молекул.
Водород плохо растворяется в воде и во многих других растворителях, но может медленно диффундировать в металлах.
Получение водорода
Водород получают взаимодействием 20%-ной серной кислоты с цинком в аппарате Киппа:
Из-за использования загрязненного цинка (цинковые руды загрязнены мышьяком и сурьмой), выход продукта уменьшается, вместе с водородом образуются ядовитые AsH3 и SbH3.
Для получения более чистого водорода используют реакции растворения кремния или алюминия в щелочах:
Из предложеных пар веществ выберите три, взаимодействие которых приводит к образованию водорода:
Водород можно получить при реакции железа нагретого до температуры красного каления (900-1000º) с перегретым водяным паром:
Взаимодействием щелочных металлов с водой:
Водород можно получить, растворив в холодной воде металл:
Реакция является экзотермической – происходит с выделением большого количества тепла. Активные металлы горят и даже взрываются при взаимодействии с водой.
Водород получают гидролизом гидридов или взаимодействием гидрида с кислотой:
KH + HOH = KOH + H2↑
KH + HCl = KCl + H2↑
- Промышленные способы получения водорода:
В промышленности используют электролиз воды и растворов солей активных металлов.
Катодный процесс: 2HOH + 2ē → H2 + 2OH ‒
Анодный процесс: 2Cl ‒ ‒ 2ē → Cl2↑
Водород можно получить электролизом:
Водород можно получить при разложении метана при 350ºС на железном или никелевом катализаторе:
Наибольшее количество водорода получают воздействием на антрацит (ископаемый уголь с наибольшей массовой долей углерода) перегретым водяным паром (1000ºC):
Или конверсией метана перегретым водяным паром (1100ºС):
Смесь угарного газа и водорода, получаемая в этих реакциях, называется синтез-газом. Он используется в органическом синтезе, главным образом для получения метанола и в синтезе Фишера-Тропша для получения алканов:
Также водород получают глубоким охлаждением коксового газа до ‒196ºС, при такой температуре только водород остаётся газообразным.
Многие описанные методы приводят к получению не чистого водорода, а его смеси с другими газами. Одним из методов отделения водорода от примесей является пропускание газовой смеси через прибор, содержащий трубку из сплава палладия и серебра. Смесь пропускают через прибор под большим давлением. Из-за давления и способности водорода диффундировать в металлах, он попадает в трубку из сплава Pd/Ag, другие газы в эту трубку попасть не могут.
Очистка водорода от примесей
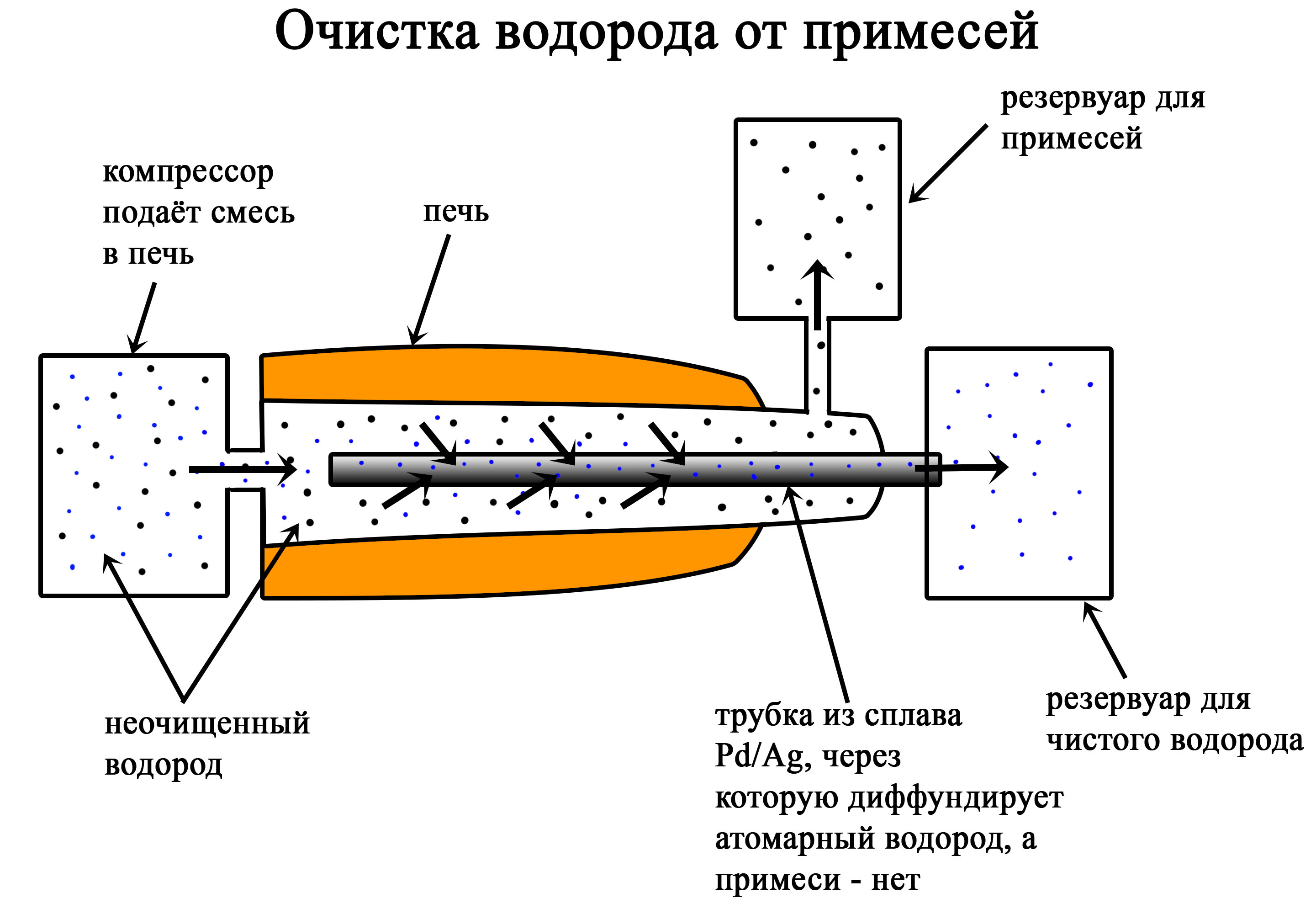
Водород под давлением диффундирует через металлическую трубку
Применение водорода
Наибольшее количество водорода используется в производстве аммиака, хлороводорода и соляной кислоты, восстановление металлов, гидрирование органических соединений, получении метанола.
Жидкий водород используется в качестве ракетного топлива.
Водород используется для очистки нефти от серы.
Использованная литература:
Репетитор по химии / под ред. А. С. Егорова. – Изд. 29-е. – Ростов н/Д : Феникс, 2010. – 762.
Хомченко Г. П. Пособие по химии для поступающих в вузы. – 4-е изд., испр. и доп. – М.: ООО «Издательство Новая Волна»: Издатель Умеренков, 2002.
Шрайвер Д., Эткинс П. Неорганическая химия. В 2-х т. Т.1/Пер. с англ. М. Г. Розовой, С. Я. Истомина, М. Е. Тамм. – М.: Мир, 2004.
Источник: onlineclass.space