Химия – это сложная наука, и мало можно, найти сегодня ее истинных поклонников, поскольку разобраться и запомнить все химические элементы Менделеева удается лишь избранным, настоящим фанатикам химии.
Однако даже сильная нелюбовь и неприязнь к этой науке не освобождает от решения задач, от изучения химических соединений и электронного строения атома.
Именно поэтому наш онлайн калькулятор может стать для вас хорошим помощником. Данная страница посвящена электронному строению атомов, и все что от вас требуется это ввести несколько химических элементов или же цепочку химических соединений и за считанные секунды вы получите всю схему строения.
Пожалуйста напишите с чем связна такая низкая оценка:
Для установки калькулятора на iPhone — просто добавьте страницу
«На главный экран»
Для установки калькулятора на Android — просто добавьте страницу
«На главный экран»
Источник: allcalc.ru
Электронные формулы атомов (практика). Учимся составлять электронные формулы атомов.
Электронные формулы атома : Фтор, Неон, Натрий, Магний, Алюминий,Кремний.
1) F — 2 период, VII группа, заряд ядра +9
1s^2 2s^2 2p^5
2) Ne — 2 период, VIII группа, заряд ядра +10
1s^2 2s^2 2p^6
3) Na — 3 период, I группа, заряд ядра +11
1s^2 2s^2 2p^6 3s^1
4) Mg — 3 период, II группа, заряд ядра +12
1s^2 2s^2 2p^6 3s^2
5) Al — 3 период, III группа,заряд ядра +13
1s^2 2s^2 2p^6 3s^2 3p^1
6) Si — 3 период, IV группа, заряд ядра +14
1s^2 2s^2 2p^6 3s^2 3p^2
Как добавить хороший ответ?
Что необходимо делать:
- Написать правильный и достоверный ответ;
- Отвечать подробно и ясно, чтобы ответ принес наибольшую пользу;
- Писать грамотно, поскольку ответы без грамматических, орфографических и пунктуационных ошибок лучше воспринимаются.
Что делать не стоит:
- Списывать или копировать что-либо. Высоко ценятся ваши личные, уникальные ответы;
- Писать не по сути. «Я не знаю». «Думай сам». «Это же так просто» — подобные выражения не приносят пользы;
- Писать ответ ПРОПИСНЫМИ БУКВАМИ;
- Материться. Это невежливо и неэтично по отношению к другим пользователям.
Пример вопроса
Русский язык
7 минут назад
Какой синоним к слову «Мореплаватель»?
Пожаловаться
Хороший ответ
Вася Иванов
Мореплаватель — имя существительное, употребляется в мужском роде. К нему может быть несколько синонимов.
1. Моряк. Старый моряк смотрел вдаль, думая о предстоящем опасном путешествии;
2. Аргонавт. На аргонавте были старые потертые штаны, а его рубашка пропиталась запахом моря и соли;
3. Мореход. Опытный мореход знал, что на этом месте погибло уже много кораблей, ведь под водой скрывались острые скалы;
4. Морской волк. Старый морской волк был рад, ведь ему предстояло отчалить в долгое плавание.
Источник: uchi.ru
Движение электронов в атоме. 1 часть. 8 класс.
s-элементы
Чтобы рассмотреть строение электронных оболочек атомов элементов, нам надо понимать строение атома и периодическую систему.
Допустим, что с этим мы разобрались.
Теперь подробно рассмотрим строение электронных оболочек атомов
S-элементов
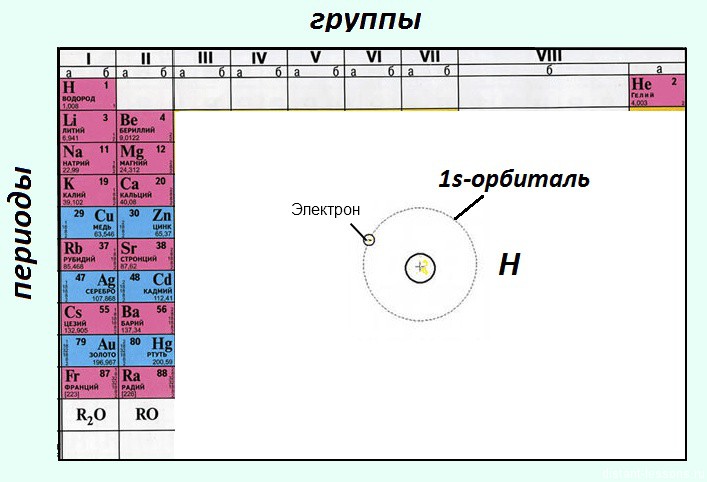
В школьной периодической системе элементов они обозначены красным цветом — « красненькие «.
Помимо этого, это элементы главных подгрупп, т.е. электроны s-орбитали у них валентные
А что следует из того, что у элемента электроны располагаются на S-орбитали?
- Каждый энергетический уровень атома начинается с этой орбитали. Это значит, что если у атома появится возможность отдать электроны с этого уровня, он приблизится к стабильному состоянию — достижению 8-ми электронной оболочки, как у благородных газов!
(у гелия, например, s-обиталь полностью заполнена электронами (2 электрона), он химически инертен) - Значит, в основном, S-элементы проявляют металлические свойства — восстановительные
- На нем могут располагаться максимум 2 электрона! Т.е. их валентность равна 1 или 2
s- элементы
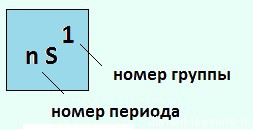
Как видно из рисунка, элементы 1-й группы периодической системы имеют на внешнем энергетическом уровне только 1 электрон, поэтому их валентность =1 , степень окисления — +1.
Внизу таблички есть подсказка: формула высшего оксида:
Т.е. из правил составления химических формул можно легко определить валентность R
Общая электронная конфигурация этих элементов будет выглядеть так:
Если расписать строение подробно, например, для K, то вот «полный отчет»:

s- элементы
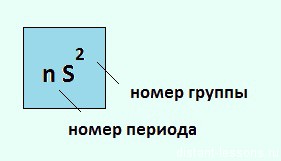
Элементы 2-й группы периодической системы имеют на внешнем энергетическом уровне 2 электрона, поэтому их валентность=2 , степень окисления — +2.
Внизу таблички есть подсказка: формула высшего оксида:
RO
Т.е. из правил составления химических формул можно легко определить валентность R
Общая электронная конфигурация этих элементов будет выглядеть так:
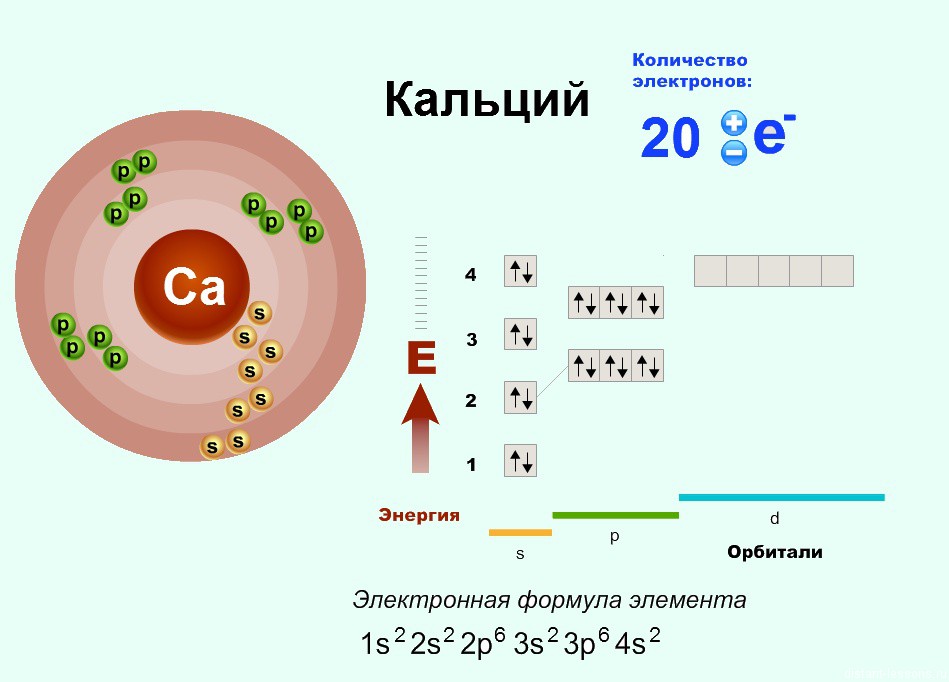
Ну и если расписать строение подробно, например, для Ca, то вот «полный отчет»:
- примеры вопросов ЕГЭ по этой теме
- примеры вопросов ГИА (ОГЭ) по этой теме
Источник: distant-lessons.ru