1. Квантовые числа (главное, побочное, магнитное, спиновое).
2. Закономерности заполнения электронной оболочки атома:
— принцип наименьшей энергии;
3. Определения понятий: электронная оболочка, электронное облако, энергетический уровень, энергетический подуровень, электронный слой.
Атом состоит из ядра и электронной оболочки. Электронная оболочка атома – это совокупность всех электронов в данном атоме. От строения электронной оболочки атома напрямую зависят химические свойства данного хим. элемента. Согласно квантовой теории, каждый электрон в атоме занимает определенную орбиталь и образует электронное облако, которое является совокупностью различных положений быстро движущегося электрона.
Для характеристики орбиталей и электронов используют квантовые числа.
Главное квантовое число – n. Характеризует энергию и размер орбитали и электронного облака; принимает значения целых чисел от 1 до бесконечности (n = 1,2,3,4,5,6…). Орбитали, имеющие одинаковое значение n, близки между собой по энергии и по размеру и образуют один энергетический уровень.
№2 Строение атома. Строение электронных оболочек атомов.
Энергетический уровень – это совокупность орбиталей, имеющих одинаковое значение главного квантового числа. Энергетические уровни обозначают либо цифрами, либо большими буквами латинского алфавита (1-K, 2-L, 3-M, 4-N, 5-O, 6-P, 7-Q). С увеличением порядкового номера энергия и размер орбиталей увеличиваются.
Электронный слой – это совокупность электронов, находящихся на одном энергетическом уровне.
На одном энергетическом уровне могут находиться электронные облака, имеющие различные геометрические формы.
Побочное (орбитальное) квантовое число – l. Характеризует форму орбиталей и облаков; принимает значения целых чисел от 0 до n-l.
| УРОВЕНЬ | ГЛАВНОЕ КВАНТОВОЕ ЧИСЛО — n | ЗНАЧЕНИЕ ПОБОЧНОГО КВАНТОВОГО ЧИСЛА – l |
| K | 0 (s) | |
| L | 0,1 (s,p) | |
| M | 0,1,2 (s,p,d) | |
| N | 0,1,2,3 (s,p,d,f) |
Орбитали, для которых l=0, имеют форму шара (сферы) и называются s-орбиталями. Они имеются на всех энергетических уровнях, причем на К-уровне имеется только s-орбиталь. Схематично изобразите форму s-орбитали:
Орбитали, для которых l=1, имеют форму вытянутой восьмерки и называются р — орбиталями. Они имеются на всех энергетических уровнях, кроме первого (К). Схематично изобразите форму l -орбитали:
Орбитали, для которых l=2, называются d-орбиталями. Их заполнение электронами начинается с третьего энергетического уровня.
Заполнение f-орбиталей, для которых l=3, начинается с четвертого энергетического уровня.
Энергия орбиталей, находящихся на одном энергетическом уровне, но имеющих разную форму, неодинакова: Espdf, поэтому на одном уровне выделяют разные энергетические подуровни.
Энергетический подуровень – это совокупность орбиталей, которые находятся на одном энергетическом уровне и имеют одинаковую форму. Орбитали одного подуровня имеют одинаковые значения главного и побочного квантового числа, но отличаются направлением (ориентацией) в пространстве.
8 класс — Химия — Строение электронных оболочек атома
Магнитное квантовое число – ml. Характеризует ориентацию орбиталей (электронных облаков) в пространстве и принимает значения целых чисел от –l через 0 до +l. Число значений ml определяет число орбиталей на подуровне, например:
s-подуровень: l=0, ml=0, — 1 орбиталь.
p-подуровень: l=1, ml=-1, 0, +1, -3 орбитали
d-подуровень: l=2, ml=-2, -1, 0, +1, +2, — 5 орбиталей.
Таким образом, число орбиталей на подуровне можно вычислить как 2l+1. Общее число орбиталей на одном энергетическом уровне = n 2 . Общее число электронов на одном энергетическом уровне = 2n 2 . Графически любая орбиталь изображается в виде клетки (квантовой ячейки).
Схематично изобразите квантовые ячейки для разных подуровней и подпишите для каждой из них значение магнитного квантового числа:
Итак, каждая орбиталь и электрон, находящийся на этой орбитали, характеризуется тремя квантовыми числами: главным, побочным и магнитным. Электрон характеризуется еще одним квантовым числом – спином.
Спиновое квантовое число, спин (от англ. to spin – кружить, вращать) – ms. Характеризует вращение электрона вокруг своей оси и принимает только два значения: +1/2 и –1/2. Электрон со спином +1/2 условно изображают так: ; со спином –1/2: ¯.
Заполнение электронной оболочки атома подчиняется следующим законам:
Принцип Паули: в атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел. Составьте наборы квантовых чисел для всех электронов атома кислорода и убедитесь в справедливости принципа Паули:
Принцип наименьшей энергии: Основное (устойчивое) состояние атома – это такое состояние, которое характеризуется минимальной энергией. Поэтому электроны заполняют орбитали в порядке увеличения их энергии.
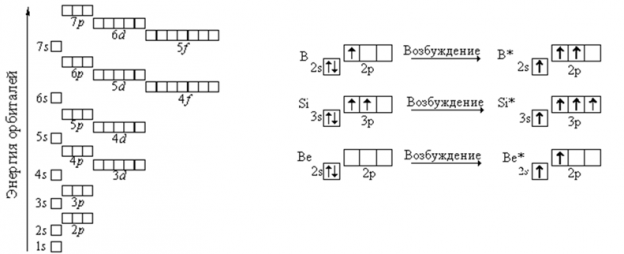
Правило Клечковского: Электроны заполняют энергетические подуровни в порядке увеличения их энергии, который определяется значением суммы главного и побочного квантовых чисел (n + l): 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d.
Правила Гунда: На одном подуровне электроны располагаются так, чтобы абсолютное значение суммы спиновых квантовых чисел (суммарного спина) было максимальным. Это соответствует устойчивому состоянию атома.
Составьте электронно-графические формулы магния, железа и теллура:
Исключения составляют атомы хрома и меди, в которых происходит проскок (переход) одного электрона с 4s-подуровня на 3d-подуровень, что объясняется большой устойчивостью образующихся при этом электронных конфигураций 3d 5 и 3d 10 . Составьте электронно-графические формулы атомов хрома и меди:
Для характеристики электронного строения атома можно использовать схемы электронного строения, электронные и электронно-графические формулы.
Используя вышеперечисленные схемы и формулы, покажите строение атома серы:
ТЕСТ НА ТЕМУ «СТРОЕНИЕ ЭЛЕКТРОННОЙ ОБОЛОЧКИ АТОМА»
1. Элемент, невозбужденный атом которого не содержит неспаренных электронов, — это
| А) магний | Б) углерод | В) сера | Г) цинк |
2. Электронная конфигурация иона Cl + в основном электронном состоянии (этот ион образуется при действии ультрафиолетового излучения на сильно нагретый хлор) имеет вид:
| А) [Ne] 3s 2 3p 5 | Б) [Ne] 3s 1 3p 6 | В) [Ne] 3s 2 3p 4 | Г) [Ne] 3s 2 3p 6 |
3. Элементу второго периода для завершения внешнего уровня не хватает трех электронов. Этот элемент
| А) бор | Б) углерод | В) азот | Г) фосфор |
4. Формула высшего оксида некоторого элемента – ЭО3. Какую конфигурацию валентных электронов может иметь этот элемент в основном состоянии?
5. Чему равно орбитальное квантовое число 3р электрона?
| А) 1 | Б) 3 | В) 0 | Г) +1/2 |
6. Число неспаренных электронов в атоме хрома в невозбужденном состоянии равно:
| А) 1 | Б) 4 | В) 5 | Г) 6 |
7. Электронную конфигурацию внешнего электронного слоя 3s 2 3p 6 имеют соответственно атом и ионы:
| А) Ar, Cl — , S -2 | Б) Kr, K + , Ca +2 | В) Ne, Cl — , Ca +2 | Г) Ar, Cl — , Ca +2 |
8. Число d-электронов у атома серы в максимально возбужденном состоянии равно:
| А) 1 | Б) 2 | В) 4 | Г) 6 |
9. Распределение электронов в нормальном состоянии в атоме хрома по энергетическим уровням соответствует ряду цифр:
| А) 2,8,12,2 | Б) 2,8,8,6 | В) 2,8,13,1 | Г) 2,8,14,0 |
10. Ионы О -2 и К + имеют соответственно следующие электронные формулы:
| А) 1s 2 2s 2 2p 4 | Б) 1s 2 2s 2 2p 6 | В)1s 2 2s 2 2p 6 3s 2 3p 6 4s 0 | Г)1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 |
| А,Г | В | В | В | А | Г | А,Г | Б | В | Б,В |
ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ ФОРМУЛЫ ВЕЩЕСТВА ПО ПРОДУКТАМ СГОРАНИЯ
1. При полном сгорании 0,88 г вещества образовалось 0,51 г углекислого газа и 1,49 г сернистого газа. Определить простейшую формулу вещества. (CS2)
2. Установить истинную формулу органического вещества, если известно, что при сжигании 4,6 г его было получено 8,8 г углекислого газа и 5,4 г воды. Плотность паров этого вещества по водороду равна 23. (С2Н6О)
3. При полном сгорании 12,3 г органического вещества образовалось 26,4 г углекислого газа, 4,5 г воды и выделилось 1,4 г азота. Определить молекулярную формулу вещества, если его молярная масса в 3,844 раза больше молярной массы кислорода. (C6H5NO2)
4. При сгорании 20 мл горючего газа расходуется 50 мл кислорода, а получается 40 мл углекислого газа и 20 мл водяных паров. Определить формулу газа. (C2H2)
5. При сжигании 5,4 г неизвестного вещества в кислороде образовалось 2,8 г азота, 8,8 г углекислого газа и 1,8 г воды. Установите формулу вещества, если известно, что оно легче воздуха. (HCN)
6. При сжигании 3,4 г неизвестного вещества в кислороде образовалось 2,8 г азота и 5,4 г воды. Установить формулу вещества, если известно, что оно легче воздуха. (NH3)
7. При сжигании 1,7 г неизвестного вещества в кислороде образовалось 3,2 г сернистого газа и 0,9 г воды. Установить формулу вещества, если известно, что оно легче аргона. (H2S)
8. Образец вещества массой 2,96 г в реакции с избытком бария при комнатной температуре дает 489 мл водорода (Т=298°К, давление нормальное). При сожжении 55,5 мг того же вещества получили 99 мг углекислого газа и 40,5 мг воды. При полном испарении образца этого вещества массой 1,85 г его пары занимают объем 0,97 л при 473°К и 101,3 кПа. Определить вещество, привести структурные формулы двух его изомеров, отвечающих условиям задачи. (С3Н6О2)
9. При сгорании 2,3 г вещества образовалось 4,4 г углекислого газа и 2,7 г воды. Плотность паров этого вещества по воздуху равна 1,59. Определить молекулярную формулу вещества. (С2Н6О)
10. Определить молекулярную формулу вещества, если известно, что 1,3 г его при сгорании образует 2,24 л углекислого газа и 0,9 г паров воды. Масса 1 мл этого вещества при н.у. равна 0,00116 г. (C2H2)
11. При сжигании одного моля простого вещества образовалось 1,344 м 3 (н.у.) газа, который в 11 раз тяжелее гелия. Установить формулу сжигаемого вещества. (С60)
12. При сжигании 112 мл газа было получено 448 мл углекислого газа (н.у.) и 0,45 г воды. Плотность газа по водороду составляет 29. Найти молекулярную формулу газа. (С4Н10)
13. При полном сгорании 3,1 г органического вещества образовалось 8,8 г углекислого газа, 2,1 г воды и 0,47 г азота. Найти молекулярную формулу вещества, если масса 1 л паров его при н.у. составляет 4,15 г. (C6H7N)
14. При сгорании 1,44 г органического вещества образовалось 1,792 л углекислого газа и 1,44 г воды. Установите формулу вещества, если его относительная плотность по воздуху составляет 2,483. (С4Н8О)
15. При полном окислении 1,51 г гуанина образуется 1,12 л углекислого газа, 0,45 г воды и 0,56 л азота. Вывести молекулярную формулу гуанина. (C5H5N5O)
16. При полном окислении органического вещества массой 0,81 г образуется 0,336 л углекислого газа, 0,53 г карбоната натрия и 0,18 г воды. Установить молекулярную формулу вещества. (C4H4O4Na2)
17. При полном окислении 2,8 г органического вещества образовалось 4,48 л углекислого газа и 3,6 г воды. Относительная плотность вещества по воздуху 1,931. Установить молекулярную формулу данного вещества. Какой объем 20% раствора гидроксида натрия (плотность 1,219 г/мл) необходим для поглощения выделившегося при сгорании углекислого газа? Какова массовая доля карбоната натрия в полученном растворе? (С4Н8; 65,6 мл; 23,9%)
18. При полном окислении 2,24 г органического вещества образуется 1,792 л углекислого газа, 0,72 г воды и 0,448 л азота. Вывести молекулярную формулу вещества. (C4H4N2O2)
19. При полном окислении органического вещества массой 2,48 г образуется 2,016 л углекислого газа, 1,06 г карбоната натрия и 1,62 г воды. Установить молекулярную формулу вещества. (C5H9O2Na)
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Найдите 2 минуты и прочитайте про:
Объемно-планировочные решения зданий и сооружений 1. Требования, предъявляемые к зданиям. 2. Объемно-планировочные параметры зданий. 3. Отдельные элементы зданий. 4. Вертикальные и.
ВИДЫ ОРУЖИЯ МАССОВОГО ПОРАЖЕНИЯ И ПОСЛЕДСТВИЯ ЕГО ПРИМЕНЕНИЯ Оружие массового поражения (ОМП) – оружие большой поражающей способности.
Экспериментальные и контрольные группы и их назначение в экспериментальном психолого-педагогическом исследовании Экспериментальная группа – это группа, непосредственно подвергающаяся экспериментальному воздействию в процессе исследования.
Конфликт. Понятие, определение, виды Курсовая работа По теме: « конфликт и его роль в менеджменте» Подготовил студент 3 курса группы 306 ОРГ Гетта.
Тест по конфликтологии, 80 вопросов с ответами 1. Конфликтология как самостоятельное направление в социологии выделилась.
Источник: studopedia.ru
Строение электронных оболочек
Химия
Автор Марина Андреева На чтение 2 мин Просмотров 3.2к. Опубликовано 23 мая, 2018
Строение электронных оболочек
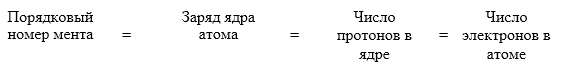
Каждый протон имеет заряд +1, поэтому заряд ядра равен числу протонов. Атом является электронейтральной частицей, поэтому число протонов равно число электронов: Массовое число равно сумме числа протонов и нейтронов в ядре.
Атомы одного элемента, которые имеют разные массовые числа, называются изотопами. (Изотопы содержат одинаковое число протонов, но разное число нейтронов)
Электронная оболочка — это совокупность всех электронов в данном атоме.
Орбиталь — часть атомного пространства, в которой вероятность нахождения электрона наибольшая.
Энергетический уровень — совокупность орбиталей, которые имеют одинаковое значение главного квантового числа.
Для примера, рассмотрим строение электронной оболочки элемента бора:

Как выглядит электронная оболочка в пространстве:
- атом состоит из ядра и электронной оболочки;
- ядра атомов заряжены положительно, они состоят из протонов p+ и нейтронов no (вместе носят название нуклоны);
- при образовании положительно заряженного иона количество электронов уменьшается (на величину заряда данного иона), а при образовании отрицательно заряженного иона количество электронов увеличивается (на величину заряда данного иона).
Орбитали различаются по форме и энергии. Каждая орбиталь обозначается цифрой и лат.буквой. Цифра указывает энергию (энергетический уровень, т. е на сколько далеко орбиталь находится от ядра), а буква ― форму орбитали.
d и f ― более сложной формы.
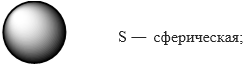
![]()
Одинаковые по форме и энергии орбитали объединяются в подуровни. s подуровень состоит из одной s орбитали, p подуровень — из трех р орбиталей, d подуровень из 5 d орбиталей.
На каждой орбитали может находится не более двух электронов. Поэтому максимальное число электронов на s-подуровне ―2. на р ― 6, на d ― 10.
Макс. количество электронов
Источник: novstudent.ru
Строение атома. Электронные оболочки атома

1. Строение атома. Электронные оболочки атома.
Ачкасова Юлия Максимовна
Учитель-консультант школы
Н.И. Лобачевского
2. Атом
— наименьшая электронейтральная частица
химического элемента, являющаяся
носителем его свойств.
3. Атом
ЯДРО
ЭЛЕКТРОННАЯ
ОБОЛОЧКА
нуклоны
нейтроны
Не заряжены
протоны
Положительно заряжены
электроны
Отрицательно заряжены
4. Атом
Число p+ = числу e- =порядковому номеру
элемента (Z)
5. Изотопы
6. Электронная оболочка
— cовокупность всех электронов в
атоме,
окружающих ядро.
7. Электронные уровни
Орбиталь– это область наиболее вероятного
местонахождения электрона в пространстве.
Номер периода = числу эл. Уровней
Состояние электрона в атоме описывается 4
квантовыми числами:
1. Главное квантовое число n;
2. Побочное (орбитальное) квантовое число l;
3. Магнитное квантовое число ml;
4. Спиновое квантовое число ms.
8. Главное квантовое число
определяет энергетический
уровень электрона (равно номеру
периода). Принимает любые
целочисленные значения,
начиная с n=1 (n=1,2,3,…) и
соответствует номеру периода.
9. Орбитальное квантовое число
Определяет геометрическую форму атомной орбитали.
Принимает любые целочисленные значения с l = 0 (l = n -1)
10. Магнитное квантовое число
11. Спиновое квантовое число
Определяет
направление
вращения электрона
12. Основные квантово-механические законы
• Принцип Паули.
• Принцип наименьшей энергии.
• Правило Гунда (Хунда).
13. Принцип Паули
Хотя бы одно из квантовых чисел n, l, ml и
ms, должно обязательно различаться
проекцией спина.
14. Принцип наименьшей энергии
Электроны в основном состоянии заполняют
орбитали в порядке повышения уровня их
энергии. Первыми заполняются орбитали с
минимальными уровнями
энергии- сначала заполняются
те подуровни, для которых
сумма значений квантовых
чисел m и l является наименьшей.
15. Правило Хунда
В данном подуровне электроны стремятся
занять энергетические состояния таким
образом, чтобы их суммарный спин был
максимальным, суммарный спин
спаренных электронов равен нулю.
16. Электронная оболочка
Уровень- > подуровень -> орбиталь
1
s
2
s
p
3
s
p d
4
s
p d f
17. Электронная оболочка
1s2
2s2 2p6
3s2 3p6 3d10
4s2 4p6 4d10 4f14
число электронов
1 уровень = max. 2 элекрона
2 уровень = max. 8 электронов
3 уровень = max. 18 электронов
4 уровень = max. 32 электрона
18. Электронные орбитали
f
d
p
s
Электроны сначала
заполняют свободные
орбитали, затем пара!
Спины на орбитали
направлены
противоположно!
19. Электронная формула
1. Число e- = числу p+ =порядковому номеру
2. Число электронов на внешнем уровне =
номеру группы
3. Число эл. уровней = номер периода
20. Составляем формулу
3 период = 3 уровня
Na
+11
281
1s2 2s2 2p6 3s1
1 уровень
2 у-нь
3 у-нь
Номер группы = число e- на последнем
уровне
Суммарное число e- в
атоме = порядковому
номеру элемента
1 уровень = max. 2 элекрона
2 уровень = max. 8 электронов
3 уровень = max. 18 электронов
4 уровень = max. 32 электрона
21. Составляем формулу
S
+ 16
286
1s2 2s22p6 2s23p4
1 уровень = max. 2 элекрона
2 уровень = max. 8 электронов
3 уровень = max. 18 электронов
4 уровень = max. 32 электрона
22. Составляем формулу
Сa
+ 20
4s
2882
3p
3s
1s2 2s22p6 3s23p6 4s2
2s
1s
2p
23. Возбужденное состояние атома
24. Электронные формулы ионов
25. Решите:
Электронную конфигурацию 1s22s22p6
имеют частицы:
1. Na 1s22s22p63s1
2. O 1s22s22p4
22s22p6
–
1s
3. F
4. Na+ 1s22s22p6
5. S2- 1s22s22p63s23p6
26. Решите:
Хлорид-ион имеет такую же электронную
конфигурацию, как и: Сl- 1s22s22p63s23p6
1. катион кальция Ca2+ 1s2 2s2 2p6 3s2 3p6.
2. гидрид-анион H- 1s2
3. атом брома Br 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
4. атом натрия Na 1s2 2s2 2p6 3s1
5. сульфид-анион S2- 1s2 2s2 2p6 3s2 3p6
27. Решите:
Восьмиэлектронную внешнюю оболочку в
основном состоянии имеют частицы:
1. Al3+ 13-3 = 10 1s22s22p6
2. C2+ 6-2 = 4 1s22s2
3. S2- 16+2 = 18 1s22s22p63s23p6
22s22p5
9:
1s
4. F
22s22p63s2
5+
17-5
=
12
1s
5. Cl
28. Решите:
Один неспаренный электрон на внешнем
уровне в основном состоянии имеют
атомы:
1. Al 1s22s22p63s23p1
2. C 1s22s22p2
3. O 1s22s22p4
4. F 1s22s22p5
5. Fe 1s22s22p63s23p63d64s2
Источник: ppt-online.org