Обычно в начале статьи пишут краткий план того, о чем пойдет речь в статье. Еще добавляют зачем и почему на нее нужно тратить время. Но здесь такого не будет, потому что я не уверен — нужна ли она вообще.
Но я расскажу историю. Вообще статья должна была быть про белок, как формируется первичная, вторичная структура, ну и так далее. И вот идет подготовка материала, а там довольно большую роль играет электроотрицательность. На самом деле не очень и большую, но все-таки роль у нее есть. И вот мне стало интересно, а как она формируется?
Ты конечно знаешь, что она растет в периодической таблице слева направо и зависит от радиуса атома. Но почему? В общем-то эти вопросы привели меня к строению атома и закону Кулона. Поэтому сейчас мы устроим маленькое путешествие в химию и физику. Начнем со строения атома.
А уже в следующей статье будем разбираться с электроотрицательностью.
Планетарная модель строения атома от Резерфорда
Это модель ключевая, потому что на ее основе строились все остальные. Вообще Резерфорд крутой мужик, который очень любил всякие опыты. Вот один из них:
Строение электронных оболочек атома. Урок 18. Химия 8 класс
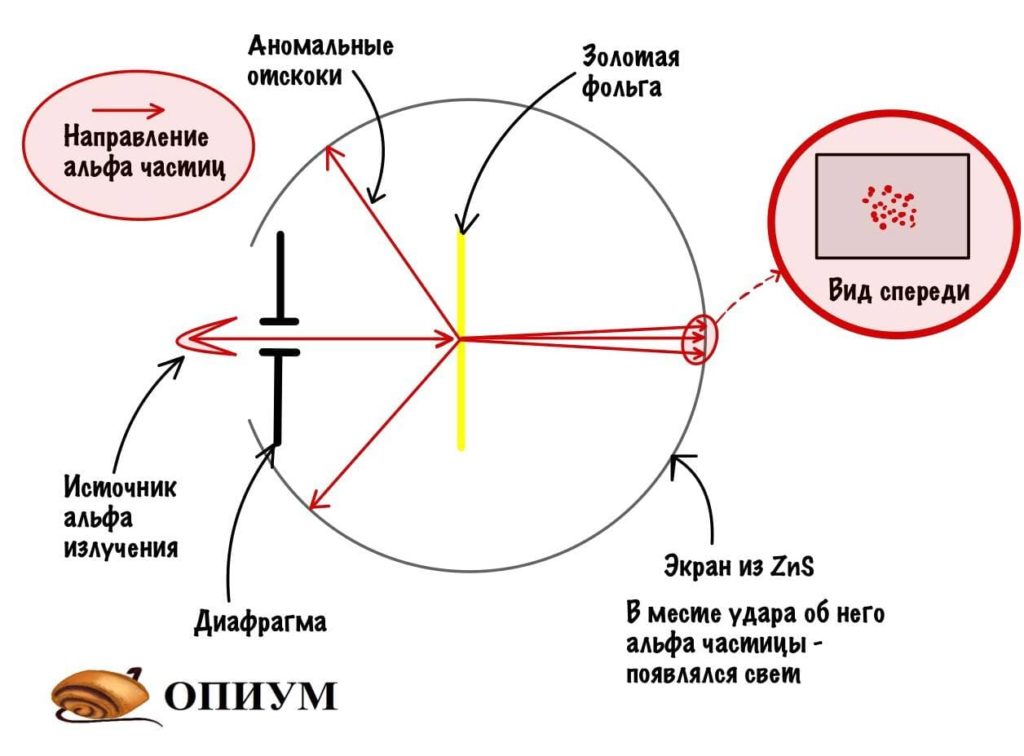
Резерфорд взял источник альфа-частиц и направил его на фольгу из золота. Диафрагма нужна для того, чтобы альфа-излучение направлялось только к фольге, а не разлеталось в разные стороны. При прохождении альфа-частиц через атомы золота они отклонялись, а место их удара отмечалось на цинковом экране (он светится, когда на него попадает альфа-частица).
Ничего удивительного, у атома есть заряд, и он вызывает отклонение частиц. Но тут случилось кое-что необычное: очень редко альфа-частицы отскакивали в другую сторону — к месту их «запуска». Резерфорд очень удивился и сказал: «Да это примерно тоже самое, что стрелять по тряпке из ружья и получить пулю в лоб». Конечно, не дословно, но смысл примерно такой.
Какие выводы делает Резерфорд из этого опыта? Он предполагает, что основная масса атома сосредоточена в его ядре — когда альфа-частицы попадают в него, то отскакивают в обратную сторону. Ядро очень маленькое и заряжено положительно, а вокруг него по орбитам летают отрицательно заряженные электроны. Он называет это планетарной моделью. Очень красиво, согласитесь?
Мы живем в мире, который находится в солнечной системе. А атомы, из которых состоит все вокруг, имеют строение такой же системы.
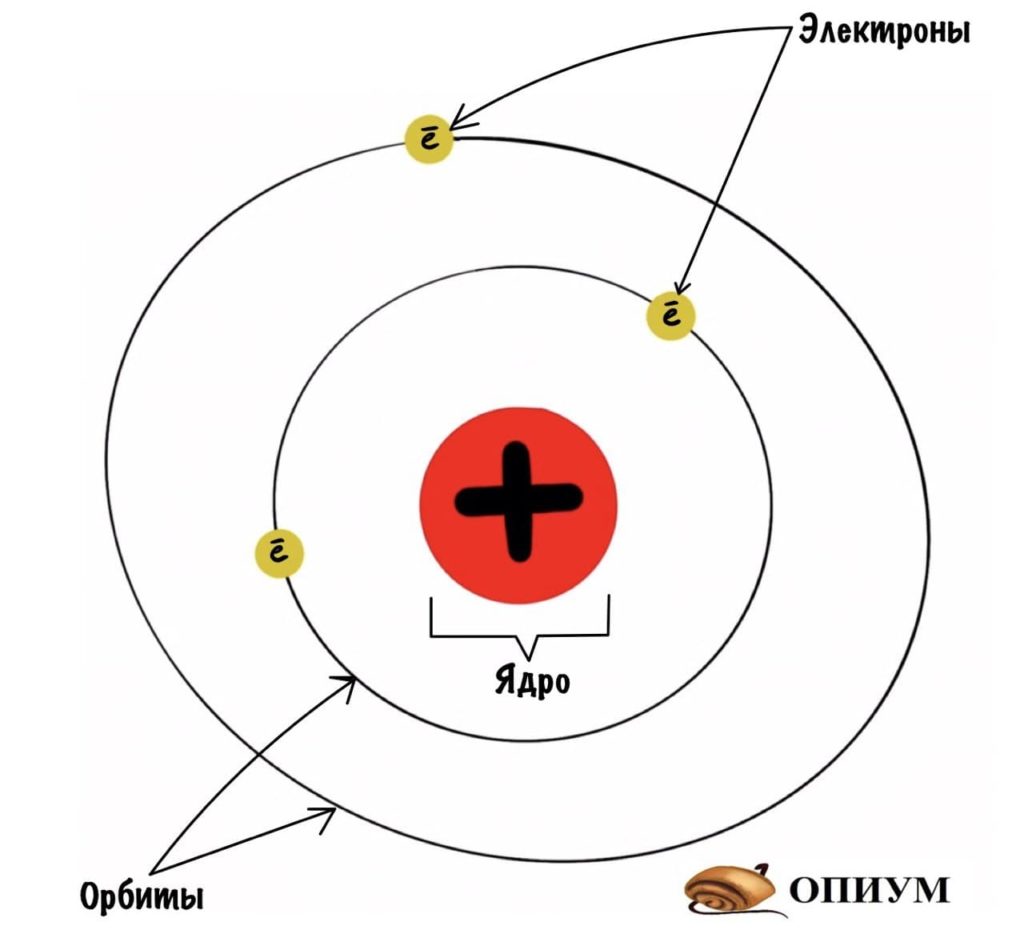
Это все очень поэтично и красиво, но есть парочка проблем:
- Если электроны летят по орбите, то у них есть скорость, и они излучают электромагнитные волны — или энергию. А значит они быстро ее потратят и упадут на ядро.
- Некоторые атомы излучают свет — фотоны. Это называется спектром. Но при такой модели им неоткуда взять такое количество энергии. Мало того, что они падают на ядро, так им еще и излучать что-то нужно. Не очень все это складывается.
Были и еще проблемы, но это основные. Как же их решить?
Полуклассическая модель атома по Бору
Появляется второй крутой мужик. Может быть, он даже круче первого, потому что говорит такое — от чего волосы у физиков встают дыбом. Бор взял модель атома по Резерфорду и сказал что-то вроде: «Давайте предположим, что электроны движутся по орбитам, но никакую энергию они не излучают. Но если электрон перепрыгивает с одной орбиты на другую, то он выделяет энергию — фотоны. Это и есть спектр!»
Бор назвал состояние атома, когда его электроны движутся по свои орбитам, стационарным состоянием. При перепрыгивании одного электрона на другую орбиту атом становится возбужденным и может выделять энергию. Атом становится возбужденным не просто так — он поглощает какую-то энергию извне, она представляет собой фотон или фотоны.
Переведем Бора на язык физиков: “Вся ваша физика полная туфта. Атому на нее плевать, он живет по другим законам”. И все как бы в шоке, но больше всех Эйнштейн — он становится главным хейтером Бора. Но экспериментально модель Бора подтверждается.
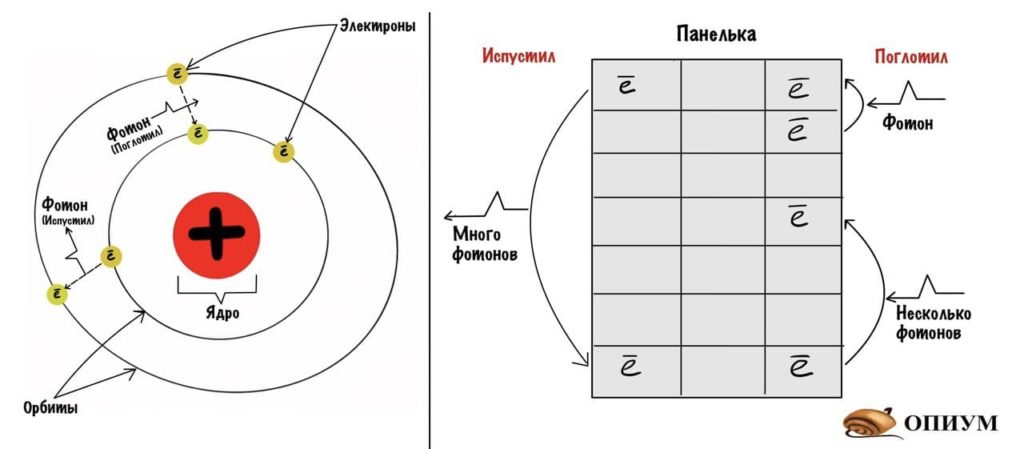
Модель Бора чем-то похожа на дом. Представьте себе панельку. Если электрон упадет с 7 этажа на первый, то он выделит энергию — это и есть фотон. А вот если зарядить как следует атом, то электрон может прыгнуть с первого этажа на пятый. Чем больше зарядишь, тем выше прыгнет. Чем с большей высоты упадет, тем больше выделит энергии. Примерно так.
Оказалось, что Бор был прав и дальше мы это увидим.
Резерфорд, кстати, сделал предположение, что ядро состоит из положительно заряженных протонов. Но Резерфорд и Бор еще не знали, от чего зависит количество электронов и протонов, но с этим разберутся попозже.
Современная модель атома
Ну а дальше началось самое интересное — физики взяли модель атома по Бору и добавили к ней своего добра. Так получилась современная модель атома. Конец! Ну или не совсем. Атом состоит из ядра и электронной оболочки.
Начинаем с ядра.
Ядро атома
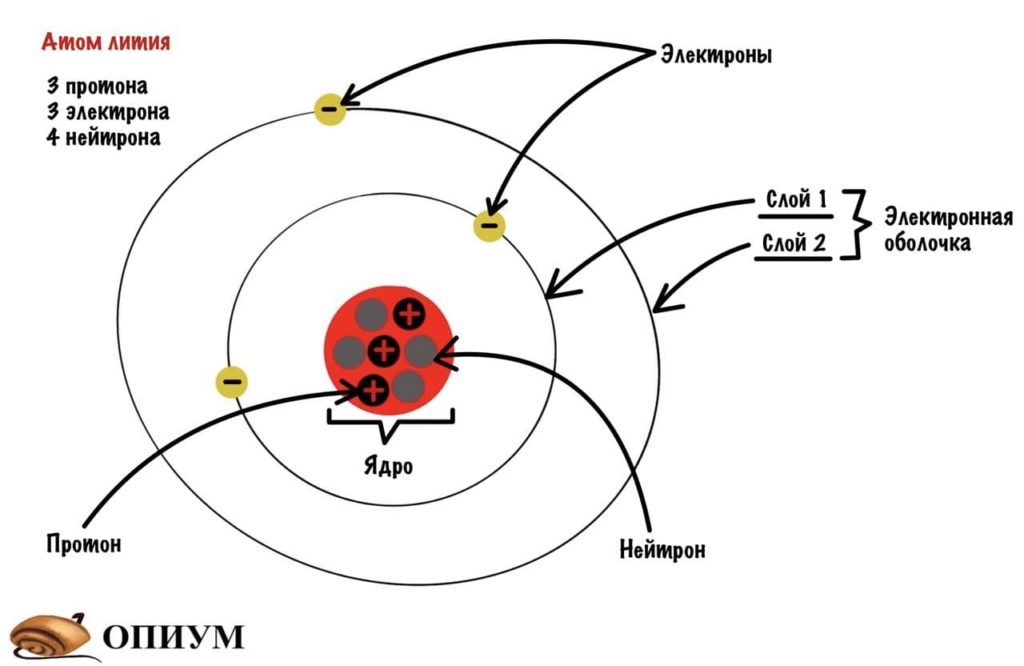
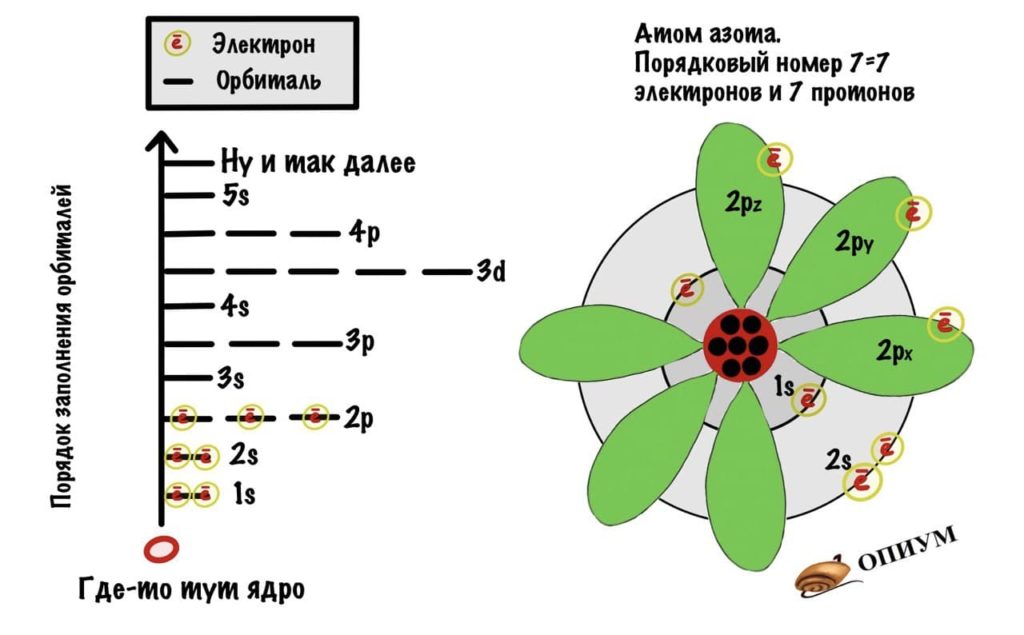
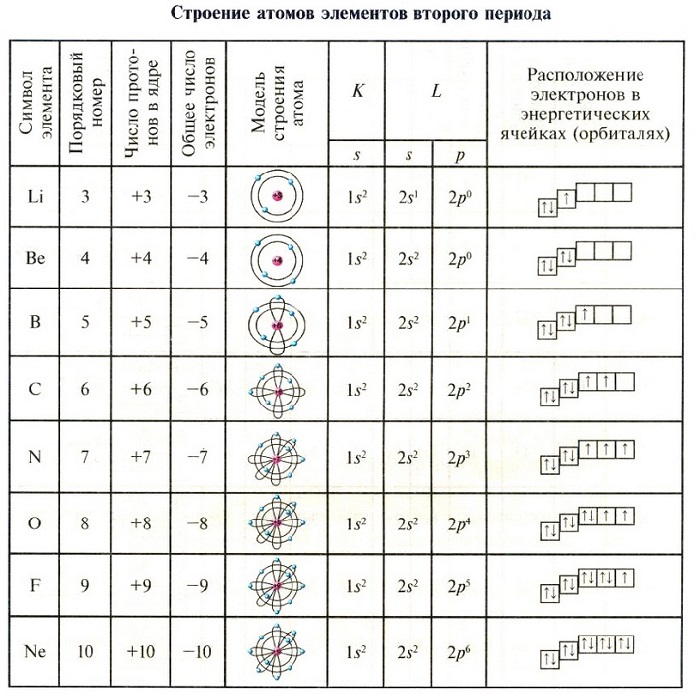
У атома есть ядро, которое состоит из протонов и нейтронов. Протоны заряжены положительно, а у нейтронов заряда нет. Количество протонов и электронов равно — зависит от порядкового номера в таблице Менделеева. Если это атом азота, то у него 7 протонов и 7 электронов. Нейтрон такому правилу не подчиняется — их может быть больше, а может и меньше.
Протон и нейтрон весят в примерно 1800 раз больше, чем электрон. Поэтому основная масса атома находится в ядре.
На самом деле протон и нейтрон состоят из других частиц, но не будем слишком глубоко копать. Можешь почитать, если интересно.
Электронная оболочка
Электронная оболочка — это все электроны атома. Она состоит из слоев, на которых располагается какая-то часть электронов.
Каждый слой состоит из орбиталей. Заметили? Не орбит, а орбиталей. Орбита — это траектория движения тела, на которой в какой-то момент времени можно его встретить. Помните круговые поливалки в деревне? Вода из них движется по определенной траектории. Можно встать и подождать пока тебя польют в жаркий день.
Орбиталь — это другое дело, на ней электрон проводит 90 процентов времени, но как он там движется — одному ему известно. Поэтому можно стоять очень долго, но так и не дождаться пока тебя польют. Пример не очень, согласен. Лучше бы привел Луну или какую-нибудь планету, но вы поняли…
Есть 4 вида орбиталей: s, p, d и f. S- это сфера, p — бесконечность или гантелька, d и f сложнее. Я их рисовать не буду, потому что они нас не интересуют. P-орбиталей всегда 3 — px, py, pz.
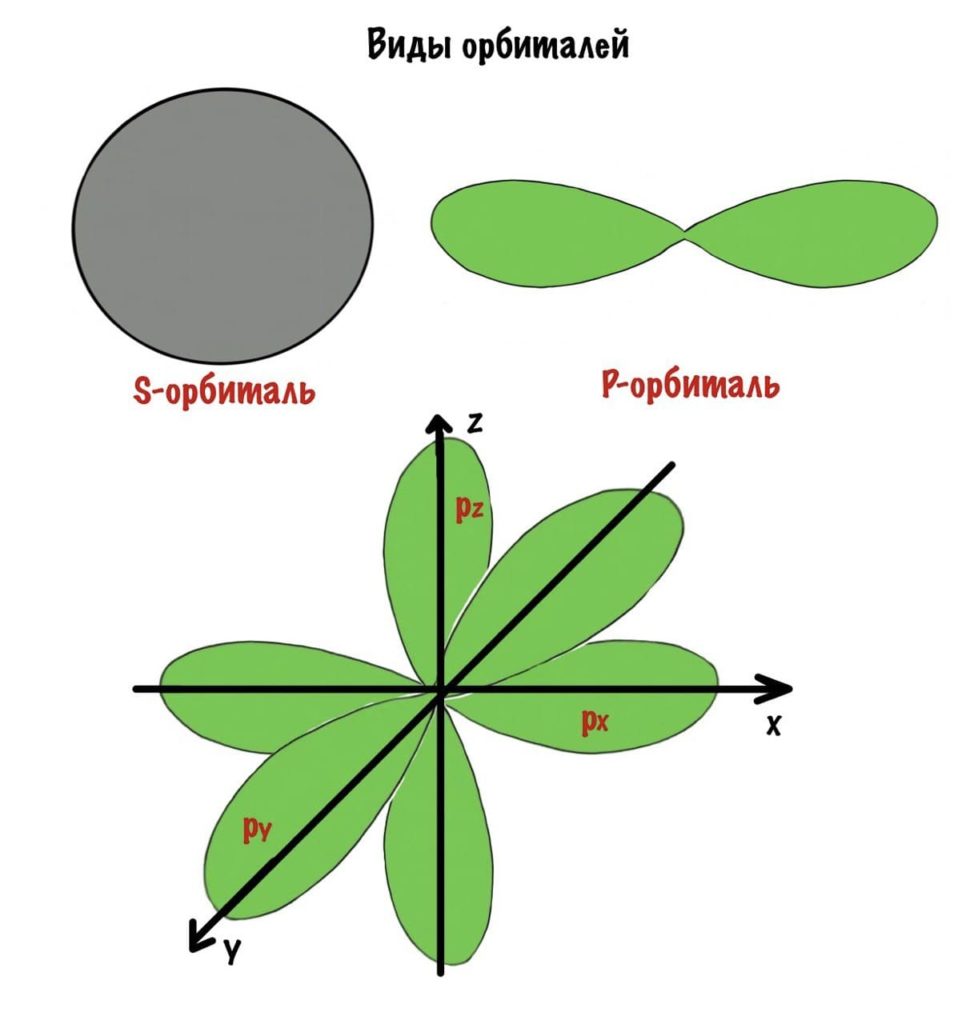
Слои электронной оболочки
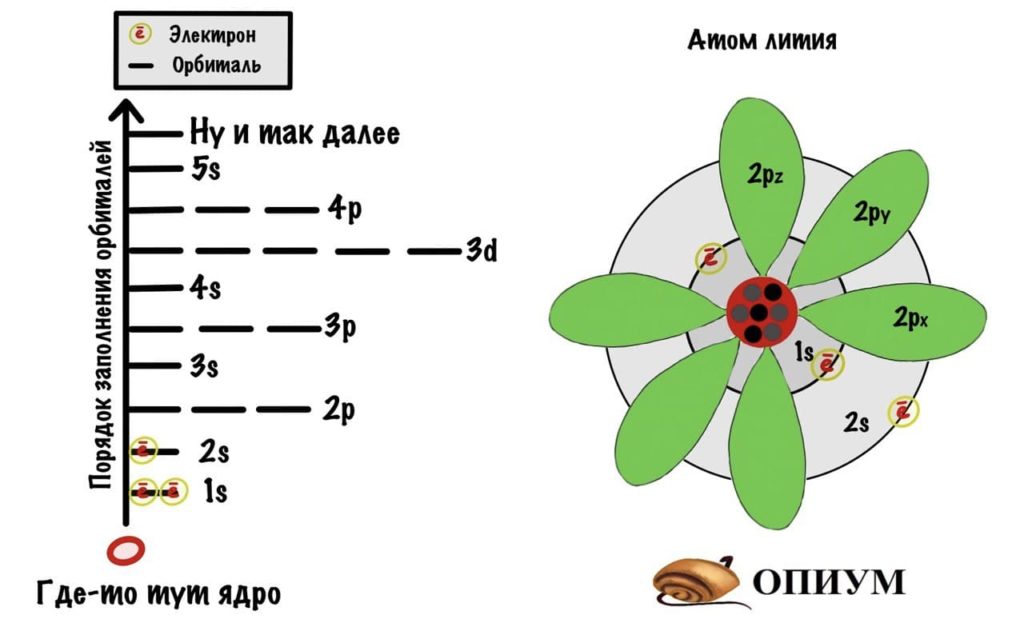
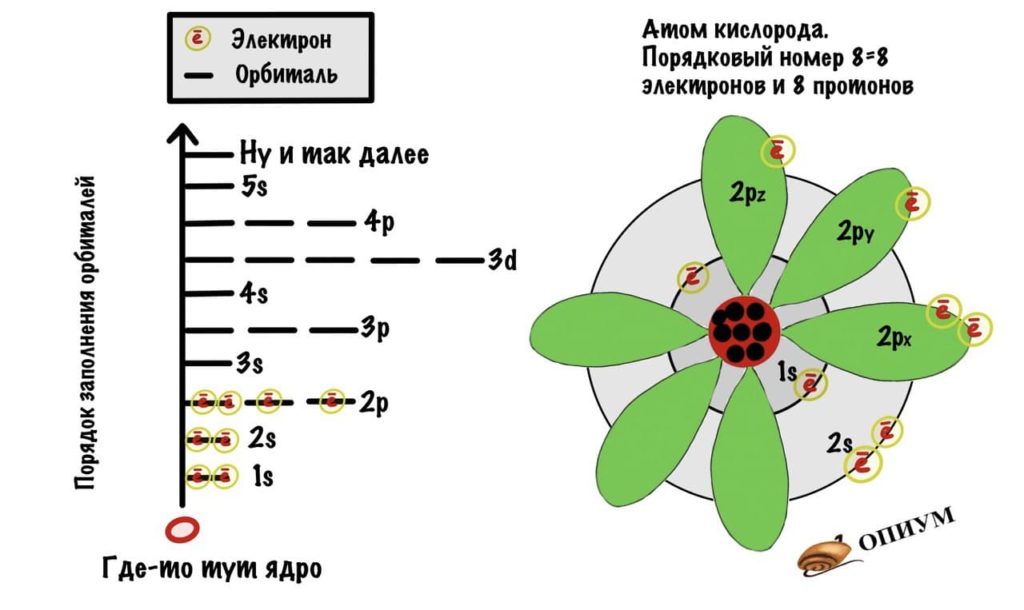
Теперь подробнее про слои. Первый слой состоит только из одной орбитали — s. Второй слой: одна s и три p орбиталей. Третий слой — одна s, три p и пять d орбиталей. Ну а на четвертом за 5d орбиталями добавятся еще 7f. Количество слоев зависит от количества электронов, а значит от порядкового номера атома.
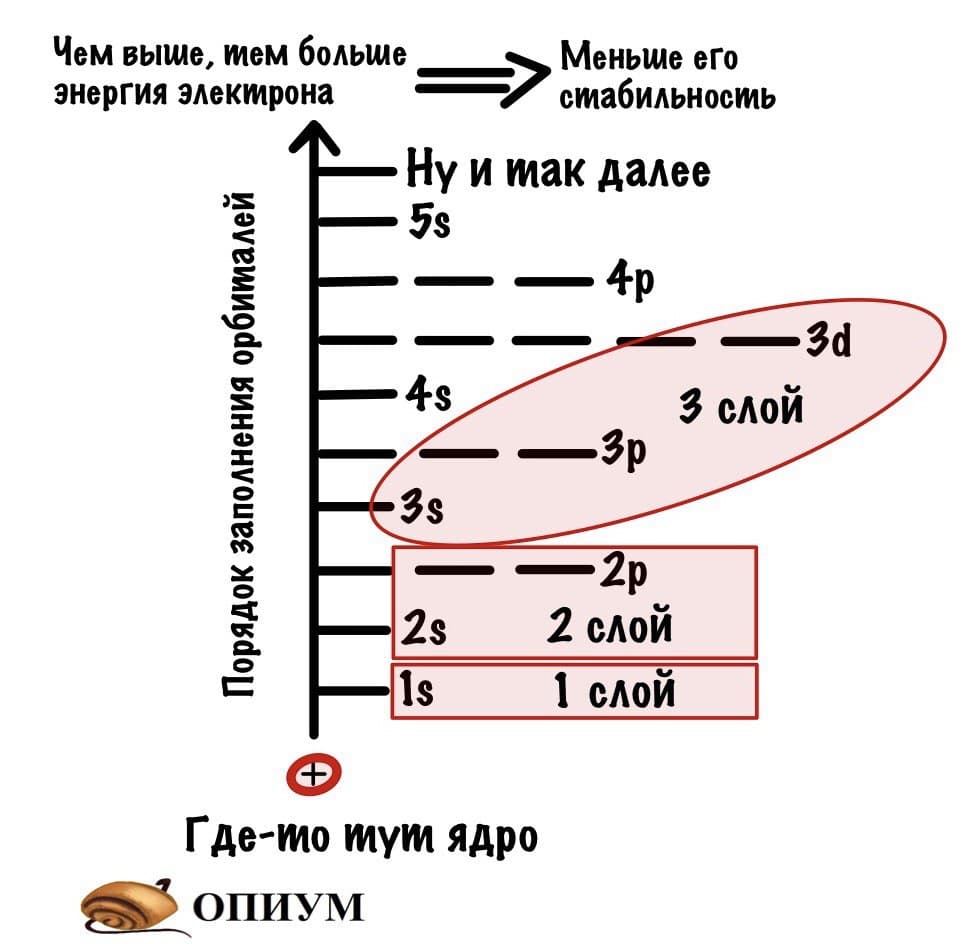
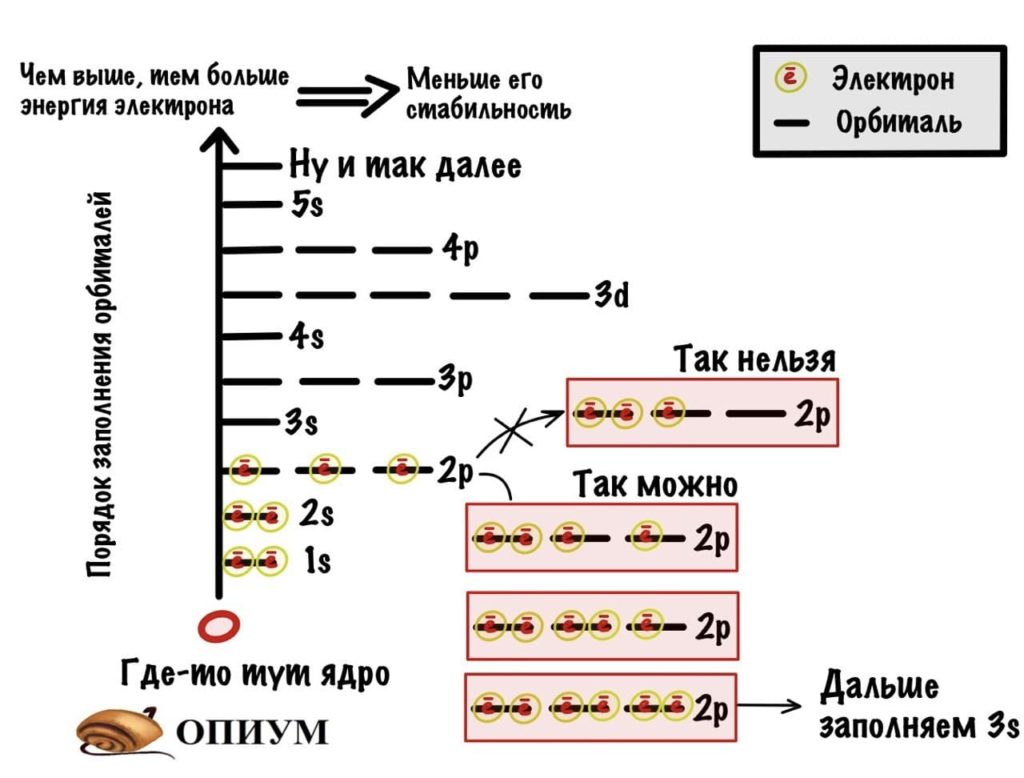
Тут есть определенные правила:
- На каждой орбитали могут находиться только два электрона.
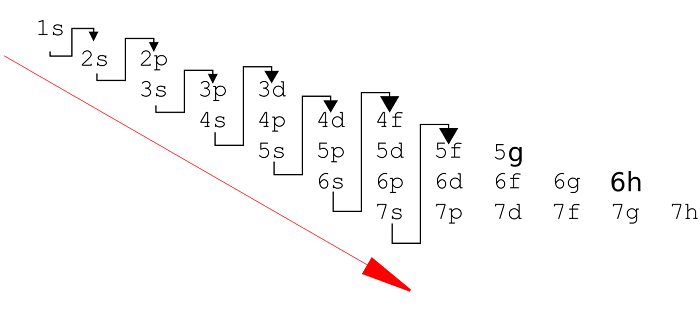
- Орбитали заполняются с определенной последовательностью, она видна на картинке.
- Чем дальше орбиталь от ядра атома, тем больше ее энергия и энергия электрона на ней.
- Электрону выгоднее быть на орбитале и слое, которые ближе всего к ядру атома. Там его энергетическое состояние стабильнее, так как меньше энергия. Поэтому электроны стремятся упасть вниз — прямо как я по социальной лестнице, ой.
Добавим к атому лития, который я показывал до этого, орбитали и получим что-то такое.
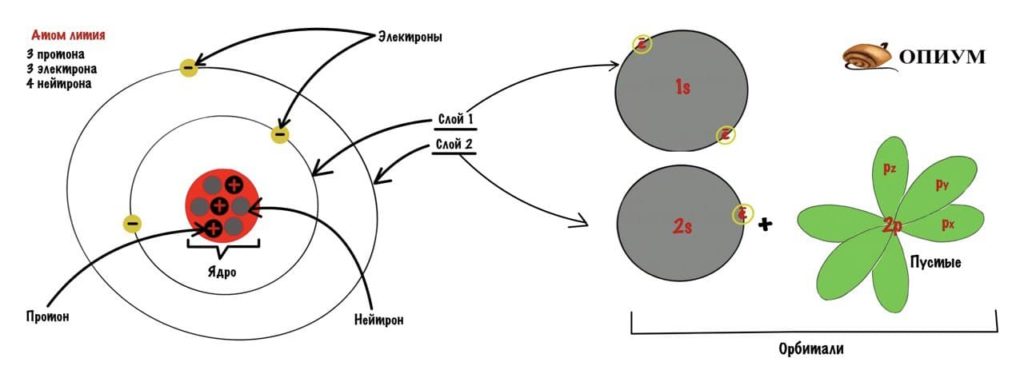
Можно еще попробовать свести орбитали в один рисунок, смотрите.
Химические связи чаще всего образуются за счет неспаренных электронов, но подробнее об этом поговорим в следующей статье. А сейчас нас интересует углерод и гибридизация его орбиталей.
Гибридизация орбиталей
Сначала посмотрим на электронную формулу углерода и вспомним о Боре. В стационарном состоянии у углерода всего два электрона на 2p-орбиталях. Однако, если атом углерода поглотит энергию фотона, то электрон с 2s-орбитали может перейти на 2p-орбиталь — атом углерода становится возбужденным. В таком состоянии он может образовать 4 связи, т.к. у него 4 неспаренных электрона.
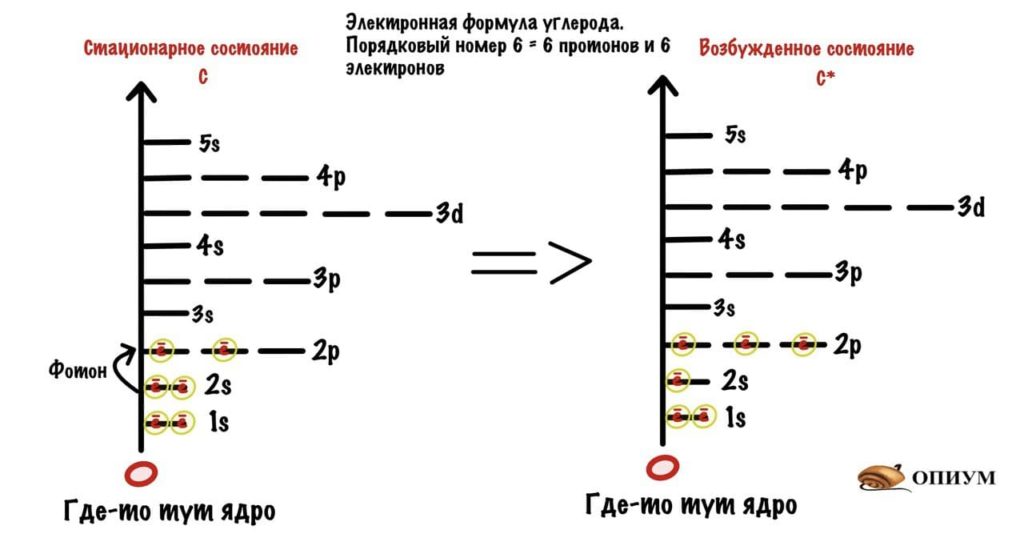
И тут встал вопрос. Атом углерода в возбужденном состоянии может образовать четыре связи, так как у него четыре неспаренных электрона. Но энергия связей будет разной, потому что эти электроны располагаются на разных орбиталях (у p орбитали энергия побольше). Это не очень хорошо сказывается на стабильности системы. Как выйти из этого положения?
Атом придумал интересную штуку — он изменил форму и размеры орбиталей. Это и есть гибридизация.
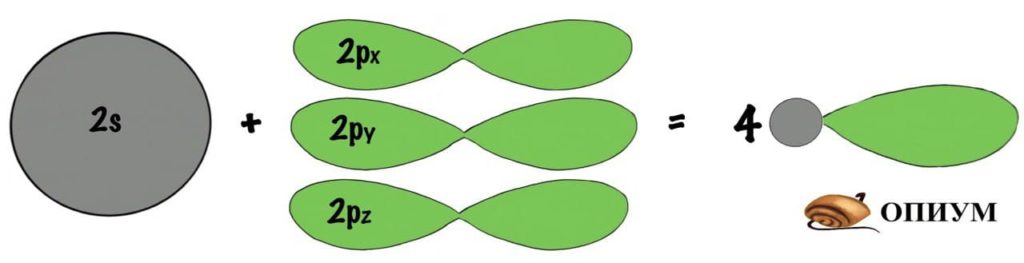
sp 3 -гибридизация
Когда три p орбитали объединяются с одной s, тогда получается sp 3 -гибридизация. Форма молекулы примерно такая:
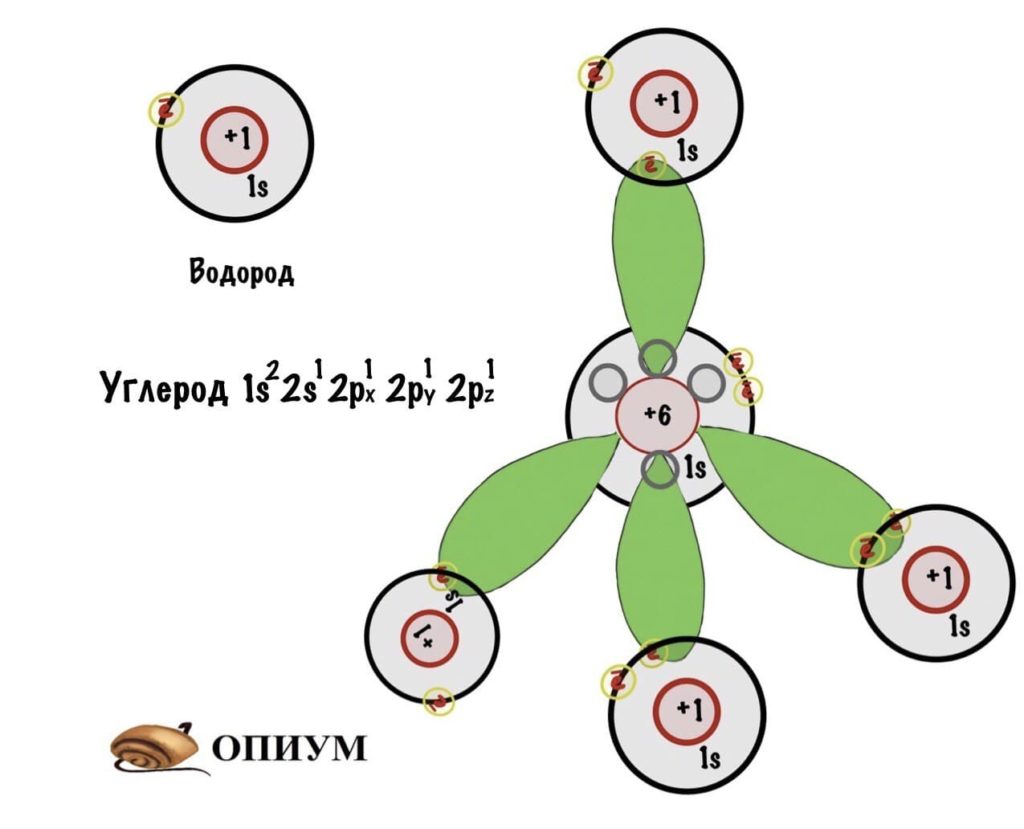
И на рисунке не особо понятно, но это тетраэдр или правильная треугольная пирамида. Просто рисовать в плоскости у меня не особо хорошо получается. Здесь между орбиталями легендарный угол — 109 о 28 ‘ . В организме почти весь углерод в такой гибридизации. Но не только у него бывает sp 3 -гибридизация. В молекулах аммиака и воды тоже такая гибридизация, но с нюансом, смотрите.
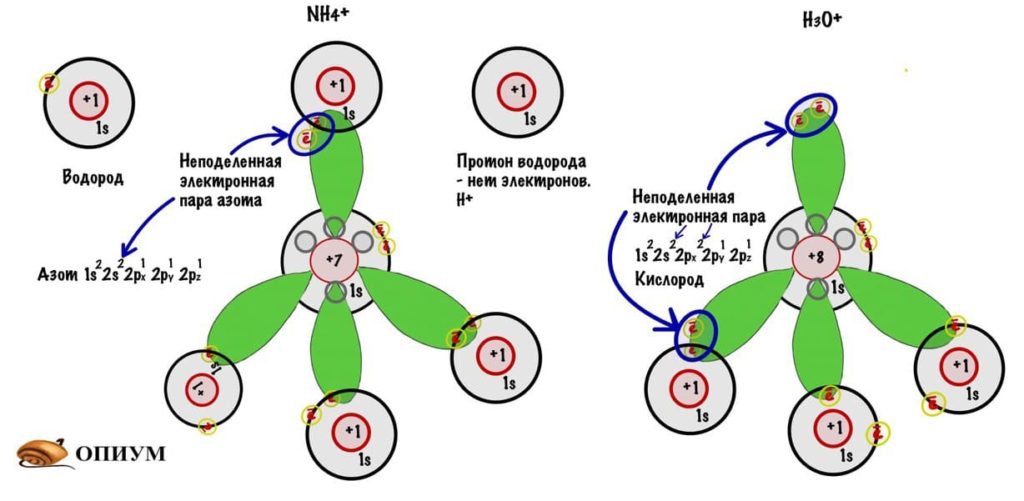
У азота есть одна неподеленная электронная пара на втором энергетическом слое, а именно на 2s-орбитали — там находится два электрона и третий туда уже не засунуть. Но азот может отдать протону водорода один электрон по донорно-акцептерному механизму и образовать связь. Так возникает ион аммония. Такая же тема с водой, но кислород не может отдать по электрону от каждой электронной пары — только с одной! Так образуется ион гидроксония.
sp 2 и sp-гибридизация
Название говорит само за себя. При sp 2 -гибридизации одна p-орбиталь остается без изменений, а две другие гибридизируются с s-орбиталью. Все орбитали лежат в одной плоскости под углом 120 градусов.

Куда пропала p-связь? Ну ладно, держите формулу этилена со всеми связями.
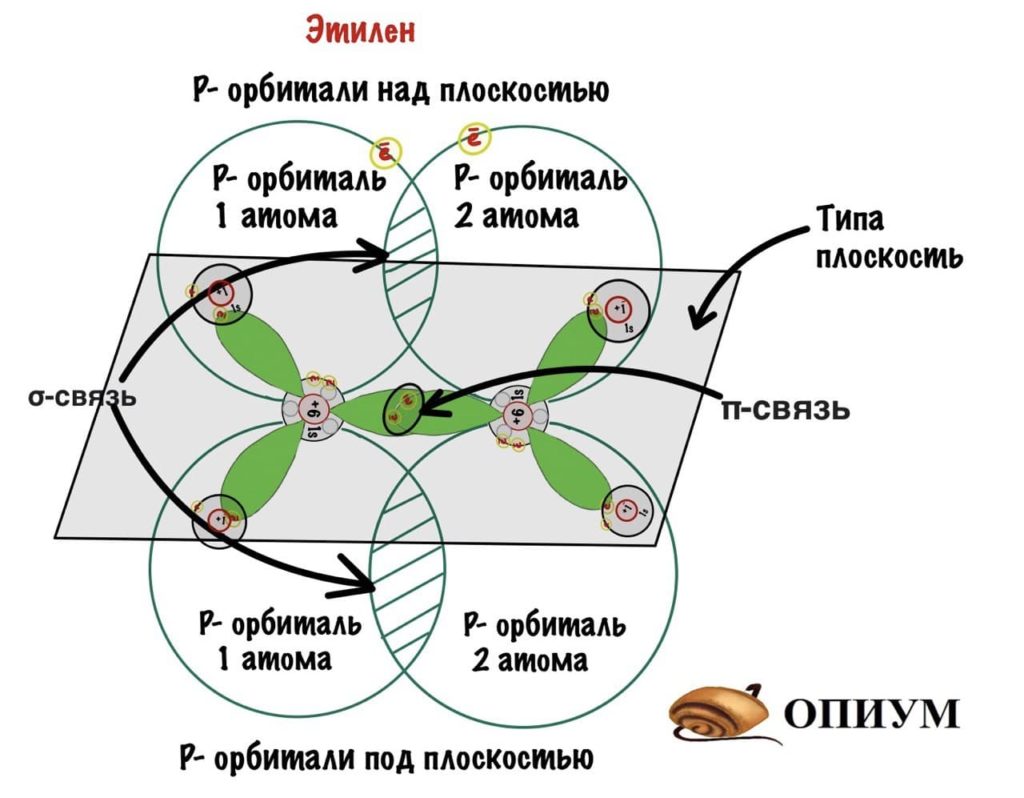
На рисунке видно, что p-орбитали без гибридизации находятся над и под плоскостью, они образуют сигма-связь — эта связь более жесткая, чем пи-связь. Поэтому вращение вокруг нее ограничено.
sp-гибридизацию нарисовать не смогу, сорян. Но смысл вы поняли: без изменений останутся две p-орбитали, а две sp-орбитали будут похожи на палочку — угол между ними будет 180 градусов. Одна p-орбиталь будет идти над плоскостью, а другая смотреть в лицо. Надеюсь, что у тебя получилось представить. Едем дальше.
Атомный остов
Есть еще такое понятие — ядерный остов, оно понадобится нам дальше. Сейчас быстро разберемся с ним.
Электронный слой бывает завершенным или незавершенным:
- Завершенный, если все орбитали заняты электронами.
- Незавершенный, если заняты не все.
Заряд ядра атома (количество протонов) + заряд завершенных слоев (количество электронов) = атомный остов. Картинка….
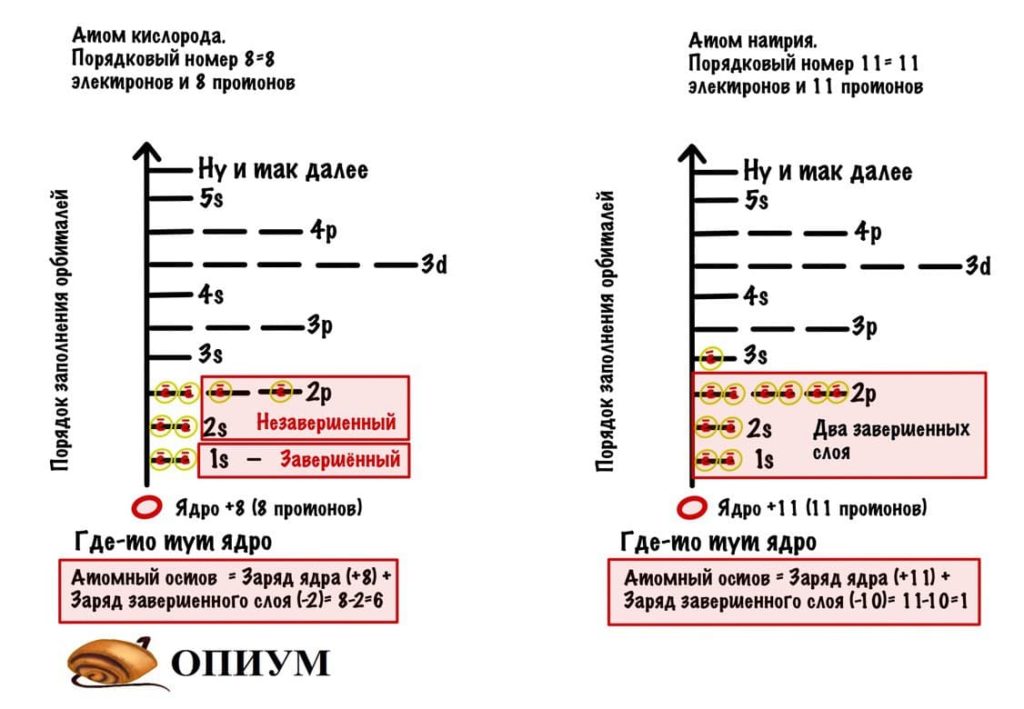
У кислорода заряд атомного остова больше, чем у натрия. Это нам понадобится, когда будем считать электроотрицательность.
Фух, со строением атома закончили. Поздравляю всех, кто дочитал до этого момента. Дальше можно переходить к электроотрицательности, но это уже в следующей статье.
Источник: opiumedu.ru
Строение электронных оболочек атомов — структура и схема распределения электронов по уровням
Строение электронных оболочек атомов химического элемента зависит от его месторасположения в периодической таблице Д. И. Менделеева. Химия неразрывно связана с изучением мельчайших частиц вещества. В данной статье рассмотрим, как заполняются электронами орбитали атома.
Строение атома
Атом любого вещества состоит из ядра (с положительным зарядом) и электронов (с отрицательным зарядом), расположенных вокруг него в виде электронного облака.

Ядро состоит из протонов и нейтронов. Значения зарядов противоположных частиц по абсолютному значению равны, в результате чего атом нейтрален. Вся его масса сосредоточена в центре. Количество протонов элемента всегда равно его порядковому номеру таблицы Д. И. Менделеева. Масса протона равна 1,00728 а.е.м., а заряд соответствует +1 условной единице.

Масса нейтрона составляет 1,00866 а.е.м., а заряд нейтрален. Масса электрона составляет 0,00055 а.е.м., а заряд -1 условной единице. Число нейтронов вычисляется по формуле N = A — Z, где A – массовое число, Z – число положительных частиц.
Строение электронной оболочки атома
Вид электронного облака зависит от орбит, по которым движутся отрицательные частицы. Область пространства, где вероятность их присутствия больше 90%, называется орбиталью.
Существует несколько типов орбиталей. S – шаровидная, p – гантелеобразная, d и f – сложная. Они группируются в виде слоев. Эти слои отличаются друг от друга расстоянием от ядра и энергией. Чем ближе находится слой к ядру, тем меньше его энергия.
Каждый уровень может содержать ограниченное количество отрицательных частиц, которое определяется формулой N = 2n 2 , где n – номер энергетического уровня. Внешний уровень может содержать не больше 8-ми электронов. В соответствии с правилом октета, это так называемый валентный слой, который характеризуется повышенной устойчивостью.
Принципы заполнения электронами орбиталей атома
Электронные оболочки заполняются по принципу возрастания энергии системы. Сначала заполняется уровень, расположенный ближе всего к ядру, а затем остальные, в порядке увеличения расстояния от него.

Первый уровень состоит из одной s-орбитали, а остальные из s-, p-, d- и f-подуровней, которые имеют 1, 3, 5 и 7 орбиталей. На каждой из них может находиться максимум 2 электрона. Таким образом, они могут содержать не более 2, 6, 10 и 14 электронов соответственно. Если у элемента внешним является полностью заполненный s-подуровень, то его называют s-элементом.
Если у элемента внешним является полностью заполненный p-подуровень, то его называют p-элементом. В соответствии с правилом Хунда отрицательные частицы располагаются на однотипных орбиталях одного ряда таким образом, чтобы суммарный спин был максимален. Следовательно, при заполнении ряда каждый электрон в первую очередь старается занять отдельную ячейку.
Если занять отдельный орбиталь не удается, он присоединяется к ряду уже другой отрицательной частицы. Определить структуру элемента можно по таблице Д. И. Менделеева. На примере химического элемента бария Ba (класс мягких металлов), видно, что он расположен в восьмом периоде, что означает наличие 8 энергетических уровней.

Порядковый номер 56 соответствует общему количеству электронов. Заполнение орбиталей выглядит следующим образом: +56Ba)2)8)18)18)8)2; 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6 6s 2 Если нарисовать схему данного элемента, то она будет иметь следующий вид:
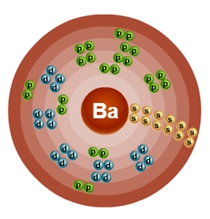
Следует отметить, что свойства и структура расположения частиц определяют химические и физические свойства вещества. Взаимодействие различных веществ также зависит от того, какой вид и структуру имеет электронное облако вещества.
Источник: nauka.club
Современные представления о строении атома. Электронные оболочки.
презентация к уроку по химии (11 класс)
Презентация, которая содержит теоретический и практический материал, необходимый для эффективного изучения темы Современные предствления о строении атома, электронные оболочки.
Скачать:
| |
932.76 КБ |
Предварительный просмотр:
Подписи к слайдам:
Современные представления о строении атома. Ядро атома образовано протонами и нейтронами..Электронную оболочку составляют электроны. Размеры атома имеют порядок 10 -10 м, а размеры ядра 10 -15 м.
Название частицы Обозначе-ние Заряд частицы Масса частицы В кулонах В единицах В кг В а.е.м . (112 массы атома изотопа углерода-12) протон P + 1,6 ˑ 10 -19 +1 1,6 ˑ 10 -27 1 нейтрон n 0 0 0 1,6 ˑ 10 -27 1 электрон e — 1,6 ˑ 10 -19 -1 9 ˑ 10 -31 0 (0,000549) ˑ
Число протонов как и число электронов в атоме определяется порядковым номером элемента в периодической системе химических элементов . Число протонов определяет заряд ядра атома (обозначается Z). Количество нейтронов рассчитывается как разность между массовым числом атома и зарядом ядра (A-Z). Совокупность атомов с определенным значением заряда ядра Z , массового числа A , называется нуклидом . Например: 37 Cl , 15 P . Если атомы одного и того же элемента отличаются по массе, то они являются изотопами . В атомах изотопов содержится разное количество нейтронов Например: 1 H , 2 H , 3 H – водород (H), дейтерий ( D ) и тритий ( T ).
Понятие об электронном облаке и s -, p -, d -, f — электронах Область пространства вокруг ядра, где наиболее вероятно нахождение электрона, называют атомной орбиталью . Атомные орбитали имеют различные формы, размеры и ориентацию в пространстве.
Состояние электронов в пространстве описывают с помощью четырех квантовых чисел. Главное квантовое число n – соответствует номеру энергетического уровня, на котором расположен электрон. (Количество энергетических уровней в атоме соответствует номеру периода, в котором расположен элемент .). Энергетический уровень – это совокупность энергетических состояний электрона в атоме, характеризующихся одним и тем же значением квантового числа n . Максимальное число электронов на каждом энергетическом уровне равно 2n 2 . Главное квантовое число принимает значения из множества натуральных чисел.
Орбитальное квантовое число l – определяет форму атомной орбитали. Принимает значения: для s — орбитали= 0, для p -орбитали=1, для d =2, а для f =3 Орбитальное квантовое число принимает значения ( n-l ). Совокупность орбиталей одной формы (с одинаковым значением орбитального квантового числа) на данном энергетическом уровне образует энергетический подуровень. На основании математических расчетов определили, что электронные облака имеют следующую форму: s – орбиталь — форму сферы, р – орбиталь форму вытянутой восьмерки, формы d — и f — еще более сложные. На каждом энергетическом уровне (кроме первого) содержится несколько разных орбиталей. На первом уровне – одна — s . На втором — две- s и p . На третьем – три s , p , d . На четвертом – четыре s , p , d , f и т.д.
Номер энергетического уровня Возможные орбитали Максимальное количество электронов на каждой орбитали 2п 2 1 уровень s -орбиталь 2 е 2 2 уровень s и p орбитали 2е, 6е 8 3 уровень s , p , и d орбитали 2е, 6е, 10е 18 4 уровень s , p , d , и f орбитали 2е, 6е, 10е, 14е 32 Строение первых четырех энергетических уровней Если электрон находится на s орбитали, то его называют s — электроном и т.д.
Вид электронной орбитали. Значение орбитального квантового числа ( l ). Число значений магнитного квантового числа (2 l +1). s 0 1 (1) p 1 -1,0,1 (3) d 2 -2,-1,0,1,2 (5) f 3 -3,-2,-1,0,1,2,3 (7) Магнитное квантовое число m l – определяет ориентацию атомных орбиталей в пространстве. Значение меняется от — l до + l . Число значений l определяется по формуле: (2 l +1).
Магнитное спиновое квантово число – m s — принимает два значения -12 и +12. На каждой орбитали могут одновременно находиться не более двух электронов, они будут отличаться друг от друга значением спинового квантового числа.
Принцип заполнения электронами атомных орбиталей подчиняется запрету Паули: в атоме не может быть двух электронов с одинаковым значением всех четырех квантовых чисел, т.е. в атоме не может быть электронов, которые находились бы в одинаковом квантовом состоянии. Правило Хунда : Наиболее устойчивым состоянием является такое, при котором будет максимально возможное число неспаренных электронов на каждом из подуровней.
Строение электронных оболочек описывают с помощью электронных формул, ее также называют электронной конфигурацией . Заполнение электронами электронных оболочек подчиняется правилу Хунда и правилу Клечковского . В соответствии с правилом Клечковского атомные орбитали заполняются электронами в порядке плавного возрастания суммы ( n+l ). При одинаковых значениях ( n+l ) сначала заполняются орбитали с наименьшим значением n .
1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f n 1 2 2 3 3 3 4 4 4 4 5 5 5 5 l 0 0 1 0 1 2 0 1 2 3 0 1 2 3 ( n+l ) 1 2 3 3 4 5 4 5 6 7 5 6 7 8
Таким образом, электронная конфигурация будет иметь вид: 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d и т . д . Примеры : S 1 s 2 2 s 2 2 p 6 3 s 2 3 p 4 p – элемент (т.к. последней заполняемой орбиталью является p-орбиталь ); Ca 1s 2 2s 2 2p 6 3s 2 3p 6 4 s 2 s – элемент ; V 1s 2 2s 2 2p 6 3s 2 3p 6 4s 4 3 d 3 d – элемент ; Pr 1s 2 2s 2 2p 6 3s 2 3p 6 4s 4 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4 f 3 5d 0 f — элеме нт
Радиус атома . Радиус атома – половина межъядерного расстояния в молекулах простых и сложных веществ в среднем достигают 10 -10 м. По периоду радиус атома немонотонно уменьшается . С увеличением заряда ядра атома число энергетических уровней остается постоянным. Т.о. электронная оболочка испытывает более сильное притяжение ядра, которое приводит к сжатию атома, т.е. уменьшению радиуса. В главных подгруппах радиус атома увеличивается. По мере увеличения номера периода происходит увеличение заполняющихся электронами уровней.
Основное и возбужденное состояние атома. Основное состояние атома – это то состояние, которое следует при составлении электронной конфигурации с учетом принципа минимума энергии, когда каждый электрон стремиться занять положение ближайшее к ядру. Для объяснения валентных возможностей атома элемента иногда прибегают к понятию возбужденного состояния атома. При этом происходит распаривание общих электронных пар, расположенных на валентном уровне и перевод электронов на другую валентную орбиталь. Пример обозначения состояния атома: основное возбужденное, C C *
Задания для тренировки 1. Изобразить электронные конфигурации атомов, указать тип элемента: Натрий, сера, фосфор, титан, гелий. Серебро, селен, марганец, углерод, аргон. Ванадий, скандий, теллур, цезий, криптон 2. По электронной конфигурации определите о каком элементе идет речь: 1S 2 2S 2 2P 5 ; 1S 2 2S 2 2P 6 3S 2 3P 6 4S 1 ; 1S 2 2S 2 2P 6 3S 2 3P 6 4S 2 3D 10 4P 5 . 3s 2 3p 2 4s 2 3d 3 4f 3 5d 0 6s 2 5s 2 4d 2 3. Почему в атомах следующих элементов происходит «проскок» электрона? Напишите электронные конфигурации атомов следующих элементов и объясните этот эффект: Cr, Ag, Mo, Pd
4.Почему в атомах следующих элементов вопреки ожиданию не происходит «проскока» электрона? W, Pt 5.Могут ли атомы в основном (не в возбужденном) состоянии иметь следующие конфигурации: 2s 2 2p 3 3s 2 3p 5 3d 1 3s 2 3p 3 3d 1 4s 1 4p 3 3d 2 6.Какие частицы могут иметь следующие конфигурации: 3s 2 3p 6 4s 2 3s 2 2s 2 2p 2
7.Какие, из приведенных ниже частиц, могут иметь одинаковые конфигурации: P 5+ ; F — ; S 2- ; Al 0 ; K + ; Ti 4+ ; C 4+ ; Na + ; Si 4+ ; N 3- ; Cu 2+ ? 8.Можно ли считать, что S 0 и S 2- одна и та же частица? Объясните свою точку зрения, составив электронные конфигурации. 9.Можно ли считать, что Cl — и Ar 0 абсолютно одинаковые частицы? Объясните свою точку зрения, приведя необходимые расчеты.
10.Числа 35 и 17 в обозначении атома 17 35 Cl показывают.. . число протонов и число нейтронов массовое число и заряд ядра атомную массу и порядковый номер хлора общее число электронов и число валентных электронов в атоме 11.Главное квантовое число характеризует… молекулярную орбиталь ориентацию орбитали в пространстве число электронов в атоме общую энергию электрона
12.Распределение электронов по орбиталям в основном состоянии атома определяется… принципом запрета Паули правилом Хунда принципом наименьшей энергии всеми перечисленными выше принципами 13.Укажите, в каком из случаев орбитали перечислены в порядке увеличения их энергии: 2s,2p,2d 3s,3p,3d 4f,5s,6d 3p,3d,3f
14. Сколько электронов находится на 2 p -подуровне в основном состоянии атома азота? 7 5 3 1 15. Какую из перечисленных электронных конфигураций может иметь атом хлора? 1s 2 2s 2 2p 5 1s 2 2s 2 2p 6 3s 2 3p 4 4p 1 1s 2 2s 2 2p 6 3s 2 3p 6 1s 2 2s 2 2p 6 3s 2 3p 5 4s 1
Тестовые задания 1. Число протонов, нейтронов и электронов в атоме изотопа 90 Sr соответственно равно 38, 90, 38 38, 52, 38 90, 52, 38 38, 52, 90 2. Инертный газ, имеющий такую же электронную конфигурацию, что и ион K + Ne Ar Cl Kr 3. Частица, имеющая такую же электронную конфигурацию, что и атом Kr , это Se 2- Br +5 S 2- Ar 0
4. Ионы, имеющие такую же электронную конфигурацию, что и атом аргона, это K + и S 2- K + и Na + Al 3+ и S 2- Na + и Al 3+ 5. Электронная формула меди 1s 2 2s 2 2p 6 3s 2 3p 6 3d 9 4s 2 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 1s 2 2s 2 2p 6 3s 2 3p 6 3d 3 4s 2 4p 6 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 6. Какой ряд не содержит d -элементов Марганец, тантал, сера, углерод Азот, натрий, аргон, йод Вольфрам, железо, цинк, лантан Хром, цезий, франций , бром
7. Заряд иона, образующегося в результате удаления всех валентных электронов атома с электронной конфигурацией 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 1 , равен +14 +1 +5 +6 8. Суммарное число электронов в частице NO 2 — равно 22 23 24 25 9. 16 электронов содержит частица Cl — S 2- O 0 S 0
10. Число нейтронов в атоме 39 К равно числу нейтронов в атоме 39 Ar 40 Ca 35 Cl 40 Ar 11. Число протонов в атоме 39 К равно 39 20 19 4 12. Число электронов внешнего электронного слоя для атома кислорода равно 2 4 6 8
13. Не отвечает формуле 2 s 2 2 p 6 строение внешнего электронного слоя частицы F — Mg 2+ Na + O 0 14. Число неспаренных электронов атома углерода в возбужденном состоянии равно 1 2 3 4 15. Число нейтронов в ядре атома 31 Р равно 5 15 16 31
16. 20 нейтронов содержит атом 39 K 42 Ca 20 Ne 10 B 17. В четвертом электронном слое содержит 5 электронов атом V As Sn Zr 18. Электронную конфигурацию внешнего электронного слоя 4 s 2 4 p 3 имеет атом As Ga Sc V
19. Заряд любого атома равен.. нулю порядковому номеру элемента числу электронов заряду ядра 20.Массовое число атома показывает.. относительную атомную массу массу атома в атомных единицах заряд ядра общее число протонов и нейтронов
По теме: методические разработки, презентации и конспекты

Тест «Строение атома. Строение электронных оболочек атомов»
Ученикам: Выберите один правильный ответ. Обратите внимание вы должны уметь расписывать электронное строение атомов 20 первых элементов расположенных в ПСХЭ Д.И.Менделеева. Удачи! Тест для 9 класса. .

Видео. Как составить схему строения атома, электронную формулу, энергетическую диаграмму (8 класс)
В этом видеоролике показан порядок составления схемы строения атома, электронной формулы и энергетической диаграммы.Ссылка на видео:http://www.youtube.com/watch?v=_GQVkuLFXdM.

Проверочная работа по теме «Строение атома. Электронные оболочки атомов», 8 класс
Тестовая работа по теме «Строение атома. Электронные оболочки атомов» предназначена для учащихся 8-х классов и включает в себя 10 заданий с выбором одного правильного ответа.

Тест «Строение атома. Электронная оболочка атома»
Тестовая работа включает 10 вопросов, 4 варианта. Задания на выбор одного верного ответа из четырех предложенных, задания на соответствие.

Примеры заданий по теме: Строение атома. Строение электронных оболочек атомов
Разработка представляет собой подборку заданий по теме: «Строение атома. Строение электронных оболочек атома»(задание 1). Задания могут быть использованы.

8 класс Состав и важнейшие характеристики атомов. Строение электронных оболочек атомов.

Презентация по теме «Строение атома. Электронные оболочки»
Информация о распределении электронов по энергетическим уровням, электронные конфигурации ионов, основное и возбуждённое состояние атома, валентные и внешние электроны.
Источник: nsportal.ru