Великому русскому ученому Дмитрию Ивановичу Менделееву было всего 35 лет, когда в 1869 году он сформулировал периодический закон и создал Периодическую систему химических элементов.
Прообраз таблицы появился в первом издании учебника «Основы химии», который разрабатывал Менделеев. По мнению историков, именно работа над учебником и заставила его задуматься над природой и взаимосвязью химических элементов и попытаться поместить их в понятную систему.
Об истории создания таблицы Менделеева и о том, почему она, как и закон, называется периодической – в материале РЕН ТВ.
Предыстория появления системы химических элементов
В далеком 1668 году выдающимся ирландским химиком, физиком и богословом Робертом Бойлем был опубликован научный труд, в котором было развенчано немало мифов об алхимии, и в котором он рассуждал о необходимости поиска неразложимых химических элементов.
Ученый также привел их список, состоящий всего из 15 элементов, но допускал мысль о том, что этот список неполный. Это стало отправной точкой не только в поиске новых элементов, но и в их систематизации.
Группы периодической таблицы
Сто лет спустя французским химиком Антуаном Лавуазье был составлен новый перечень, в который входили уже 35 элементов. 23 из них позже были признаны неразложимыми. Но поиск новых элементов продолжался учеными по всему миру.
К середине XIX века было открыто 63 химических элемента и ученые всего мира не раз предпринимали попытки объединить все существовавшие вещества в единую концепцию. Элементы предлагали разместить в порядке возрастания атомной массы и разбить на группы по сходству химических свойств.
В 1863 году свою теорию представил химик и музыкант Джон Александр Ньюлендс, который предложил схему размещения химических элементов, схожую с той, что открыл Менделеев, но работа английского ученого не была принята всерьез научным сообществом из-за того, что автор увлекся поисками гармонии и связью музыки с химией.

Как появились периодический закон и таблица химических элементов
Знаменитый русский ученый-энциклопедист Дмитрий Иванович Менделеев впервые выдвинул гипотезу о том, что между атомной массой элементов и их расположением в системе может быть взаимосвязь.
Благодаря кропотливому труду и сопоставлению химических элементов Менделеев смог обнаружить связь между элементами, в которой они могут быть одним целым, а их свойства являются не чем-то само собой разумеющимся, а представляют собой периодически повторяющееся явление.
В результате размышлений Менделеева 1 марта 1869 года был завершен самый первый вариант Периодической системы химических элементов, который получил тогда название «Опыт системы элементов, основанной на их атомном весе и химическом сходстве».
Как выглядела первая таблица Менделеева
В этом варианте элементы были расставлены по девятнадцати горизонтальным рядам (рядам сходных элементов, ставших прообразами групп современной системы) и по шести вертикальным столбцам (прообразам будущих периодов).
Как пользоваться таблицей Менделеева. Химия – просто
1 марта 1869 года знаменует собой открытие Менделеевым периодического закона, но более верным будет считать эту дату началом открытия, поскольку еще требовалось его осмысление и затем – достижение формулировки.
«Опыт системы элементов» был напечатан с химическим обоснованием в программной статье ученого «Соотношение свойств с атомным весом элементов» в «Журнале Русского физико-химического общества». А уже в апреле 1869 года состоялась первая публикация таблицы Менделеева в международной печати – она вышла в свет в лейпцигском Journal für Practische Chemie («Журнале практической химии») и стала достоянием мировой науки.
В том же году эта статья из «Журнала Русского химического общества» была переведена в Zeitschrift für Chemie, а в 1872 году в журнале Annalen der Chemie und Pharmacie была опубликована развернутая статья Менделеева, посвященная его открытию, – Die periodische Gesetzmässigkeit der Elemente («Периодическая закономерность химических элементов»).
В этой работе, датированной августом 1871 года, Дмитрий Менделеев приводит формулировку периодического закона, которая затем оставалась в силе на протяжении более сорока лет: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
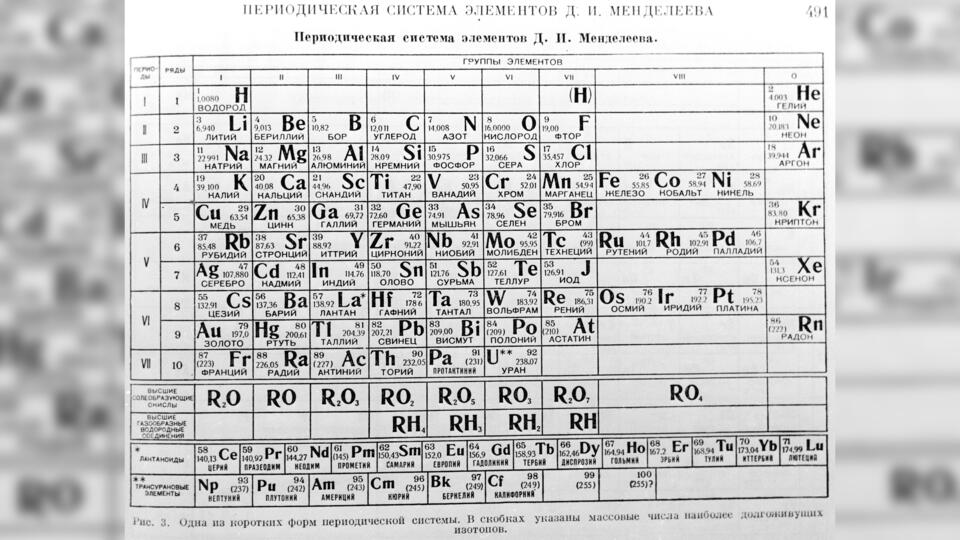
Почему таблица называется периодической
Суть открытия Менделеева в том, что с ростом атомной массы химические свойства элементов меняются не монотонно, а периодически. После определенного количества разных по свойствам элементов свойства начинают повторяться. Так, калий похож на натрий, фтор – на хлор, а золото схоже с серебром и медью.
Появление новых элементов в таблице Менделеева
Пользуясь периодической системой, Менделеев также предсказал открытие нескольких новых химических элементов и описал их химические и физические свойства. В дальнейшем расчеты ученого полностью подтвердились: галлий (открыт в 1875 году), скандий (открыт в 1879 году) и германий (открыт в 1885 году) поразительно точно соответствовали тем свойствам, которые описал Менделеев.
Затем прогнозы гениального химика продолжили реализовываться и были открыты еще восемь новых элементов, среди которых: полоний (1898 год), рений (1925 год), технеций (1937 год), франций (1939 год) и астат (1942–1943 годы).
Кстати, в 1900 году Дмитрий Менделеев и шотландский химик Уильям Рамзай пришли к мнению, что в таблицу должны быть включены и элементы нулевой группы – до 1962 года они назывались инертными, а после – благородными газами.
На сегодняшний день в Периодической системе химических элементов – 118 элементов. Последний, самый тяжелый из известных, — оганесон (Og), названный так в честь своего первооткрывателя Юрия Цолаковича Оганесяна. Научный руководитель лаборатории ядерных реакций имени Г.Н. Флерова Объединенного института ядерных исследований в Дубне стал четвертым в истории ученым, при жизни которого его именем был назван химический элемент.

Организация Периодической системы химических элементов
Химические элементы в таблице Д.И. Менделеева расположены по рядам в соответствии с возрастанием их массы, а длина рядов подобрана так, чтобы находящиеся в них элементы имели схожие свойства.
Например, благородные газы, такие как радон, ксенон, криптон, аргон, неон и гелий, с трудом вступают в реакции с другими элементами, а также имеют низкую химическую активность, из-за чего расположены в крайнем правом столбце.
А элементы левого столбца (калий, натрий, литий и т.п.) отлично реагируют с прочими элементами, а сами реакции носят взрывной характер.
Говоря проще, внутри каждого столбца элементы имеют подобные свойства, варьирующиеся при переходе от одного столбца к другому.
Все элементы вплоть до № 92 встречаются в природе, а с № 93 начинаются искусственные элементы, которые могут быть созданы лишь в лабораторных условиях.
В своем первоначальном варианте периодическая система понималась только как отражение существующего в природе порядка, и никаких объяснений, почему все должно обстоять именно так, не было. И лишь когда появилась квантовая механика, истинный смысл порядка элементов в таблице стал понятен.

Самые старые экземпляры таблицы Менделеева
В 2019 году в Сент-Эндрюсском университете Великобритании был обнаружен один из старейших образцов таблицы. Это произошло, когда доктор Алан Айткен наводил порядок в кладовке химического факультета. Факультет переехал в новое помещение в 1968 году, и с тех пор оборудование, реактивы и бумаги пылились в подсобном помещении.
Таблица лежала в кладовке среди кучи разных лабораторных принадлежностей. В какой-то момент Айткен обнаружил свернутые в трубку лекционные материалы по химии, а в них – копию Периодической таблицы химических элементов, возраст которой оценивался в 133–140 лет.
Найденная таблица аннотирована на немецком языке, слева внизу идет надпись Verlag v. Lenoir Sohn, Wien – определяет литографа диаграммы, который умер в 1890 году.
Выяснить, в каком году была напечатана таблица, помогли поиски в университетском архиве. Нашлись данные о покупке таблицы профессором Томасом Пурди – пособие было куплено в октябре 1888 года. Тогда оно стоило 3 немецкие марки.
Восстановление плаката заняло немало времени: поверхность пришлось очистить от грязи и мусора, отделить таблицу от подкладки, на которой та была закреплена, обработать специальными растворами для выравнивания кислотно-щелочного баланса и устранить разрывы с помощью специальной бумаги из бруссонетии бумажной и пасты из пшеничного крахмала.
Теперь таблица находится в специальном хранилище университета, где для нее созданы подходящие условия. На самом же факультете осталась ее полномасштабная копия.
Чуть позже, но в том же 2019 году, сотрудники Санкт-Петербургского университета сообщили о своей сенсационной находке – обнаруженная ими в Большой химической аудитории таблица оказалась на 12 лет старше.
В университете рассказали, что таблица представляет собой демонстрационный вариант, изготовленный в 1876 году. Она отличается от современных вариантов. Например, в ней нет VIII группы, в которую входят инертные (благородные) газы: на момент публикации они еще не были открыты.

Как появилась легенда о том, что Менделеев увидел таблицу во сне
Об известном ученом и его открытиях ходило немало баек и легенд. Одна из самых известных гласит, что Менделеев увидел свою таблицу во сне.
Сам Дмитрий Иванович об открытии периодического закона писал так:
«Заподозрив о существовании взаимосвязи между элементами еще в студенческие годы, я не уставал обдумывать эту проблему со всех сторон, собирал материалы, сравнивал и сопоставлял цифры. Наконец настало время, когда проблема созрела, когда решение, казалось, вот-вот готово было сложиться в голове. Как это всегда бывало в моей жизни, предчувствие близкого разрешения мучившего меня вопроса привело меня в возбужденное состояние. В течение нескольких недель я спал урывками, пытаясь найти тот магический принцип, который сразу привел бы в порядок всю груду накопленного за 15 лет материала.
И вот в одно прекрасное утро, проведя бессонную ночь и отчаявшись найти решение, я, не раздеваясь, прилег на диван в кабинете и заснул. И во сне мне совершенно явственно представилась таблица.
Я тут же проснулся и набросал увиденную во сне таблицу на первом же подвернувшемся под руку клочке бумаги».
Эта история позже и легла в основу легенды о том, что таблица Менделееву приснилась. Самому ученому такая интерпретация не нравилась.
«Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг. готово», – говорил он.
Научные открытия, сделанные во сне
Впрочем, история знает и другие примеры, когда ученые мужи не только не отрицали, а даже подчеркивали, что сделали свои открытия во сне.
- Так, немецкому химику Фридриху Августу Кекуле приснилась формула бензольного кольца.
- Датчанин Нильс Бор во сне очутился на Солнце, а вокруг него на огромной скорости вращались планеты. Под впечатлением от этого сновидения Бор создал планетарную модель строения атомов, за которую ему позже вручили Нобелевскую премию.
- А в середине XX века американский ученый Джеймс Уотсон увидел во сне двух переплетающихся змей. Это сновидение помогло ему первым в мире изобразить форму и структуру ДНК.
Источник: ren.tv
Как называется серебро в таблице Менделеева?
У нас есть 19 ответов на вопрос Как называется серебро в таблице Менделеева? Скорее всего, этого будет достаточно, чтобы вы получили ответ на ваш вопрос.
Содержание
- Как в таблице Менделеева обозначено серебро?
- Как называется золото в таблице?
- Какая есть проба серебра?
- Как обозначается проба серебра?
- Как называется серебро в таблице Менделеева? Ответы пользователей
- Как называется серебро в таблице Менделеева? Видео-ответы
Отвечает Роман Петряков
Серебро (лат. Argentum), Ag, химический элемент I группы периодической системы Менделеева, атомный номер 47, атомная масса 107,868; металл белого цвета, пластичный, хорошо полируется.
Как в таблице Менделеева обозначено серебро?
Серебро́ (химический символ — Ag, от лат. Argentum) — химический элемент 11 группы (по устаревшей классификации — побочной подгруппы первой группы, IB), пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 47.
Как называется золото в таблице?
Зо́лото (Au от лат. Aurum) — элемент 11 группы (по устаревшей классификации — побочной подгруппы первой группы), шестого периода периодической системы химических элементов, с атомным номером 79. Простое вещество золото — благородный металл жёлтого цвета.
Какая есть проба серебра?
Таким образом, существует несколько разновидностей проб серебра:800 — для столовых приборов. . 830 — для изготовления посуды;875 — для бытовых нужд и изделий экономкласса. . 925 — самая распространенная проба. . 960 — максимальная проба для ювелирного дела. . 999 — чистое серебро.
Как обозначается проба серебра?
Для благородных металлов в России установлены следующие пробы: золото — 375, 500, 583*, 585, 750, 875, 916, 958, 999. серебро — 800, 830, 875, 925, 960, 999. платина — 585, 850, 900, 950.
Источник: querybase.ru
Серебро
Серебро (лат. Argentum), Ag, химический элемент I группы периодической системы Менделеева, атомный номер 47, атомная масса 107,868; металл белого цвета, пластичный, хорошо полируется. В природе находится в виде смеси двух стабильных изотопов 107 Ag и 109 Ag; из радиоактивных изотопов практически важен 110 Ag (T½ = 253 сут). Серебро было известно в глубокой древности (4-е тысячелетие до н. э.) в Египте, Персии, Китае.
Физические свойства Серебра. Серебро имеет гране-центрированную кубич. решетку (а = 4,0772 Å при 20 °С). Атомный радиус 1,44 Å, ионный радиус Ag + 1,13 Å. Плотность при 20 °С 10,5 г/см 3 ; tпл 960,8 °С; Tкип 2212 °С; теплота плавления 105 кДж/кг (25,1 кал/г). Серебро обладает наивысшими среди металлов удельной электропроводностью 6297 сим/м (62,97 ом -1 ·см -1 ) при 25 °С, теплопроводностью 407,79 Вт/(м·К.) [0,974 кал/(см·°С·сек)] при 18 °С и отражательной способностью 90-99% (при длинах волн 100000-5000 Å). Удельная теплоемкость 234,46 дж/(кг·К) [0,056 кал!(г·°С)], удельное электросопротивление 15,9 ном·м (1,59 мком·см) при 20 °С. Серебро диамагнитно с атомной магнитной восприимчивостью при комнатной температуре -21,56·10 -6 , модуль упругости 76480 Мн/м 2 (7648 кгс/мм 2 ), предел прочности 100 Мн/м 2 (10 кгс/мм 2 ), твердость по Бринеллю 250 Мн/м 2 (25 кгс/мм 2 ). Конфигурация внешних электронов атома Ag 4d 10 5s 1 .
Химические свойства Серебра. Серебро проявляет химические свойства, характерные для элементов Iб подгруппы периодической системы Менделеева. В соединениях обычно одновалентно.
Серебро находится в конце электрохимического ряда напряжений, его нормальный электродный потенциал Ag = Ag + + e — равен 0,7978 в.
При обычной температуре Ag не взаимодействует с О2, N2 и Н2. При действии свободных галогенов и серы на поверхности Серебра образуется защитная пленка малорастворимых галогенидов и сульфида Ag2S (кристаллы серо-черного цвета).
Под влиянием сероводорода H2S, находящегося в атмосфере, на поверхности серебряных изделий образуется Ag2S в виде тонкой пленки, чем объясняется потемнение этих изделий. Сульфид можно получить действием сероводорода на растворимые соли Серебра или на водные суспензии его солей. Растворимость Ag2S в воде 2,48·10 -3 моль/л (25 °С). Известны аналогичные соединения — селенид Ag2Se и теллурид Ag2Te.
Из оксидов Серебра устойчивыми являются оксид (I) Ag2O и оксид (II) AgO. Оксид (I) образуется на поверхности Серебра в виде тонкой пленки в результате адсорбции кислорода, которая увеличивается с повышением температуры и давления.
Ag2O получают действием КОН на раствор AgNO3. Растворимость Ag2O в воде — 0,0174 г/л. Суспензия Ag2O обладает антисептическими свойствами. При 200 °С оксид Серебра (I) разлагается. Водород, оксид углерода (II), многие металлы восстанавливают Ag2O до металлического Ag.
Озон окисляет Ag2O с образованием AgO. При 100 °С AgO разлагается на элементы со взрывом. Серебро растворяется в азотной кислоте при комнатной температуре с образованием AgNO3. Горячая концентрированная серная кислота растворяет Серебро с образованием сульфата Ag2SO4 (растворимость сульфата в воде 0,79% по массе при 20 °С).
В царской водке Серебро не растворяется из-за образования защитной пленки AgCl. В отсутствие окислителей при обычной температуре НCl, HBr, HI не взаимодействуют с Серебром благодаря образованию на поверхности металла защитной пленки малорастворимых галогенидов. Большинство солей Серебра, кроме AgNO3, AgF, AgClO4, обладают малой растворимостью. Серебро образует комплексные соединения, большей частью растворимые в воде. Многие из них имеют практическое значение в химические технологии и аналитической химии, например комплексные ионы [Ag(CN)2] — , [Ag(NH3)2] + , [Ag(SCN)2] — .
Получение Серебра. Большая часть Серебра (около 80%) извлекается попутно из полиметаллических руд, а также из руд золота и меди. При извлечении Серебра из серебряных и золотых руд применяют метод цианирования — растворения Серебра в щелочном растворе цианида натрия при доступе воздуха:
Из полученных растворов комплексных цианидов Серебро выделяют восстановлением цинком или алюминием:
Из медных руд Серебро выплавляют вместе с черновой медью и затем выделяют его из анодного шлама, образующегося при электролитической очистке меди. При переработке свинцово-цинковых руд Серебро концентрируется в сплавах свинца — черновом свинце, из которого его извлекают добавлением металлического цинка, образующего с Серебром нерастворимое в свинце тугоплавкое соединение Ag2Zn3, всплывающее на поверхность свинца в виде легко снимающейся пены.
Далее для отделения Серебра от цинка последний отгоняют при 1250 °С. Извлеченное из медных или свинцово-цинковых руд Серебро сплавляют (сплав Доре) и подвергают электролитической очистке.
Применение Серебра. Серебро используют преимущественно в виде сплавов: из них чеканят монеты, изготовляют бытовые изделия, лабораторную и столовую посуду. Серебро покрывают радиодетали для придания им лучшей электропроводности и коррозионной стойкости; в электротехнической промышленности применяются серебряные контакты.
Для пайки титана и его сплавов используются серебряные припои; в вакуумной технике Серебро служит конструкционным материалом. Металлическое Серебро идет на изготовление электродов для серебряно-цинковых и серебряно-кадмиевых аккумуляторов.
Оно служит катализатором в неорганических и органических синтезе (например, в процессах окисления спиртов в альдегиды и кислоты, а также этилена в окись этилена). В пищевой промышленности применяются серебряные аппараты, в которых приготовляют фруктовые соки. Ионы Серебра в малых концентрациях стерилизуют воду. Соединения Серебра (AgBr, AgCl, AgI) применяются для производства кино- и фотоматериалов.
Серебро в искусстве. Благодаря красивому белому цвету и податливости в обработке Серебро с глубокой древности широко используется в искусстве. Однако чистое Серебро слишком мягко, поэтому при изготовлении монет и различных художественных произведений в него добавляют цветные металлы, чаще всего медь. Средствами обработки Серебра и украшения изделий из него служат чеканка, литье, филигрань, тиснение, применение эмалей, черни, гравировки, золочения.
Высокая культура художественной обработки Серебра характерна для искусства эллинистического мира, Древнего Рима, Древнего Ирана (сосуды эпохи Сасанидов, 3-7 века), средневековой Европы. Разнообразием форм, выразительностью силуэтов, мастерством фигурной и орнаментальной чеканки и литья отличаются изделия из Серебра, созданные мастерами Возрождения и барокко (Б.
Челлини в Италии, ювелиры из семейств Ямницеров, Ленкеров, Ламбрехтов и других в Германии). В 18 — начале 19 вв. ведущая роль в производстве изделий из серебра переходит к Франции (К. Баллен, Т.Жермен, Р. Ж. Огюст и других).
В искусстве 19-20 веков преобладает мода на незолоченое серебро; среди технических приемов доминирующее положение занимает литье, распространяются машинные приемы обработки. В русском искусстве 19 — начала 20 вв. выделяются изделия фирм Грачевых, П. А. Овчинникова, П. Ф. Сазикова, П. К. Фаберже, И. П. Хлебникова. Творческое развитие традиций ювелирного искусства прошлого, стремление наиболее полно выявить декоративные качества Серебра характерны для советских изделий из Серебра, среди которых видное место занимают произведения народных мастеров.
У животных накапливается в некоторых эндокринных железах, пигментной оболочке глаза, в эритроцитах; выводится главным образом с фекалиями. Серебро в организме образует комплексы с белками (глобулинами крови, гемоглобином и других). Блокируя сульфгидрилъные группы, участвующие в формировании активного центра ферментов, Серебро вызывает ингибирование последних, в частности инактивирует аденозинтрифосфатазную активность миозина. При парентеральном введении Серебро фиксируется в зонах воспаления; в крови связывается преимущественно глобулинами сыворотки.
Препараты Серебра обладают антибактериальным, вяжущим и прижигающим действием, что связано с их способностью нарушать ферментные системы микроорганизмов и осаждать белки. В медицинской практике наиболее часто применяют нитрат серебра, колларгол, протаргол (в тех же случаях, что и колларгол); бактерицидную бумагу (пористая бумага, пропитанная нитратом и хлоридом Серебра) применяют при небольших ранах, ссадинах, ожогах и т. п.
Экономическое значение Серебра. Серебро в условиях товарного производства выполняло функцию всеобщего эквивалента наряду с золотом и приобрело, как и последнее, особую потребительную стоимость — стало деньгами. Товарный мир выделил Серебро в качестве денег потому, что оно обладает важными для денежных товаров свойствами: однородностью, делимостью, сохраняемостью, портативностью (высокой стоимостью при небольших объеме и массе), легко поддается обработке.
Первоначально Серебро обращалось в форме слитков. В странах Древнего Востока (Ассирия, Вавилон, Египет), а также в Греции и Риме Серебро было широко распространенным денежным металлом наряду с золотом и медью. В Древнем Риме чеканка монет из Серебра начата в 4-3 веках до нашей эры. Чеканка первых древнерусских монет из Серебра началась в 9-10 веках.
В период раннего средневековья преобладала чеканка золотой монеты. С 16 века в связи с недостатком золота, расширением добычи Серебра в Европе и притоком его из Америки (Перу и Мексики) Серебро стало основным денежным металлом в странах Европы. В эпоху первоначального накопления капитала почти во всех странах существовал серебряный монометаллизм или биметаллизм.
Золотые и серебряные монеты обращались по действительной стоимости содержавшегося в них благородного металла, причем ценностное соотношение между этими металлами складывалось стихийно, под влиянием рыночных факторов. В конце 18 — начале 19 вв. на смену системе параллельной валюты пришла система двойной валюты, при которой государство в законодательном порядке устанавливало обязательное соотношение между золотом и Серебром.
Однако эта система оказалась чрезвычайно неустойчивой, так как в условиях стихийного действия закона стоимости неизбежно возникало несоответствие между рыночными и фиксированными стоимостями золота и Серебра. В конце 19 века стоимость Серебра резко снизилась вследствие совершенствования способов его добычи из полиметаллических руд (в 70-80-е годы 19 века отношение стоимости золота к Серебру составляло 1:15 — 1:16, в начале 20 века уже 1:38 — 1:39).
Рост мировой добычи золота ускорил процесс вытеснения обесценившегося Серебра из обращения. В последней четверти 19 века широкое распространение в мире получил золотой монометаллизм. В большинстве стран мира вытеснение серебряной валюты золотой закончилось в начале 20 века.
Серебряная валюта сохранилась примерно до середины 30-х годов 20 века в ряде стран Востока (Китай, Иран, Афганистан и других). С отходом этих стран от серебряного монометаллизма Серебро окончательно утратило значение валютного металла. В промышленно развитых странах Серебро используется только для чеканки разменной монеты.
Основными потребителями Серебра являются следующие отрасли: производство ювелирных изделий (столового Серебро и анодированных изделий), электротехническая и электронная промышленность, а также кинофотопромышленность.
Источник: sainfo.ru