Получи верный ответ на вопрос «Сколько грамм серебра выпадает в осадок в результате реакции между 8,8 грамм уксусного альдегида и аммиачным раствором оксида серебра . » по предмету Химия, используя встроенную систему поиска. Наша обширная база готовых ответов поможет тебе получить необходимые сведения!
Новые вопросы по химии
1) Вычислить объём углекислого газа, выделившегося при сливании растворов, содержащих 5,3 гр карбоната натрия и 7,3 гр соляной кислоты. 2) Вычислить массовую долю поваренной соли в растворе, приготовленном из 40 гр соли и 160 гр воды.
Рассчитайте массу алюминия, необходимого для получения 130 г хрома из его оксида cr203 алюмотермическим способом
Определить количество оксида железа 3 необходимиго для получения чистого железа количеством 112 г путём алюминотермии и составить дано
Рассчитайте объем водорода, выделившегося при взаимодействии 30 г цинка с 200 мл 20%-ного раствора соляной кислоты
Na-NaOH-Ch3 COONa-Ch4-Co2-Na2 CO3-NaHCo3
Восстановление серебра после электролиза.
Главная » Химия » Сколько грамм серебра выпадает в осадок в результате реакции между 8,8 грамм уксусного альдегида и аммиачным раствором оксида серебра
Источник: 4i5.ru
Серебро выпадает в осадок в результате реакции или нет
Привет Лёва Середнячок

Сколько грамм серебра выпадает в осадок в результате реакции между 8,8 грамм уксусного альдегида и аммиачным раствором оксида серебра
5 (1 оценка)

Marina030672 9 лет назад
Светило науки — 14 ответов — 0 раз оказано помощи
..m (CH3COH) = 8,8 гmпрак (CH3COOH) = 10 г Найти:w(вых CH3COOH)Решение:Найдем теоретическую массу уксусной кислоты: 8,8 г x гCH3COH + Ag2O = CH3COOH + 2Ag↓ 44 г 60 г8,8 г — x г 44 г — 60 гx г = 8,8 г ∙ 60 г 44 г = 12 гРассчитаем выход уксусной кислоты:w(вых) = m(пр) ∙ 100% m(теор)w(вых CH3COOH) = 10 г ∙ 100% 12 г = 83,3% Ответ: w(вых CH3COOH) = 83,3%.
Источник: vashurok.com
Научная электронная библиотека


В данном случае речь идет о наложении друг на друга двух типов равновесий – гетерогенного, устанавливающегося между твердой фазой (осадок) и насыщенным раствором, и гомогенного– между ионами комлексообразователя и добавляемыми в раствор лигандами.
Рассмотрим в качестве примера аммиачный комплекс серебра (I) [Ag(NH3)2] + , диссоциирующий в растворе в соответствии с уравнением:
с константой нестойкости
Химия для чайников. Урок 8. Химические реакции. Выпасть в осадок или запузыриться
.
Если к раствору добавлять хлорид-ионы Cl — , то можно ожидать образования AgCl, который, будучи малорастворимым соединением, должен выпадать в осадок:
и характеризуется произведением растворимости
По мере увеличения концентрации ионов Cl — , равновесие (53) все более смещается вправо, поскольку уменьшается концентрация Ag + за счет его перевода в твердую фазу в виде осадка AgCl(т). Это влечет за собой разрушение комплекса.
С другой стороны, если к осадку AgCl(т) добавлять аммиак, то равновесие (54) будет смещаться влево из-за уменьшения концентрации Ag + , вовлекаемого в комплексный ион, и при достаточной концентрации в растворе NH3 осадок должен полностью исчезнуть, а вместо него в растворе образуется [Ag(NH3)2] + . Данное явление описывается суммарным уравнением
в котором прямое направление соответствует разрушению комплекса с переводом иона – комплексообразователя в осадок, а обратное – растворению осадка за счет комплексообразования.
Полнота протекания прямой реакции качественно характеризуется константой равновесия
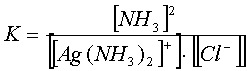
.
Разделим константу нестойкости комплекса Кн на произведение растворимости ПР:
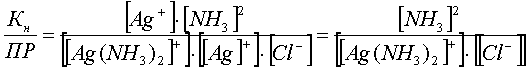
.
Полученное выражение есть не что иное, как константа равновесия рассматриваемой реакции, т.е.
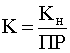
.
Данное соотношение позволяет сделать важный вывод: реакция разрушения комплекса в результате перевода комплексообразователя в осадок протекает тем полнее, чем менее устойчив комплекс (больше Кн) и менее растворим образующийся осадок (меньше ПР). Справедливо также и обратное утверждение.
Разумеется, этот вывод имеет общий характер.
Учитывая, что для рассмотренного примера Кн=10 -7,2 , а ПР=10 -9,7 , имеем
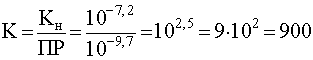
.
Достаточно большое численное значение константы равновесия говорит о том, что реакция (55) в принципе возможна.
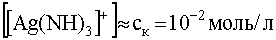
Вычислим минимальную концентрацию иона-осадителя (Cl — ), начиная с которой произойдет разрушение комплекса, т.е. станет преимущественным прямое направление реакции (55). Пусть имеем раствор, исходная концентрация комплекса (ск) в котором равна 10 -2 моль/л. Поскольку рассматриваемый комплекс достаточно устойчив в водном растворе, можно считать, что его равновесная концентрация и исходная весьма близки, т.е. .
Равновесная концентрация свободных (не связанных в комплекс) ионов комплесообразователя может быть вычислена, исходя из выражения для константы нестойкости, в котором [Ag + ] обозначим через х, а [NH3] через 2х, т.е.
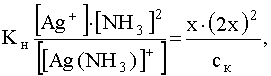
.
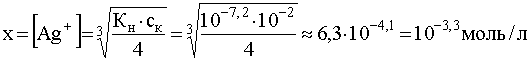
..
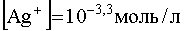
Если теперь к раствору комплекса постепенно добавлять ион-осадитель, то разрушение комплекса начнется с того момента, когда концентрация Cl — станет такой, какая вытекает из произведения растворимости осадка. Учитывая, что , получим:
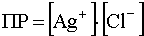 ;
;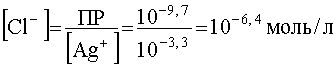 .
.
Такая низкая концентрация иона-осадителя указывает на то, что образование осадка и разрушение комплекса начнется практически сразу, как только в раствор стали добавлять ионы Cl — .
Теперь предположим, что к раствору комплекса, концентрация которого в растворе осталась прежней, добавлен избыток лиганда (NH3), концентрация которого, например, стала равной 1,0 моль/л. В этом случае равновесие (53) будут существенно смещено влево, что вызовет уменьшение концентрации свободных ионов Ag + , которая теперь станет равной:
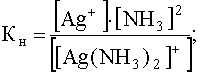
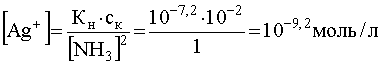 .
.
Тогда минимальная концентрация Cl — , необходимая для того, чтобы началось осаждение AgCl, станет равной
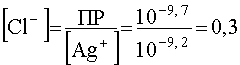
моль/л,
т.е. она сильно возросла вследствие стабилизации комплекса в присутствие избытка лиганда. Отсюда вытекает важный практический вывод: чтобы воспрепятствовать разрушению комплекса под воздействием иона — осадителя, необходимо создать в растворе достаточный избыток лиганда. Эта операция носит название маскировки комплексообразователя.
Рассмотрим обратное явление – растворение осадка в результате комплексообразования.
Пусть имеется осадок хлорида серебра (I) в равновесии с его насыщенным раствором.
Если к этому раствору постепенно добавлять аммиак, то равновесие (55) станет смещаться влево, осадок, по мере добавления лиганда будет растворяться вследствие образования комплекса [Ag(NH3)2] + . Пусть в результате полного растворения осадка концентрация комплекса в растворе стала равной 10 -2 моль/л. Нетрудно рассчитать ту минимальную концентрацию лиганда, которую для этого нужно создать в растворе.
Как следует из уравнения (55), концентрации [Ag(NH3)2] + и [Cl — ] при условии полного растворения AgCl, одинаковы и равны 10 -2 моль/л. При этом, как следует из выражения для ПР,
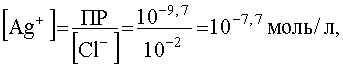
.
а из выражения Кн получим:
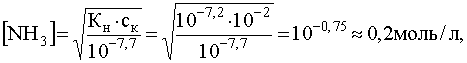
.
т.е. полное растворение осадка AgCl произойдет тогда, когда концентрация лиганда достигнет значения приблизительно 0,2моль/л.
Очевидно, что, чем меньше растворимость осадка, т.е. чем меньше его ПР, тем труднее этот осадок растворить, т.е. для этого потребуется более значительная концентрация добавляемого в раствор лиганда. Так, бромид серебра (I) менее растворим, чем хлорид:
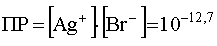
.
Аналогичный предыдущему расчет показывает, что для полного растворения AgBr добавлением NH3 минимальная концентрация последнего должна достигнуть значения 10 1,5 =31,6 моль/л, что практически недостижимо.
Источник: monographies.ru