Для разбавленных растворов , тогда уравнение Нернста примет вид:
Электроды в зависимости от того относительно какого иона они обратимы делятся на два класса – электроды первого и второго родов, иначе называемые индикаторными электродами, поскольку их потенциал однозначно зависит от концентрации определенного вида ионов в растворе.
1)Электроды I рода – представляет собой металл, погруженный в раствор, содержащий ионы этого же металла. Электроды I рода обратимы относительно катионов. Записываются как
На электроде протекает реакция
Потенциал электрода зависит от активности катиона:
Пример: серебряный электрод (Ag | Ag + );
медный электрод (Cu | Cu 2+ );
водородный электрод (Pt, H2 | H + ).
2) Электроды II рода – представляют собой металл, покрытый слоем малорастворимой соли и погруженный в раствор, насыщенный этой солью и содержащий другую легкорастворимую соль с тем же анионом. Обратимы относительно анионов. Записывается как
На электроде протекает реакция:
Тавровое соединение. Козыряние электрода. Поиск причин…
Потенциал электрода зависит от активности аниона:
Пример: каломельный и хлорсеребряный электроды.
Рассмотрим другие типы электродов.
Электрод сравнения – это электрод, у которого точно известен электродный потенциал. С электродами сравнения сравнивают другие электроды, чем потенциала необходимо установить.
Электроды сравнения бывают следующими:
I. Стандартный водородный (газовый) электрод – является основным электродом сравнения.
Представляет собой платинированную платиновую пластинку погруженную в водный раствор HCl или серной кислоты H2SO4. Через раствор проникает ток чистого Н2 под постоянным давлением. Записывается как
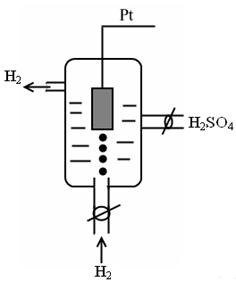
Pt, H2 | H + , aq;
а) если давление Н2 равно 1 атм., а активность раствора равна 1, то это стандартный водородный электрод для которого условно считают что .
p = 1 атм. а Н + = 1
б) если , , то это нестандартный водородный электрод, .
p ≠ 1 атм. а Н + ≠ 1
На электроде протекает следующая обратимая электрохимическая реакция:
Выведем уравнение для электродного потенциала нестандартного водородного электрода (или называется газовый электрод).
Для этого составляем элемент, у которого слева стандартный водородный электрод с , а справа обычный водородный электрод с потенциалом . Тогда э.д.с. этого элемента равна:
Изменение энергии Гиббса равно:
где ; (в газообразном состоянии)
Потенциал водородного электрода уменьшается с повышением давления Н2 на электроде. Водородный электрод обратим относительно катиона.
II. Каломельный электрод: более простое устройство, служит вспомогательным электродом сравнения, его потенциал точно известен относительно стандартного электрода.
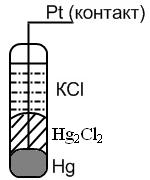
Представляет собой ртутный электрод, покрытый труднорастворимой солью Hg2Cl2 – каломелью и погруженный в раствор, насыщенный этой же солью (каломелью) и содержащий другую легкорастворимую соль с тем же анионом хлорид калия KСl.
Электрод НЕВИДИМКА…! Обматал электроды разной проволокой И ПРОВАРИЛ.
На электроде протекает реакция:
Пользуясь уравнением Нернста, запишем электродный потенциал:
Поскольку раствор насыщен труднорастворимой камелью, то произведение активностей ионов будет постоянно:
Потенциал электрода зависит от активности Cl — (т. е. она задается концентрацией соли КСl, т. к. концентрация каломели постоянна, поскольку ею насыщенный раствор). Если используется 1 н раствор КСl – нормальный каломельный электрод, если 0,1 н – децинормальный, если насыщенный раствор КСl, то насыщенный каломельный электрод.
Каломельный электрод обратим относительно аниона.
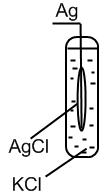
III. Хлорсеребряный электрод – также используется в качестве электрода сравнения.
Представляет собой серебряный электрод, покрытый малорастворимой солью AgCl и погруженный в раствор, насыщенный этой солью и содержащий другую легкорастворимую соль с тем же анионом КСl.
Ag, AgCl (т) | Cl — , aq;
На электроде протекает реакция:
Уравнение для электродного потенциала равно:
Хлорсеребряный электрод обратим относительно аниона Сl — .
Рассмотрим другой тип электродов, у которых электрохимические реакции получения или отдачи электронов не связаны с окислением или восстановлением электродов (из электролита выделяется вещество и восстанавливает электрод). В таких электродах электрохимические реакции связаны с изменением валентности ионов в растворе. Электрод обменивается с электролитом не ионами, а электронами. Это так называемые окислительно-восстановительные электроды.
Окислительно-восстановительные электроды представляют собой инертный металл, погруженный в раствор, который содержит окислительную и восстановительную форму металла. Инертный металл обменивается с раствором электролита не ионами, а электронами.
На электроде протекает реакция:
Потенциал окислительно-восстановительного электрода зависит от активностей окислительной и восстановительной формы ионов:
Потенциал окислительно-восстановительного электрода называется окислительно-восстановительным или редокспотенциалом.
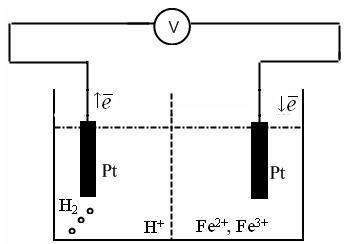
Пример: для определения окислительно-восстановительного потенциала составим следующий электрохимический элемент – слева стандартный водородный электрод, а справа окислительно-восстановительный электрод – платина, опущенная в раствор, содержащий FeCl2 и FeCl3.
(-) Pt, H2 | H + || Fe 2+ , Fe 3+ | Pt (+)
Атомы платины не участвуют в электродном процессе, а служат лишь переносчиками электронов. От платинового электрода электроны переходят к ионам Fe 3+ и восстанавливают их до Fe 2+ .
В элементе протекают следующие электрохимические реакции:
Поскольку Е 0 =0 на катоде, то для расчета будем учитывать реакцию только на аноде.
Окислительно-восстановительные электроды могут быть составлены и на основе органических окислительно-восстановительных систем. Особый интерес представляет хингидронный электрод.
Хингидронный электрод – это платиновый электрод, погруженный в раствор хингидрона (насыщенный раствор с кристалликами хингидрона):
Органическое соединение хингидрон – это труднорастворимое в воде соединение хинона и гидрохинона с водородной связью.
| [C6H4O2 ∙ C6H4(OH)2] |
В растворе хингидрон частично распадается (т. е. диссоциирует) на хинон и гидрохинон
Для определения электродного потенциала хингидронного электрода составим следующий гальванический элемент:
в растворе есть Н + , т. к.
гидрохинон слабая кислота способная
диссоциировать с образованием Н +
Рассмотрим Ех, г для правого электрода. Согласно уравнению Нернста для Е будем иметь следующее:
В насыщенном растворе хингидрона соотношение постоянно, а значит и . Тогда
Потенциал хингидронного электрода зависит от в растворителе и от Т. Хингидронный электрод нельзя использовать в щелочных растворах, так как гидрохинон, как слабая кислота, будет сильно диссоциировать на ионы и его концентрация будет непостоянной (то есть не будет соблюдаться соотношение ).
Источник: studopedia.su
Хлорсеребряный электрод (ХСЭ)


Применяют в качестве электрода сравнения и вспомогательного электрода в составе электрохимической ячейки вольтамперометрического анализатора. ХСЭ сравнения предназначен для создания опорного потенциала при работе в паре с рабочим (индикаторным) электродом. Представляет собой спираль из серебряной проволоки, покрытой хлоридом серебра и помещенной в полипропиленовый корпус с полупроницаемой пробкой из оксида алюминия. Перед применением корпус электрода заполняют раствором хлорида калия концентрации 1 моль/л. ХСЭ используют в соответствии с применяемой методикой измерений в качестве электрода сравнения, вспомогательного электрода или применяют при модифицировании поверхности рабочего электрода.
ХСЭ входит в комплектацию вольтамперометрических анализаторов ТА-Lab, ПАН-As, ТА-4, анализатора ТА-Универсал и является заменяемым на протяжении всего срока службы данных анализаторов.
Корпус ХСЭ
Сменный корпус хлорсеребряного электрода. Корпус ХСЭ представляет собой полипропиленовую трубку с полупроницаемой мембраной из оксида алюминия. Предназначен для замены корпуса ХСЭ в случае загрязнения мембраны.
Хлорсеребряный электрод для анализатора ТА-2
ХСЭ применяют в качестве электрода сравнения и вспомогательного электрода в составе электрохимической ячейки вольтамперометрических анализаторов ТА-1 и ТА-2.
ХСЭ представляет собой спираль из серебряной проволоки, покрытой хлоридом серебра и помещенной в полипропиленовый корпус с полупроницаемой пробкой из оксида алюминия. Перед применением корпус электрода заполняют раствором хлорида калия концентрации 1 моль/л. Хлорсеребряный электрод используют в соответствии с применяемой методикой измерений в качестве электрода сравнения, вспомогательного электрода или применяют при модифицировании поверхности рабочего электрода.
Количество ХСЭ в комплекте поставки оговаривается потребителем на стадии приобретения и определяется методикой измерений, в соответствии с которой планируется использовать ХСЭ. Дополнительно в комплект поставки может входить запасной корпус ХСЭ, который используют в случае загрязнения пробки в процессе эксплуатации электрода.
Амальгамный электрод
Применяют в качестве рабочего (индикаторного) электрода при проведении измерений содержания кадмия, свинца, цинка, меди, марганца, никеля, кобальта, сурьмы, висмута. Рабочая поверхность электрода представляет собой амальгаму серебра, нанесенную на серебряную подложку. Амальгамный электрод является альтернативой ртутно-пленочным электродам, широко применяемым для проведения измерений вольтамперометрическими методами.
Для увеличения безопасности работы с амальгамными электродами:
- установка и выемка электродов из анализатора проводится с помощью специальных защитных колпачков;
- анализатор вольтамперометрический имеет двойную защиту ячеек: каждая ячейка анализатора закрывается индивидуально, и все три ячейки закрываются общей крышкой.
Амальгамный электрод входит в комплектацию вольтамперометрических анализаторов ТА-Lab, ТА-4, анализатора ТА-Универсал и является заменяемым на протяжении всего срока службы данных анализаторов. Рекомендуется заменять АмЭ на новый не реже одного раза в год.
Серебряный электрод модифицированный
Представляет собой серебряный электрод, поверхность которого покрыта твердым раствором ртути в серебре. Электрод является альтернативой ртутно-пленочным электродам при определении йода, селена, кадмия и свинца. Применяется в качестве рабочего электрода для определения содержания йода, кадмия, свинца и селена.
Серебряный электрод модифицированный (СЭМ) представляет собой полимерный стержень с запрессованной серебряной проволокой, покрытой твердым раствором ртути в серебре. Перед применением поверхность электрода дополнительно не обрабатывают, поэтому электрод прост и удобен в применении.
Серебряный электрод модифицированный входит в комплектацию вольтамперометрических анализаторов ТА-Lab, ТА-4, анализатора ТА-Универсал и является заменяемым на протяжении всего срока службы данных анализаторов. Рекомендуется заменять СЭМ на новый не реже 1 раза в год.
Углеродсодержащий электрод
Углеродсодержащий электрод может быть использован как аналог графитового электрода, углеродсодержащий электрод, модифицированный золотом — как аналог золото-графитового и золотого электродов.
Путем модифицирования поверхности электрода получают микроэлектродные ансамбли, отличающиеся высокими чувствительностью и стабильностью работы. Наиболее часто используют углеродсодержащий электрод, на поверхность которого нанесено золото – золотоуглеродсодержащий электрод.
Для образования золотоуглеродсодержащего электрода рабочую поверхность электрода модифицируют золотом путем электролиза раствора золотохлористоводородной кислоты. Периодичность нанесения золота на поверхность углеродсодержащего электрода зависит от условий его использования и от количества анализируемых проб. Как правило, повторное нанесение золота проводят не чаще, чем после анализа 100 проб.
Ртутно-пленочный электрод для анализатора ТА-2
Применяют в качестве рабочего (индикаторного) электрода при определении кадмия, свинца, цинка, меди, марганца, никеля, кобальта, сурьмы, висмута. Рабочая поверхность электрода представляет собой серебряный стержень, на поверхности которого формируют амальгаму серебра путем нанесения тонкого слоя ртути.
Ртутно-пленочный электрод (РПЭ) представляет собой полимерный стержень с запрессованным серебряным стержнем меньшего диаметра. Для приведения в рабочее состояние в день проведения измерений на поверхности серебряного стержня формируют амальгаму серебра путем нанесения тонкого слоя ртути. Нанесение ртути проводят электролизом раствора нитрата одновалентной ртути в электрохимической ячейке анализатора.
РПЭ входит в комплектацию вольтамперометрических анализаторов ТА-1 и ТА-2 и является заменяемым на протяжении всего срока службы данных анализаторов. Для получения стабильных результатов измерений рекомендуется заменять ртутно-пленочный электрод на новый не реже 1 раза в год.
Углеродсодержащий электрод для анализатора ТА-2
Углеродсодержащий электрод для вольтамперометирческих анализаторов ТА-1 и ТА-2.
Углеродсодержащий электрод состоит из полиэтиленового корпуса, который заполнен электропроводящей смесью полиэтилена с техническим углеродом, и является твердым композитным электродом. Путем модифицирования поверхности электрода получают микроэлектродные ансамбли, отличающиеся высокими чувствительностью и стабильностью работы. Рабочую поверхность электрода модифицируют Au, Hg или Ag предварительно или “in situ”. Регенерация рабочей поверхности электрода осуществляется путем срезания тонкого слоя (0,1-0,3 мм) специальным резаком. Применяется для определения содержания элементов, потенциал растворения которых лежит как в отрицательной, так и в положительной областях.
- Главная
- О компании
- Отправить заявку
- Прайс-листы
- Условия работы
- Наши клиенты
- Вакансии
- Контактная информация
Источник: analitlab.ru
3 Электроды в потенциометрии
Поскольку измерить непосредственно потенциал отдельного электрода невозможно, то используют метод, основанный на сравнении величин потенциалов двух электродов. С этой целью образуют электрохимическую ячейку с электродами, погруженными в соответствующий раствор. Каждый электрод имеет свой собственный, характерный для данных условий потенциал.
При этом потенциал одного электрода зависит от концентрации определяемых ионов и должен изменяться в соответствии с уравнением Нернста (обратимость электрода). Такой электрод, обладающий обратимостью, называют индикаторным или рабочим. Индикаторные электроды могут быть изготовлены из различных материалов и иметь различную форму и размер в зависимости от назначения электрода.
Второй электрод, относительно которого измеряют потенциал индикаторного электрода, называют электродом сравнения или стандартным электродом, который должен иметь постоянный потенциал в условиях измерения.
3.1 Индикаторные электроды
Индикаторные электроды могут быть условно отнесены к двум группам: электронообменные и ионообменные электроды.
3.1.1 Электронообменные электроды
Электронообменные (металлические) — это электроды, на межфазных границах которых протекают реакции с участием электронов. В зависимости от электрохимических реакций, протекающих на электродах, различают электроды I, II, III рода и окислительно-восстановительные.
Электроды I-го рода — это металлические электроды, потенциал которых определяется концентрацией собственных ионов в растворе. При погружении электрода в раствор возникновение электродного потенциала связано с электрохимическим процессом (электродной гетерогенной реакцией), который заключается в переносе заряженной частицы (электрона, иона) через границу раздела двух соприкасающихся электропроводящих фаз металл — раствор. Перенос имеет место при погружении, например, металлического электрода в раствор, содержащий ионы этого же металла:
Ме 0 ↔ Ме n + + ne (6)
Систему (редокс-пару) обозначают металл|катион или Ме|Ме n + (знак | означает границу раздела твердое тело – раствор. На величине потенциала не сказывается концентрация анионов.
К электродам I рода относится, например, серебряный электрод, находящийся в растворе, содержащем ионы серебра. Потенциал электродов I рода определяется уравнением:

(7)
где Е — потенциал металлического электрода при данной концентрации ионов
металла в растворе
Е 0 — потенциал этого же электрода в растворе с концентрацией ионов
равной единице — нормальный электродный потенциал
[Ме n + ] — равновесная концентрация ионов металла
Так, при погружении пластинки серебра в раствор его растворимой соли образуется окислительно-восстановительная система, где Ag + + e ↔ Ag и равновесный потенциал для которой определяется уравнением:
EAg+/Ag = E 0 Ag+/Ag + 0.058 . lg . [Ag + ] (8)
По измеренному потенциалу электрода можно рассчитать концентрацию ионов серебра в растворе. Металлические электроды, подобные серебряному, потенциалы, которых обратимы относительно собственных ионов в растворе, используют в качестве индикаторных при определении концентрации ионов металла.
Электродами II-го рода – это металлы, покрытые малорастворимой солью этого же металла и погруженные в раствор хорошо растворимого соединения с тем же анионом. Такие электроды обратимы относительно соответствующего аниона. На поверхности электродов II рода протекает реакция образования анионов и металла из малорастворимой соли или обратная ей. Типичными представителями электродов II рода являются хлорсеребряный и каломельный электроды.
Хлорсеребрянный электрод состоит, например, из серебряной проволоки, электролитически покрытой слоем хлорида серебра, и погруженной в раствор хлорида калия — Ag|AgClтв|Cl — . В системе протекает реакция по схеме:
Потенциал этого электрода зависит от концентрации ионов хлора и определяется уравнением Нернста:

(10)
С изменением концентрации ионов хлора изменяется потенциал хлорсеребряного электрода (10). Таким образом, этот электрод может быть использован для определения [Cl — ] в качестве индикаторного электрода. Кроме того, из произведения растворимости ПР = [Ag + ] . [Cl — ] можно найти концентрацию ионов серебра, зная концентрацию ионов хлора, определяя ее по уравнению (10). Поэтому хлорсеребряный электрод можно использовать и как индикаторный при определении ионов серебра [Ag + ].
Каломельный электрод представляет собой платиновую проволоку, погруженную в слой ртути, контактирующую с пастой из металлической ртути и каломели (Hg2Cl2) Потенциал каломельного электрода Pt|Hg|Hg2Cl2|Cl — определяется реакцией 2Hg + 2Cl — ↔ Hg2Cl2тв. + 2e, и рассчитывается при E 0 =0,244 В по уравнению Нернста:

(11)
Поскольку концентрации веществ, находящихся в твердой фазе, постоянны, тогда уравнение примет вид:

(12)
Из этого уравнения следует, что потенциал каломельного электрода обратимо зависит только от концентрации ионов хлора в растворе.
Каломельные электроды с концентрацией хлорида калия 0,1 М, 1М используют как индикаторные электроды. Если раствор является насыщенным по хлориду калия (см. 3.3), то каломельный электрод используют как электрод сравнения – насыщенный каломельный электрод. В этом случае, его потенциал не зависит от концентрации ионов хлора в растворе, находящихся в избытке.
К электродам II рода относятся металл-оксидные электроды (сурьмяные, свинцовые, вольфрамовые, титановые и висмутовые и др.). Металл-оксидный электрод — это металл, покрытый слоем оксида металла. Потенциал такого электрода зависит от рН раствора, т.е. концентрации ионов водорода.
Из металл-оксидных электродов чаще всего применяют сурьмяный электрод изготовленный из металлической сурьмы, покрытой слоем оксида сурьмы, образующегося в процессе окисления кислородом воздуха. При погружении сурьмяного электрода в раствор на его поверхности протекает реакция:
Электродный потенциал реакции (13) определяется следующим уравнением:

(14)
Такой электрод может быть использован в качестве индикаторного для определения ионов водорода.
Электроды III-го рода — это металл (Ме1), покрытый малорастворимой солью этого же металла (Ме1Х1) и погруженный в раствор, который содержит малорастворимую соль другого металла (Ме2) с тем же анионом и хорошо растворимую соль этого металла (Ме2Х2). У такого электрода концентрация аниона точно определяется из произведения растворимости (ПР) второй соли и концентрации ее катиона. Но так как ионы металла электрода находятся в равновесии с катионами другого металла, то потенциал таких электродов III-го рода зависит от концентрации ионов второго металла.
В общем виде потенциал электрода III рода для системы Ме1|Ме1Х1|Ме2Х1|Ме2 определяется следующими уравнениями:

(15)
Рассчитав отношение произведений растворимости солей и концентрацию Ме1 — (18, 19), получают зависимость величины потенциала электрода III рода от концентрации определяемых ионов металла (Ме2) (20, 21).

(18)

(19)

(20)

(21)
Например, для измерения концентрации кальция и меди в растворе можно использовать следующие электроды III рода, соответственно:
Электроды III рода применяют как индикаторные для определения концентрации катионов, чужеродных по отношению к металлу электрода.
Окислительно-восстановительные электроды (редокс-электроды) — это инертные металлические электроды, обратимые по окисленной и восстановленной формам какого-либо вещества. Обычно, редокс-электрод — инертный электронный проводник (например, Pt, Pd, Au, Ni, W, угольный), погруженный в раствор, содержащий редокс- пару какого-либо элемента, например, Fe 3+ |Fe 2+ , Cr2O7 2- |2Cr 3+ , MnO 4- |Mn 2+ и др. В таких случаях нет равновесия между металлом электрода и ионами этого металла в растворе. При любом окислительно-восстановительном процессе подобный инертный индикаторный электрод служит только проводником электронов, и приобретает больший или меньший потенциал в зависимости от изменения соотношения окисленной и восстановленной форм элемента в соответствии с уравнением Нернста (4).
Так, если платиновую пластинку погрузить в раствор, содержащий сульфат железа (II) и сульфат железа (III), то в этой системе ионы Fe 2+ будут отдавать электроны такому редокс-электроду:
Fe 2+ — е → Fe 3+ (22)
Ионы Fe 3+ будут принимать электроны от редокс- электрода:
Fe 3+ + e → Fe 2+ (23)
Таким образом, на электроде устанавливается равновесие:
Fe 3+ + е ↔ Fe 2+ (24)
Сам инертный материал электрода (например, платина) в такой равновесной системе принимает лишь косвенное участие — служит проводником электронов.
Особым видом окислительно-восстановительных электродов, являются газовые электроды, в которых одним из активных веществ является газ. Пример такого газового электрода — водородный электрод (см. 3.3).
Требования к электроннообменным (металлическим) индикаторным электродам зависят от их назначения и использования: в потенциометрическом исследовании или в потенциометрическом титровании.
Индикаторные электроды должны быть обратимы по потенциалу, т.е. их потенциал должен меняться с изменением концентрации потенциалопределяющих ионов в растворе. Однако, свойство обратимости присуще не всем электроннообменным (металлическим) электродам. Например, потенциал алюминиевого электрода необратим по отношению к ионам алюминия, так как поверхность этого электрода покрыта образующейся пленкой оксида алюминия. По этой же причине лучше не использовать для потенциометрического титрования собственных ионов электроды из железа, молибдена, вольфрама, тантала, ниобия, сурьмы и некоторых других металлов.
Металлические индикаторные электроды должны быть химически индифферентны (инертны) по отношению к веществам, находящимся в анализируемом растворе. Некоторые индикаторные электроды не будут пригодны для потенциометрического анализа кислых и щелочных сред, если материал электрода может растворяться в кислоте или в щелочи.
Не следует использовать индикаторные электроды I рода в растворах, содержащих катионы более электроположительных металлов по отношению к металлу электрода. В таком случае, катионы из раствора будут выделяться на электроактивном, более электроотрицательном металле. Например, цинковый электрод не пригоден как индикаторный в растворе, содержащем ионы меди. Медь будет выделяться на электроде по реакции:
Cu 2+ + Zn ↔ Cu + Zn 2+
При потенциометрическом титровании надо использовать только такие индикаторные электроды, равновесный потенциал которых устанавливается быстро, иначе утрачивается одно из основных преимуществ потенциометрического титрования, а именно, быстрота определения. Так как равновесие, например, на висмутовом, свинцовом, медном электродах в растворах их солей устанавливается медленно, то такие электроды не применяют для потенциометрического титрования. Однако медленное установление равновесия не препятствует применению указанных металлических электродов в качестве индикаторных в прямой потенциометрии.
Электроды из сплава металла со ртутью (из амальгамы) – амальгамные (электроды I рода) — имеют дополнительное преимущество по сравнению с электродами из одного металла. Растворенный в ртути металл почти не реагирует с кислотами, т.е. затруднено выделение водорода на амальгаме и окисление (растворение) металла электрода. Равновесие между амальгамным электродом и раствором устанавливается достаточно быстро. Благодаря этому, амальгамные электроды применяют чаще в качестве индикаторных электродов в потенциометрическом анализе, чем просто металлические электроды.
Источник: studfile.net