· ионоселективные электроды, представляющие собой мембраны, на поверхности которых происходит скачок потенциала.
К электродам с активным электродным материалом относятся электроды 1-го и 2-го рода, а к электродам с инертным электродным материалом относятся простые и сложные окислительно-восстановительные электроды, или редокс-электроды, и газовые электроды.
Из ионоселективных электродов важнейшим является стеклянный электрод.
Электроды 1-го рода
Электрод первого рода состоит из активного металла, погруженного в ненасыщенный раствор соли этого металла.
Обозначим металл M, а катионы, образующиеся при растворении его соли, — M z + .
С учетом этих обозначений электродную реакцию можно записать следующим образом:
Условная запись электрода принимает следующий вид:
Уравнение для электродного потенциала записывается так:
К электродам 1-го рода относятся медный электрод Cu 2+ ôCu, цинковый электрод Zn 2+ ôZn, серебряный электрод Ag + ôAg и др.
Классификация электродов 1
Эту группу электродов объединяет то, что их потенциал зависит от активности катиона. Название этой группы — электроды, обратимые по катиону.
Однако к числу электродов 1-го рода относится немногочисленная группа электродов, потенциал которых определяется активностью аниона (их называют электродами, обратимыми по аниону). Наиболее изученными из них являются селеновый электрод и теллуровый электрод, который характеризуется следующим:
Электроды 2-го рода
Электроды 2-го рода содержат металл и труднорастворимое соединение этого металла, контактирующие с раствором, содержащим анионы, входящие в состав труднорастворимого соединения.
В зависимости от типа труднорастворимого соединения металла различают металлогалогенидные электроды, содержащие труднорастворимые галогениды металлов, металлосульфатные, содержащие труднорастворимые сульфаты металлов, и др.
Общая запись электродной реакции для электродов 2-го рода такова:
Приведенная выше запись результирующей электродной реакции соответствует двум ее основным стадиям:
· растворению труднорастворимой соли
· восстановлению ионов металла на катоде
Таким образом, по механизму катодного процесса электроды 2-го рода принципиально не отличаются от электродов 1-го рода.
Отвечающая суммарной реакции (а) условная запись электрода 2-го рода имеет следующий вид:
Этой же реакции соответствует выражение для электродного потенциала:
Потенциал электродов 2-го рода зависит от активности анионов. Поэтому их часто называют электродами, обратимыми по анионам.
Электроды 2-го рода широко применяются при проведении электрохимических измерений. Кроме того, данные по их стандартным электродным потенциалам используются для расчета произведения растворимости PS труднорастворимых солей. С этой целью сравнивают стандартный потенциал электрода 2-го рода со стандартным потенциалом электрода 1-го рода с соответствующим металлом . Так как в системе, содержащей труднорастворимую соль MxAz, устанавливается равновесие
Лекция 64 Классификация электродов Электрод первого рода
M x Az = xM z + + zA x — ,
характеризуемое константой равновесия
то стандартным условиям для электрода 2-го рода () отвечает активность ионов металла, равная . Таким образом, выполняется условие:
из которого следует:
Изучение наиболее известных электродов 2-го рода начнем с класса металлогалогенидных, из которых наиболее распространена группа металлохлоридных электродов.
Каломельный электрод. Его название дано по труднорастворимому хлориду ртути (I) — каломели Hg2Cl2.
Каломельный электрод характеризуют:
· выражение для электродного потенциала:
Для изготовления каломельного электрода каломель перетирают с раствором хлорида калия и несколькими каплями ртути до получения однородной пасты, которую наслаивают на поверхность ртути, помещаемой в стеклянную емкость. Сверху на пасту наслаивают раствор хлорида калия. Металлический контакт осуществляют платиновой проволокой, которую впаивают в стекло (платина и лабораторное стекло имеют близкие значения термического коэффициента расширения).
Каломельный электрод отличается прекрасной воспроизводимостью электродного потенциала и очень высокой устойчивостью. Известно, что при хранении свыше 25 лет каломельного электрода не было замечено никакого изменения его электродного потенциала. В связи с этим он широко применялся в качестве практического электрода сравнения. Было предложено использовать следующие типы каломельного электрода:
· децинормальный каломельный электрод, заполняемый 0,1 н. раствором KCl (электродный потенциал такого электрода по отношению к стандартному электроду сравнения при 25°С равен 0,3365 В),
· нормальный каломельный электрод, заполняемый 1 н. раствором KCl (его электродный потенциал по отношению к стандартному электроду сравнения при 25°С равен 0,2828 В),
· насыщенный каломельный электрод, заполняемый насыщенным раствором KCl (потенциал при 25°С равен 0,2438 В).
Наиболее употребительным является насыщенный каломельный электрод. Однако по сравнению с другими типами каломельных электродов у него наибольшая зависимость электродного потенциала от температуры.
Трудности миниатюризации каломельного электрода и работа с ртутью привели к тому, что он повсеместно заменялся серебряногалогенидными электродами.
Серебрянохлоридный электрод является наиболее распространенным представителем группы серебряногалогенидных электродов.
Приводим электродную реакцию, условную запись и выражение для электродного потенциала серебрянохлоридного электрода:
AgCl + e = Ag + Cl — ,
Серебрянохлоридный электрод подобно каломельному электроду имеет хорошую воспроизводимость и устойчивость электродного потенциала. Он широко применяется в качестве практического электрода сравнения (иногда такие электроды называют вспомогательными) не только в водных средах, но и в водных растворах спиртов, кетонов и эфиров.
Для получения серебрянохлоридного электрода тонкую серебряную проволоку покрывают слоем хлорида серебра. С этой целью ее погружают в водный раствор, содержащий хлорид-ионы, и пропускают электрический ток, используя серебряную проволоку в качестве анода. Погруженная в раствор KCl серебряная проволока с электролитическим покрытием AgCl представляет собой готовый электрод сравнения.
Миниатюрные серебрянохлоридные электроды используются в физиологических и биохимических исследованиях.
Ртутносульфатный электрод является представителем группы металлосульфатных электродов с наиболее устойчивым электродным потенциалом и наиболее высокой воспроизводимостью.
Характеристики этого электрода приводятся ниже:
Металлооксидные электроды. В этих электродах анионом, содержащимся в водной среде, служит гидроксид-ион. Частную реакцию на этих электродах можно представить как двухстадийный процесс:
Электродной реакции соответствует следующая форма условной записи электрода:
Выражение для электродного потенциала металлооксидного электрода имеет следующий вид:
Оно может быть преобразовано с использованием ионного произведения воды
и принимая во внимание, что десятичный логарифм активности водородных ионов представляет собой водородный показатель среды pH, получим
Входящий в уравнение коэффициент b называется электрохимическим коэффициентом. При 25°С он равен 0,059157 В.
Линейная зависимость между водородным показателем среды и потенциалом металлооксидного электрода предполагает его применение для измерений рН. Такая возможность действительно существует. Однако в кислой среде происходит растворение оксидов и электрод перестает функционировать как рН-метрический.
Примерами металлооксидных электродов могут служить ртутнооксидный и сурьмянооксидный электроды.
Ртутнооксидный электрод характеризуется следующим:
HgO + H2O + 2e = Hg + 2OH — ,
а сурьмянооксидный электрод может быть описан электродной реакцией и условной записью в таком виде:
Для изготовления сурьмянооксидного электрода достаточно заполнить стеклянную трубку расплавленной сурьмой и окислить выступающую поверхность сурьмы нагреванием на воздухе.
Электроды на основе металлических сплавов и растворов. Они представляют собой разновидность электродов 1-го и 2-го рода, в которых вместо чистого металла в кристаллической форме используются металлические сплавы или растворы. Многие металлы хорошо растворяются в ртути с образованием амальгамы. В качестве примера амальгамного электрода можно привести кадмиевый амальгамный электрод:
Cd 2+ + 2e = Cd (Hg),
Обращаем внимание на то, что потенциал металла входит в выражение для электродного потенциала, так как в отличие от обычных электродов 1-го и 2-го рода металл не находится в стандартном состоянии.
Источник: cyberpedia.su
Электроды 1 рода
Окислительно-восстановительный процесс можно
провести электрохимически в электроде. Например,
случай электрода 1 рода, когда металл погружён в
водный раствор собственной соли:
Zn|ZnSO4 – цинковый электрод,
Cu|CuSO4 – медный электрод,
Ag|AgNO3 – серебряный и др. Потенциал такого
электрода зависит от концентрации катионов металла,
–это электрод, обратимый по отношению к катиону:
εAg = εoAg + 0,059 lgCAg+.
2. Электроды 2 рода
Усложним конструкцию, введем в систему на границу фаз серебро –
раствор труднорастворимую соль серебра, тогда получится
электрод, обратимый как к катиону, так и к аниону – электрод 2
рода, хлорсеребряный:
Ag|AgCI + KCI.
На серебряный пруток нанесен слой хлористого серебра и этот
пруток помещается в раствор электролита — хлористого калия. В
этом случае концентрации ионов серебра и хлора связаны
величиной произведения растворимости ПРAgCI :
ПРAgCI = C Ag+ • CCI─ , отсюда C Ag+ = ПРAgCI/ CCI─.
εAgCI = εoAg + 0,059 lg ПРAgCI ─ 0,059lg CCI─ = εoAgCI ─ 0,059lg CCI─.
Потенциал такого электрода зависит от концентраций катиона и
аниона. Другим примером является каломельный электрод
(каломель – Hg2CI2): Hg| Hg2CI2 + KCI.
3. Газовые электроды
В систему вместо труднорастворимого вещества
можно ввести газ, тогда получатся так
называемые газовые электроды. Так, реакцию
восстановления кислорода, растворенного в
воде:
O2 + 2H2O + 4e 4OH─
можно провести в кислородном электроде. Для
этого нужен раствор, содержащий ионы
гидроксила (NaOH) и инертный металл (Pt).
Газоообразный кислород подают на
поверхность платины.
4. Кислородный электрод
5. Хлорный электрод
Если на такую платиновую пластину, погруженную в
раствор соляной кислоты, подавать газообразный хлор,
получится хлорный электрод:
(СI2)Pt|HCI.
На нем протекает реакция:
CI2 + 2e 2CI─.
Для улучшения адсорбции газов на платине ее
поверхность покрывают слоем губчатой, аморфной
платины, так называемой «платиновой чернью».
6. Электроды сравнения (водородный)
(H2)Pt|H2SO4
На платине устанавливается равновесие:
H2 ─ 2e 2H+
εoH + 0,059 lg CH+/PH2
ε =
ε = εo ≡ 0 при C H+ = 1 моль/л и Р H2 = 1 атм.
Ag|AgCI + KCI – хлорсеребряный электрод,
εo = 0,21В
H2
H2
H2
2
7. Red-ox электроды
(+) Pt | Fe3+ Fe3+ + e Fe2+
(─) Pt | Sn2+ Sn4+ + 2e Sn2+
Cr 3+ + e Cr 2+
εo = ─ 0,41в
Cu 2+ + e Cu+
εo = ─ 0,17в
Sn4+ + 2e Sn2+
εo = + 0,15в
Cr2O72─ + 14H+ + 6e 2 Cr3+ + 7 H2O εo = +1,33
CI2 + 2e 2CI─ εo = +1,36
8. Гальванический элемент
Двухэлектродная обратимая система, в которой энергия
химической реакции преобразуется в электрическую,
называется гальваническим элементом. Первый
химический источник тока создал Вольт. Медную и
цинковую пластины он соединил тканью, пропитанной
раствором серной кислоты:
(─) Zn| H2SO4 | Cu (+)
(─) Zn ─ 2e → Zn 2+
(+)2H+ + 2e → H2 ↑.
Из-за выделения газообразного водорода такая система
не получается обратимой, она работает только на
разряд.
9. Элемент Даниэля-Якоби
10. Схема элемента и обозначение электродов
Zn + CuSO4 ZnSO4 + Cu
(─) Zn| ZnSO4 || CuSO4 | Cu (+)
(─) Zn ─ 2e Zn2+
(+) Cu2+ + 2e Cu
Электрод, на котором протекает процесс окисления,
называется анодом.
Электрод, на котором протекает процесс
восстановления, называется катодом.
11. Электродвижущая сила (Э.Д.С)
Суммарная работа, производимая
электрическим током называется
электродвижущей силой (э.д.с.)
элемента (Е).
∑Аi = Е • n • F
где n – заряд иона металла,
F – число Фарадея для приведения к молю.
12. Виды работ
А1 –работа окисления цинка (поверхность
металлического цинка в контакте с раствором его
соли). А1 = ─ εZn • n • F.
А2 – работа восстановления ионов меди (поверхность
меди в растворе ее соли). А2 = εCu • n • F.
А3 – работа преодоления контактного потенциала
(контакт цинка и меди с электрическим проводником –
граница раздела двух металлов).
А4 – работа преодоления диффузионного потенциала
(контакт растворов солей меди и цинка с раствором
хлорида калия – граница раздела двух растворов).
13. Связь э.д.с. с потенциалами электродов
А3 = А4 ≈ 0.
Е • n • F = = εCu • n • F ─ εZn • n • F
Е = εCu ─ εZn
Медь – катод, цинк – анод. В общем случае э.д.с.
гальванического элемента равна разности электродных
потенциалов катода и анода:
Е = εкатода ─ εанода
По своему физическому смыслу Е≥0, поэтому
εкатода > εанода ,
Е = ε0Cu ─ ε0Zn = 0,337 ─ (─ 0,762) = 1,1 В
14. Концентрационная цепь
(1) Cu| CuSO4 || CuSO4 | Cu (2)
С1 = 1 моль/л, С2 = 0,01 моль/л
(1) εCu = ε0Cu = 0,34В,
(2) εCu = ε0Cu + (0,059/2) • lg 0,01 = 0,28В.
Е=0,06В.
Элемент, работающий за счёт разности концентраций,
называется концентрационным.
Источник: ppt-online.org
Электроды 1 и 2 рода, окислительно-восстановительный, сравнения. Электроды первого рода. Электроды второго рода

36(1).Электроды 1 и 2 рода, окислительно-восстановительный, сравнения. Электроды первого рода. В потенциалопределяющих реакциях на этих электродах участвует один вид ионов. Металлические электроды, обратимые относительно катионов (в том числе и амальгамные), и металлоидные, обратимые относительно анионов: 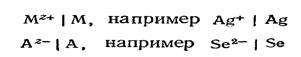
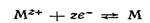 Электродный потенциал с учетом того, что активность твердого вещества при данной температуре постоянна и равна единице:
Электродный потенциал с учетом того, что активность твердого вещества при данной температуре постоянна и равна единице: 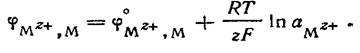 А м а л ь г а м н ы е электроды состоят из амальгамы металла, находящейся в контакте с раствором, содержащим ионы этого металла :
А м а л ь г а м н ы е электроды состоят из амальгамы металла, находящейся в контакте с раствором, содержащим ионы этого металла : 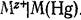 Уравнения потенциалопределяющей реакции электрода и его потенциала:
Уравнения потенциалопределяющей реакции электрода и его потенциала: 
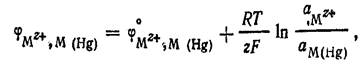 К электродам первого рода относятся также газовые.
К электродам первого рода относятся также газовые.
Водородный электрод пластинка из платины, покрытая электролитической платиновой чернью, погруженной в раствор, содержащий потенциалопределяющие вещества, через который пропускается водород. В кислой среде системе 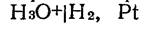 отвечает уравнение потенциалопределяющей реакции
отвечает уравнение потенциалопределяющей реакции 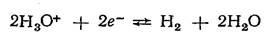 которое может быть записано в упрощенном виде:
которое может быть записано в упрощенном виде: 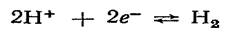
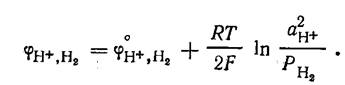
Потенциал водородного электрода
Поскольку стандартный потенциал водородного электрода при всех температурах условно принят равным нулю, то при Р, = 1 потенциал электрода определяется рН раствора: 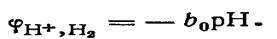 В щелочной среде в системе
В щелочной среде в системе 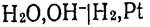 протекает потенциалопределяющая реакция по уравнению
протекает потенциалопределяющая реакция по уравнению 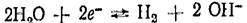 которому отвечает уравнение для расчета потенциала:
которому отвечает уравнение для расчета потенциала: 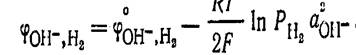 Водородный электрод применяется как индикаторный при экспериментальном определении рН растворов. Кислородный электрод по устройству аналогичен водородному электроду. В щелочной среде для системы
Водородный электрод применяется как индикаторный при экспериментальном определении рН растворов. Кислородный электрод по устройству аналогичен водородному электроду. В щелочной среде для системы 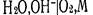
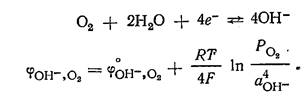
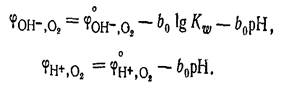
Создать практически кислородный электрод с данной реакцией не удается, так как в реальных условиях металлы под действием кислорода окисляютсяэПотенциал Кислородного электрода как в щелочной, так и кислой среде зависит от рН раствора:
Электроды второго рода.
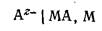
Такие электроды состоят из трех фаз: металл покрыт слоем его труднорастворимой соли и погружен в раствор, содержащий анионы, одноименные с анионами соли:
В потенциалопределяющей реакции на этом электроде принимают участие как катионы, так и анионы. Электрохимическому процессу  сопутствует химическая реакция, приводящая к осаждению или растворению МА:
сопутствует химическая реакция, приводящая к осаждению или растворению МА: 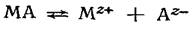 Суммарное уравнение реакции, согласно которой электрод обратим относительно аниона,
Суммарное уравнение реакции, согласно которой электрод обратим относительно аниона, 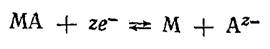 Последней реакции соответствует уравнение для расчета электродного потенциала
Последней реакции соответствует уравнение для расчета электродного потенциала 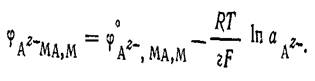
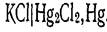
Электрод второго рода можно рассматривать как электрод первого рода, обратимый относительно катиона у которого активтность в растворе определяется растворимостью МА. Вследствие устойчивости потенциалов электроды второго рода могут быть использованы как электроды сравнения при потенциометрических измерениях. для этого наиболее употребительны каломельный и хлорсеребряный электроды. Каломельный электрод состоит из ртути, покрытой пастой, содержащей каломель, и соприкасающейся с раствором хлорида калия: .
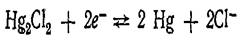
Уравнение потенциалопределяющей реакции По концентрации применяемого раствора КСI различают 0,1 н., 1 н. и насыщенный каломельные электроды. Последний имеет наиболее широкое применение.
Хлорсеребряный электрод серебряная пластинка, покрытая АgС1 и погруженная в раствор КСI. Уравнение электродной реакции 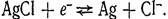 Окислительно-восстановительные электроды. Все электроды, которым соответствует потенциалопределяющие реакции с участием электронов, представляют собой окислительно-восстановительные системы.
Окислительно-восстановительные электроды. Все электроды, которым соответствует потенциалопределяющие реакции с участием электронов, представляют собой окислительно-восстановительные системы.
Однако принято в особую группу выделять электроды, в потенциалопределяющих реакциях которых не участвуют простые вещества — газы, металлы. Эти электроды называются окислительновосстановительяыми (редокси-электроды). В общем виде схема электрода и уравнение потенциалопределяющей реакции записываются так: 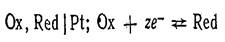 Сюда относятся в первую очередь электроды, у которых Ох и Red представляют собой ионы, причем электродная реакция состоит в перемене их заряда. Потенциал окислительно-восстановительного электрода для систем, характеризующихся равновесием
Сюда относятся в первую очередь электроды, у которых Ох и Red представляют собой ионы, причем электродная реакция состоит в перемене их заряда. Потенциал окислительно-восстановительного электрода для систем, характеризующихся равновесием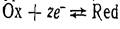 , потенциал рассчитывается по уравнению
, потенциал рассчитывается по уравнению 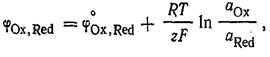 Кроме относительно простых окислительно-восстановительных электродов существуют более сложные, в потенциал- определяющих реакциях которых участвуют ионы Н+ и молекулы воды. Например, системе
Кроме относительно простых окислительно-восстановительных электродов существуют более сложные, в потенциал- определяющих реакциях которых участвуют ионы Н+ и молекулы воды. Например, системе 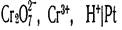 отвечают уравнения электродной реакции и для расчета потенциала электрода:
отвечают уравнения электродной реакции и для расчета потенциала электрода: 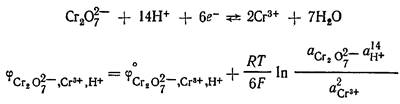
Из расчетного уравнения видно, что потенциал редокс электрода зависит
Похожие материалы
- График зависимости состава пара от состава жидкой фазы при постоянном давлении. Вариантность системы в азеотропной точке
- Диаграмма плавкости 2-х компонентных систем. Диаграммы плавкости систем с конгруэнтно и инконгруэнтно плавящимися соединениями
- Зависимость константы скорости реакции от температуры. Вычисление константы скорости бимолекулярной реакции по числу соударений
Источник: vunivere.ru