1 рода: электроды, обратимые относительно или катиона или аниона (цинковый, медный, газовый). Представляет собой металл, опущенный в раствор собственной соли.
2 рода: электроды, обратимые относительно и катиона и аниона. Электродный потенциал зависит от концентрации катиона и аниона (хлорсеребряный). Представляет собой трехфазную систему, в которой металл покрыт труднорастворимой солью и погружен в раствор, содержащий анион этой соли.
Устройство и сущность работы хлорсеребряного электрода. Уравнение Нернста для потенциала хлорсеребряного электрода.
Хлорсеребряный электрод- электрод 2 рода. Электроды 2 рода состоят из металла, нерастворимой соли этого металла и второго хорошо растворимого электролита с тем же анионом.
e — + AgCl ↔ Ag 0 + Cl — — ‘эта реакция является причиной возникновения электродного потенциала.
Уравнение Нернста: Е= Е 0 + 0,059lgC(Ag + )
Понятие об окислительно- восстановительных (редокс- системах), электродах и потенциалах.
О-В электроды:
Электроды МР-3: почему их так любят? Синие, зеленые, красные- достоинства и недостатки
Электроды, в которых материал электрода в О-В процессе не участвует он является только переносчиком электронов.
Представляет собой систему содержащую окисленную и восстановленную формы одного и того же вещества. В его раствор опущен инертный металлический электрод (платина, золото)., который является или поставщиком электронов или их переносчиком.
1)Если в системе преобладает окисленная форма будет идти процесс восстановления (+) Fe 3+ + e — = Fe 2+
2)Если в системе преобладает восстановленная форма- будет идти процесс окисления (-) Fe 2+ = Fe 3+ + e —
О-В потенциал- потенциал, возникающий на инертном (обычно платиновом) электроде, погруженном в раствор, содержащий одну или несколько обратимых О-В систем.
Механизм возникновения редокс- потенциала.
При помещении металла в раствор его соли для активных металлов (например, цинк) происходит очень малое, но растворение металла.
Граничный слой раствора в этом случае заряжается положительно, а сам металл- отрицательно. Величина скачка напряжения называется электродным потенциалом. Величина электродного потенциала может быть измерена только относительно другого электрода (например, стандартного водородного электрода).
Типы окислительно- восстановительных систем, примеры.
1)Редокс- система без участия ионов Н +
Fe 3+ + e — = Fe 2+ направление реакции зависит оттого, с чем взаимодействует. Если в начальный момент преобладает процесс присоединения электронов, то на платине возникает положительный заряд. Он обусловлен недостатком электронов.
Уравнение Нернста- Петтерса:
Е(ox/red)= E 0 (ox/red) +0,059/n* lg[ox]/[red]
2)Редокс- системы с участием ионов Н +
MnO4 — + 5e — + 8Н + = Mn 2+ +4H2O
Направление процесса зависит оттого, с чем взаимодействует платина.
Уравнение Нернста- Петтерса:
E(MnO4 — H + /Mn 2+ )= E 0 (MnO4 — H + /Mn 2+ )+ 0,059/5* lg[MnO4 — ]*[ Н + ] 8 /[ Mn 2+ ]
Стандартные окислительно- восстановительные потенциалы. Как их значения характеризуют редокс системы и определяют направление реакций?
Лекция 64 Классификация электродов Электрод первого рода
Стандартные О-В потенциалы- характеризуют способность системы функционировать в качестве окислителя или восстановителя.
Физический смысл: это потенциал в системе, когда концентрация (активность) окисленной формы равна концентрации (активности) восстановленной формы.
Реакция протекает в направлении, которое приводит к образованию более слабого окислителя и более слабого восстановителя. Т.о. сравнивая потенциалы двух сопряженных пар можно принципиально решить вопрос направления процесса.
Уравнение Нернста- Петерса для различных типов редокс- систем, анализ уравнений.
Для редокс- систем 1 типа: ox + ze — ↔ red
Е(ox/red)= E 0 (ox/red) +0,059/n* lg[ox]/[red]
Е(ox/red)= E 0 (ox/red) +0,2T/n* lg[ox]/[red]
n- количество электронов, которое передается от одной формы к другой
Для редокс- систем 2 типа: ox + ze — + mH + ↔ red
E(ox/red)= E 0 (ox/red) + 0,059/n* lg[ox]*[ Н + ] m /[ red]
E(ox/red)= E 0 (ox/red) + 0,2T/n* lg[ox]*[ Н + ] m /[ red]
Биологическое значение редокс- потенциалов.
О-В потенциал. Основными процессами, обеспечивающими жизнедеятельность любого организма, являются ОВР, т.е. реакции, связанные с передачей или присоединением электронов. Энергия, выделяемая в ходе этих реакций, расходуется на поддержание гомеостаза (жизнедеятельности организма) и регенерацию клеток организма, т.е. на обеспечение процессов жизнедеятельности организма соответственно в настоящем и будущем.
Например: цепь дыхательных ферментов в митохондриях, где каждый фермент- элемент редокс- системы.
Дата добавления: 2020-04-25 ; просмотров: 1184 ; Мы поможем в написании вашей работы!
Поделиться с друзьями:
Источник: studopedia.net
Классификация электродов
Электрохимический электрод — один из двух представленных в электрохимическом элементе проводников, на поверхности которого происходит электрохимическая реакция. По типу электродной реакции все электроды можно разделить на две группы: электроды первого и второго рода.
Электроды первого рода
К электродам первого рода относятся электроды, состоящие из металлической пластинки, погруженной в раствор соли того же металла. При обратимой работе элемента, в который включен электрод, на металлической пластинке идет процесс перехода катионов из металла в раствор либо из раствора в металл. Таким образом, электроды первого рода обратимы по катиону и их потенциал связан уравнением Нернста (12.2) с концентрацией катиона. К электродам первого рода относят также и водородный электрод.
Электроды второго рода
Электродами второго рода являются электроды, в которых металл покрыт малорастворимой солыо этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. Электроды этого типа обратимы относительно аниона, и зависимость их электродного потенциала от температуры и концентрации аниона может быть записана в следующем виде:

Электроды сравнения
Некоторые металлы (например, золото, платина, медь, серебро и др.) обладают настолько прочными кристаллическими решетками, что катионы из нее почти не могут выйти и перейти в раствор. Поэтому они практически не имеют собственного скачка потенциала. Но поверхность таких металлов может адсорбировать многие другие вещества, которые способны окисляться или восстанавливаться. Такие электроды (металлы) в этом случае называют инертными, а потенциал их определяется равновесием между окисленной и восстановленной формой веществ адсорбированных на их поверхности.
Примером подобного электрода является водородный электрод.
Водородный электрод представляет собой платиновую пластинку, омываемую газообразным водородом, погруженную в раствор, содержащий ионы водорода. Адсорбируемый платиной водород находится в равновесии с газообразным водородом; схематически электрод изображают следующим образом:

Электрохимическое равновесие на электроде можно рассматривать в следующем виде:

Роль платины заключается в том, что она осуществляет роль посредника (банка электронов) в окислительно-восстановительных процессах передачи электронов и позволяет снимать, регистрировать потенциал с газообразного водородного электрода.
Потенциал водородного электрода (платиновой пластинки) зависит от парциального давления водорода, от концентрации ионов водорода в растворе и температуры. Поскольку водородный электрод широко используется при определении других электродных потенциалов, принято условно считать, что его потенциал равен нулю при активной концентрации ионов водорода 1 моль/л, давлении водорода 101 325 Па и при температуре 25°С.
Поэтому для электродного потенциала нестандартного водородного электрода можно записать:

Каломельный электрод часто используется в качестве электрода сравнения как более простой в обращении, величина электродного потенциала которого относительно стандартного водородного электрода точно известна и зависит только от температуры. Каломельный электрод состоит из ртутного электрода, помещенного в раствор КС1 определенной концентрации и насыщенный каломелью Hg-,Cl2:

Каломельный электрод обратим относительно анионов хлора, и уравнение Нернста для него имеет вид

Хлорсеребряный электрод также используют в качестве электрода сравнения, который также обратим относительно анионов хлора:

Величина потенциала хлорсеребряного электрода зависит от концентрации ионов хлора; данная зависимость имеет следующий вид:

Чаще всего в качестве электрода сравнения используется насыщенный хлорсеребряный электрод, потенциал которого зависит только от температуры.
Источник: studme.org
Электроды сравнения
Электродами второго рода являются электроды, в которых металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. Электроды этого типа обратимы относительно аниона и зависимость их электродного потенциала от температуры и концентрации аниона может быть записана в следующем виде:
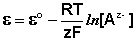
(III.48)
Для определения электродного потенциала элемента необходимо измерить ЭДС гальванического элемента, составленного из испытуемого электрода и электрода с точно известным потенциалом – электрода сравнения. В качестве примеров рассмотрим водородный, каломельный и хлорсеребряный электроды.
Водородный электрод представляет собой платиновую пластинку, омываемую газообразным водородом, погруженную в раствор, содержащий ионы водорода. Адсорбируемый платиной водород находится в равновесии с газообразным водородом; схематически электрод изображают следующим образом:
Рt, Н2 / Н+
Электрохимическое равновесие на электроде можно рассматривать в следующем виде:
2Н + + 2е — ––> Н2
Потенциал водородного электрода зависит от активности ионов Н + в растворе и давления водорода; потенциал стандартного водородного электрода (с активностью ионов Н + 1 моль/л и давлением водорода 101.3 кПа) принят равным нулю. Поэтому для электродного потенциала нестандартного водородного электрода можно записать:
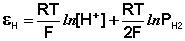
(III.49)
Каломельный электрод. Работа с водородным электродом довольно неудобна, поэтому в качестве электрода сравнения часто используется более простой в обращении каломельный электрод, величина электродного потенциала которого относительно стандартного водородного электрода точно известна и зависит только от температуры. Каломельный электрод состоит из ртутного электрода, помещенного в раствор КСl определенной концентрации и насыщенный каломелью Hg2Сl2:
Каломельный электрод обратим относительно анионов хлора и уравнение Нернста для него имеет вид:
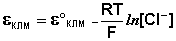
(III.50)
Хлорсеребряный электрод. В качестве электрода сравнения используют также другой электрод второго рода – хлорсеребряный, представляющий собой серебряную проволоку, покрытую хлоридом серебра и помещённую в раствор хлорида калия. Хлорсеребряный электрод также обратим относительно анионов хлора:
Аg / АgСl, КСl
Величина потенциала хлорсеребряного электрода зависит от активности ионов хлора; данная зависимость имеет следующий вид:
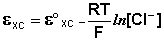
(III.51)
Чаще всего в качестве электрода сравнения используется насыщенный хлорсеребряный электрод, потенциал которого зависит только от температуры. В отличие от каломельного, он устойчив при повышенных температурах и применим как в водных, так и во многих неводных средах.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru