Потенциал электрода или электродный потенциал металла — это разность потенциалов, которая возникает на границе раздела фаз металл-раствор при погружении металла в раствор электролита в результате взаимодействия поверхностных ион-атомов металла, находящихся в узлах кристаллической решетки, с полярными молекулами воды, ориентированными у поверхности электрода. Это связано с образованием двойного электрического слоя, то есть несимметричного распределения заряженных частиц у границы раздела фаз.

Явления растворения металлов в электролитах используются в химических источниках электроэнергии. Металлическая пластина, опушенная в раствор своей же соли, в той или иной мере стремится в ней раствориться. Это стремление иногда называется упругостью растворения металла.
Цинковая пластина, опущенная в раствор сернокислого цинка Zn SO4 , отдает в раствор частицы цинка в виде положительно заряженных ионов. Вследствие того, что атомы пинка уходят в виде положительно заряженных ионов, на цинковой пластине образуется избыток свободных электронов и она заряжается отрицательно, а в слое жидкости вблизи поверхности цинка образуется избыток положительных ионов и, следовательно, этот слой заряжается положительно. Таким путем на границе жидкости и металла возникает двойной электрический слой из пространственно разделенных зарядов противоположного знака.
Лекция 65 Классификация электродов Электрод второго рода
Эти заряды будут противодействовать дальнейшему переходу металла в раствор — отрицательные пластины удерживают положительный ион металла, а положительный заряд электролита отталкивает ион металла назад на пластину. Иными словами, электрическое поле двойного слоя на границе металл — жидкость противодействует дальнейшему переходу ионов металла в раствор. Устанавливается равновесие между химическими по своей природе силами стремления металла перейти в раствор и электрическими силами, им противодействующими.
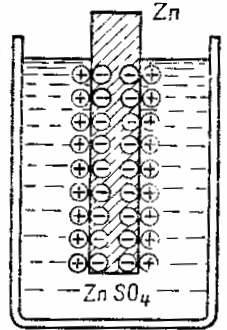
Схема образования двойного электрического слоя на границе металла и электролита
Таким образом, вследствие растворения в электролите металлический электрод приобретает по отношению к электролиту определенный электродный (иначе электрохимический) потенциал, зависящий от материала электрода и состава электролита.
Однако электродные потенциалы могут иметь положительное значение. Это имеет место в тех случаях, когда положительные ионы раствора переходят на электрод, заряжая его положительно, а слой электролита — отрицательно, например, когда медная пластина погружена в достаточно концентрированный раствор сернокислой меди (CuSO4).
Двойной электрический слой можно уподобить конденсатору, одна из обкладок которого представляет собой поверхность металла, а другая — слой ионов в растворе у поверхности металла. Между разноименно заряженными обкладками и возникает разность, или скачок, потенциала.
Химия 11 класс (Урок№8 — Химические источники тока. Ряд стандартных электродных потенциалов.)
Скачок потенциала на границе электрод-раствор может служить мерой окислительно-восстановительной способности системы. Однако невозможно произвести измерение такого скачка потенциала или, что то же, разности потенциалов между двумя фазами. Но можно произвести измерение э. д. с. элементов, составленных из интересующих нас электродов и какого-нибудь одного (одинакового во всех случаях) электрода, потенциал которого условно принят за нуль.
Измеренная э. д. с. будет характеризовать окислительно-восстановительную способность интересующего нас электрода относительно некоторого условного нуля. Полученная таким способом величина называется собственным потенциалом металла.
Чтобы измерить электродный потенциал любого металла, необходимо поместить в электролит второй электрод, который и свою очередь будет обладать определенным электродным потенциалом, зависящим от его материала. Следовательно, непосредственно измерить можно только алгебраическую сумму двух электродных потенциалов.
По этой причине электродные потенциалы различных материалов определяются по отношению к стандартному (водородному электроду, потенциал которого условно принимают за нуль.
Для измерения могут применяться и другие электроды сравнения, потенциал которых относительно водородного стандартного электрода известен. Этот потенциал также находят на основании измерения э. д. с. цепи, составленной из выбранного электрода сравнения и стандартного водородного электрода.
Если изучаемый электрод в паре со стандартным водородным электродом является отрицательным, то собственному потенциалу приписывается знак «-«, в противном случае — знак «+».
Например, измеренный таким образом в растворе соответствующей соли металла электродный потенциал цинка -0,76 В, меди +0,34 В, серебра +0,8 В. Э. д. с, которую дает элемент, определяется вычитанием потенциала более отрицательного из потенциала более положительного.
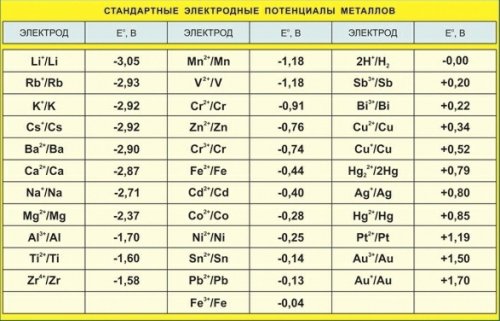
Если в соответствующий электролит помещены две пластины из металлов, имеющих различный электродный потенциал, например, в раствор серной кислоты (H2SO4) помещены цинковая (Zn) и медная (С u ) пластины, то вольтметр, присоединенный к этим пластинам, покажет между ними напряжение немного более 1 В.
Это напряжение, называемое в данном случае э. д. с. гальванической пары, будет обусловлено разностью электродных потенциалов меди, обладающей небольшим положительным потенциалам, и цинка, обладающего значительным отрицательным потенциалом. Такое устройство является простейшим гальваническим элементом — элементом Вольта.
В гальваническом элементе происходит превращение химической энергии в электрическую и с его помощью можно совершить электрическую работу за счет энергии химической реакции.

Измерение э. д. с. гальванических элементов необходимо производить при отсутствии тока в цепи элемента. В противном случае измеренная э. д. с. будет меньше, чем величина, определяемая как разность равновесных потенциалов обоих электродов. Действительно, равновесному потенциалу отвечает определенная концентрация электронов на электродах: на более положительном она ниже, на более отрицательном выше. Сообразно с этим различно и строение той части двойного слоя, которая расположена в растворе.
Измерение э. д. с. элемента без протекания тока обычно производится компенсационным методом. Для осуществления его необходимо иметь некоторый эталон э. д. с. Таким эталоном служит так называемый нормальный элемент. Чаще всего пользуются ртутно-кадмиевым нормальным элементом Вестона, э. д. с. которого равна 1,01830 В при 20 °С.
Телеграмм канал для тех, кто каждый день хочет узнавать новое и интересное: Школа для электрика
Если Вам понравилась эта статья, поделитесь ссылкой на неё в социальных сетях. Это сильно поможет развитию нашего сайта!
Не пропустите обновления, подпишитесь на наши соцсети:
Источник: electricalschool.info
Потенциал серебряного электрода в растворе соли серебра равен 0,434 В (относительно СВЭ). Какова равновесная
Потенциал серебряного электрода в растворе соли серебра равен 0,434 В (относительно СВЭ). Какова равновесная концентрация ионов Ag+ в растворе, если EAg+/Ag0=0,799 В. Дано: EAg+/Ag=0,434 В EAg+/Ag0=0,799 В Найти: Ag+
Электродный потенциал металла зависит от концентрации его ионов в растворе. Такая зависимость описывается уравнением Нернста:
EAg+/Ag= EAg+/Ag0+ 0,059nlgAg+ , где
EAg+/Ag0- стандартный электродный потенциал серебра, В;
Ag+- равновесная концентрация ионов серебра в растворе его соли, моль/л;
n – число электронов в электродной реакции.
При погружении серебряного электрода в раствор его соли Ag+, протекает следующая электродная реакция:
Ag0 –e- → Ag+
Т.е








Библиотека Ирины Эланс, основана как общедоступная библиотека в интернете. Онлайн-библиотеке академических ресурсов от Ирины Эланс доверяют студенты со всей России.
Библиотека Ирины Эланс
Полное или частичное копирование материалов разрешается только с указанием активной ссылки на сайт:
Ирина Эланс открыла библиотеку в 2007 году.
Источник: student-files.ru