Написание уравнений электродных процессов, токообразующей реакции в гальваническом элементе. Расчет энергии Гиббса токообразующей реакции, расчет электродвижущей силы гальванических элементов. Построение поляризационных кривых электродов в гальваническом элементе.
Пример 1. Работагальванического элемента при стандартном состоянии. Расчет стандартной ЭДС гальванического элемента. Поляризационные кривые.
Рассмотрите работу серебряно-цинкового гальванического элемента. Напишите катодные и анодные процессы, рассчитайте стандартную ЭДС элемента при 298 К двумя способами.
Решение. Выпишем из таблицы приложения 6 [1] значения стандартных электродных потенциалов цинка и серебра:
 В,
В,  В.
В.

Т.к. , электроны будут переходить от цинкового электрода к серебряному. Тогда в заданном ГЭ серебряный электрод – катод, цинковый электрод – анод.
Цинк — Серебряный гальванический элемент на пищевой соде в купе с преобразователем даёт 10 вольт
Электродные реакции для серебряно-цинкового элемента записываются следующим образом:


Суммируя анодную и катодную реакции, получаем уравнение токообразующей реакции (ТОР):
Zn + 2Ag + → 2Ag + Zn 2+ .
Рассчитаем стандартную ЭДС гальванического элемента Е 0 Э .

1 способ: рассчитаем этого ГЭ, как разность стандартных потенциалов катода и анода по уравнению:

= 0,799 – (– 0,763) = 1,562 В.

2 способ: Электродвижущая сила элемента связана с энергией Гиббса ТОР уравнением:

,
где п — количество моль-эквивалентов вещества.
В общем случае, для ТОР реакции:

протекающей в ГЭ при стандартных состояниях веществ при Т = 298 К, энергия Гиббса рассчитывается по табличным значениям по уравнению:

.

В соответствии с этим рассчитываем стандартную энергию Гиббса ТОР нашего ГЭ:


Рассчитаем стандартную ЭДС по известной энергии Гиббса: B.
Составление схемы и вычисление ЭДС гальванического концентрационного элемента | Уравнение Нернста

Значения , рассчитанные первым и вторым способами, практически равны между собой.
В работающем ГЭ при прохождении тока I напряжение U меньше ЭДС из-за явления поляризации катода (D EК) и анода (D ЕА) и омического падения напряжения на сопротивлении r1 в проводниках с электронной проводимостью (проводниках первого рода) и на сопротивлении r2 в электролите (проводнике второго рода)

.

Поляризацией называется изменение потенциала электрода при прохождении электрического тока: , где E i — потенциал электрода под током; Е p – равновесный потенциал электрода.
В гальваническом элементе при прохождении электрического тока потенциал анода становится более положительным, а потенциал катода – более отрицательным, что приводит к уменьшению напряжения U.
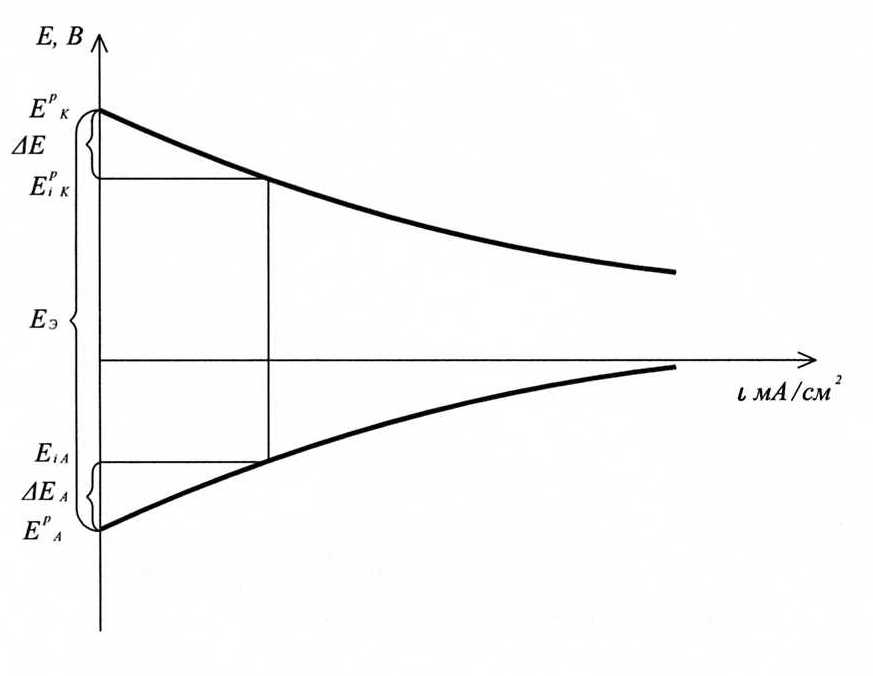
Ход поляризационных кривых ГЭ: .
Пример 2. Расчет ЭДСгальванического элемента при нестандартном состоянии.
Рассчитать ЭДС серебряно – цинкового ГЭ при Т = 298 К, если активность Zn 2+ и Ag + равны по 0,01 моль/л.
Решение. Процессы, протекающие в ГЭ, и стандартная ЭДС элемента те же, что в примере 1.
Равновесные потенциалы электродов рассчитываем по уравнению Нернста для металлических электродов при 298 К

:

B.

B.
ЭДС заданного ГЭ:

B.
Пример 3. Расчет величины максимально вырабатываемой электроэнергии в гальваническом элементе.
Рассчитайте величину максимальной электроэнергии, которая может быть выработана серебряно – цинковым ГЭ при уменьшении массы анода на 1 г в результате протекания электрохимической реакции при условиях заданных в примере 1.
Решение. Количество электричества Q, прошедшего через электродную поверхность, рассчитывается из объединенного закона Фарадея:

,
где F – число Фарадея F = 96500Кл или F =26,8 А . час;
М – молярнаямасса вещества, г/моль;
n – число электронов, принимающих участие в электрохимическом процессе;
Q – количество электричества, израсходованное на превращение вещества, Кл;

, где I – сила тока, А; t – время процесса, с.
Анодом в заданном ГЭ является цинковый электрод, молярная масса
М Zn = 65,4 г/моль.
Рассчитаем 
 .
.
Максимально вырабатываемая электроэнергия (электрическая работа W эл max ) в гальваническом элементе связана с ЭДС о энергией Гиббса ТОР:
 , Дж/моль. В то же время
, Дж/моль. В то же время  .
.

Тогда или W эл = 1,23 Вт . ч.
Пример 4. Расчет ЭДСгальванического элемента при нестандартном состоянии. Способы увеличения ЭДС.
Рассчитайте ЭДС цинк-хлорного ГЭ, если  , и
, и  моль/л при Т = 298 К. Предложите способы увеличения
моль/л при Т = 298 К. Предложите способы увеличения  ГЭ.
ГЭ.
Решение. Согласно табл. приложения 6 [1] значения стандартных электродных потенциалов:
 =1,359 В,
=1,359 В,  В.
В.
Рассчитаем значения равновесных электродных потенциалов для соответствующих электродов по уравнению Нернста.
Для потенциалопределяющей реакции Zn 2+ + 2 
 Zn:
Zn:

В.
Для потенциалопределяющей реакции Cl2(газ) + 2 
 2Cl – (р)
2Cl – (р)

В.
Так как  >
> 
 , то цинковый электрод – анод, хлорный электрод – катод. Уравнения электродных реакций и ТОР:
, то цинковый электрод – анод, хлорный электрод – катод. Уравнения электродных реакций и ТОР:

А — : Zn – 2 → Zn 2+

К + : Cl2 + 2 → 2Cl –
ТОР: Zn + Cl2 → Zn 2+ + 2Cl –

Вычислим значение ЭДС ГЭ: В.
В общем случае, для ТОР реакции:
ЭДС гальванического элемента для ТОР при активности ионов отличных от 1 моль/л можно рассчитать из выражения:

,
где аВ, аD, аL, aM, – активности веществ; b, d, l, m – стехиометрические коэффициенты ТОР. Для твердых веществ активности принимают равными единице, для газов используют относительное парциальное давление.
ЭДС цинк-хлорного гальванического элемента при 298 К:

.
Увеличить ЭДС данного ГЭ можно, если:
– уменьшить активность ионов Zn 2+ ;
– уменьшить активность ионов Cl – ;
– увеличить парциальное давление Cl2.
Пример 5. Концентрационный гальванический элемент.
Рассчитайте ЭДС концентрационного ГЭ:

H2,Pt | НCl || СН3СООН| H2,Pt, работающего при одинаковых давлениях и одинаковых концентрациях водных растворов кислот c = 0,1 моль/л.
Решение. Для кислой среды уравнения электродных реакций в концентрационном элементе:

А — : H2 → 2H + + 2

К + : 2H + + 2 → H2
Величина равновесного потенциала этих электродов определяется по уравнению
 , при
, при  .
.

Рассчитаем активность ионов водорода :

а) в растворе уксусной кислоты: СН3СООН СН3СООН – + H + ,
т.к. уксусная кислота является слабым электролитом, то коэффициент активности γ  и
и  =
=  ;
;
 = αс0 , где степень диссоциации
= αс0 , где степень диссоциации  и тогда
и тогда

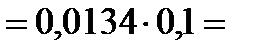
 моль/л, следовательно
моль/л, следовательно  В.
В.
б) в растворе соляной кислоты: HCl → H + + Cl – , т.к. НСl является сильным электролитом, то сначала рассчитываем ионную силу раствора:

,

затем по таблице находим коэффициент активности γ и тогда:
 моль/л и
моль/л и  В.
В.

Т.к. , рассчитанный для соляной кислоты более положительный, чем для уксусной, то катодом будет электрод погруженный в раствор соляной кислоты, анодом — электрод погруженный в раствор уксусной кислоты.

В.
Источник: poisk-ru.ru
Химик.ПРО – решение задач по химии бесплатно
Запишем уравнения химических реакций, происходящих на пластинах.
![]()
![]()
Если наружные концы пластин соединить проводником, образуется гальванический элемент.
Гальванический элемент (ГЭ) – это устройство, в котором энергия химической реакции превращается в электрическую. В основе работы гальванического элемента лежит ОВР.
Составим схему гальванического элемента:
Сравним стандартные электродные потенциалы цинка (Zn) и свинца (Pb):
E 0 (Zn 2+ /Zn 0 ) = – 0,76 В,
E 0 (Pb 2+ / Pb 0 ) = – 0,13 В.
Цинк (Zn) – металл, имеющий более отрицательное значение стандартного электродного потенциала и поэтому является более сильным восстановителем. Следовательно, цинк (Zn) будет подвергаться окислению под действием ионов свинца (Pb), и электроны от цинка (Zn) будут переходить к свинцу(Pb):
Таким образом, Zn – анод (А) и Zn – восстановитель, Pb – катод.
Электроны двигаются от цинка к свинцу. Схема гальванического элемента
Запишем электронные уравнения процессов, протекающих на электродах на пластинах, и составим суммарное уравнение:
(-) (А) Zn 0 – 2e– → Zn 2+ – процесс окисления
(+) (K) Ag + + e– → Ag 0 – процесс восстановления
Схема гальванического элемента
Вывод:
при замыкании пластин цинковая пластина растворяется, а на свинцовой пластине осаждается серебро.
Источник: himik.pro
Лабораторная работа №7 электрохимические процессы
1. Электродные потенциалы и гальванические элементы
Система, состоящая из металла, погруженного в раствор электролита, называется электродом.
Гальваническим элементомназывается многофазная система, состоящая по меньшей мере из двух электродов (полуэлементов). В качестве примера рассмотрим цинк-серебряный гальванический элемент (рис. 1), состоящий из цинкового и серебряного полуэлементов.
Гальванический элемент (рис.1) состоит из растворов, содержащих ионы Zn 2+ иAg + , разделенных пористой диафрагмой для того, чтобы обеспечить протекание тока без смешения растворов. В каждый из растворов опущен электрод из соответствующего металла. Границу раздела фаз металл – раствор обозначают символом «/», а электролитический контакт растворов – «//». Таким образом, схему рассматриваемого элемента можно представить в виде


Рис. 1. Схема цинк-серебряного гальванического элемента
В цинковом полуэлементе протекает реакция окисления, электрод называют анодом. При протекании тока масса анода уменьшается за счет его растворения.
В серебряном полуэлементе протекает реакция восстановления, электрод называют катодом. При протекании тока масса катода увеличивается за счет осаждения на его поверхности металла.
Суммарная реакция получается сложением полурекций:
Zn+ 2Ag + Zn 2+ + 2Ag
Направление протекания самопроизвольного процесса, можно определить из величин электродных потенциалов полуэлементов.
Электродный потенциалэто разность потенциалов гальванического элемента, состоящего из исследуемого электрода и электрода сравнения, при условии, что ток во внешней цепи стремится к нулю . Измеренную в таких условиях разность потенциалов называютэлектродвижущей силой(коротко – э.д.с.).
Стандартным электродом сравнения служит стандартный водородный электрод. Это газовый электрод, состоящий из платиновой проволоки, покрытой слоем платиновой черни, находящийся в атмосфере водорода под давлением 1,01310 5 Па (1 атм) и погруженный в раствор с активностью ионов Н + равной 1,0 моль/дм 3 . В соответствии с международным соглашением потенциал такого электрода условно принят за нуль при любых температурах.

Таким образом, для измерения электродного потенциала необходимо собрать гальванический элемент, состоящий из исследуемого электрода (всегда записывают справа) и стандартного водородного электрода (всегда записывают слева). Например, для цинкового электрода

Э.д.с.такого гальванического элемента, называютстандартным электродным потенциалом если измерения проводят при стандартных условиях (активности всех компонентов равны 1,00 моль/дм 3 , Т = 298 К)

.
Уравнение Нернста. Потенциал электрода зависит от состава электролита и температуры в соответствии с уравнением Нернста:

где φ – потенциал в Вольтах, φ о -стандартный электродный потенциал; aок, aвос– активности потенциалопределяющих ионов в окисленном и восстановленном состоянии; n – число электронов, принимающих участие в данной электродной реакции; F = 96480 Кл/моль (постоянная Фарадея);R- универсальная газовая постоянная; Т – температура, К.
При Т = 298 К для металлических электродов уравнение Нернста имеет вид:
Источник: studfile.net