Решение задач по химии с использованием уравнениея Нернста
Задание 246.
Потенциал серебряного электрода в растворе АgNO3 составил 95% от значения его стандартного электронного потенциала. Чему равна концентрация ионов Аg+ (моль/л). Ответ: 0,20 моль/л.
Решение:
Электродный потенциал металла (Е)зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Используя уравнение Нернста, получим выражение для расчета концентрации ионов Ag + в растворе:
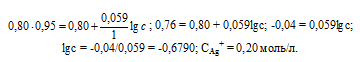
Ответ: 0,20 моль/л.
Задание 247.
Составьте схему, напишите электронные уравнения электродных процессов, и вычислите ЭДС медно-кадмиевого гальванического элемента, в котором [Сd 2+ ] = 0,8 моль/л, а [Сu 2+ ] = 0,01 моль/л. Ответ: 0,68 В.
Изучение гальванических элементов в школьном курсе химии
Решение:
Схема данного гальванического элемента:
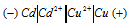
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки — границу раздела двух жидких фаз — пористую перегородку (или соединительную трубку, заполненную раствором электролита). Кадмий имеет меньший потенциал (—0,403 В) и является анодом, на котором протекает окислительный процесс:
Cd 0 — 2 = Cd 2+ (1)
Медь, потенциал которой +0,34 В, катод, т.е. электрод, на котором протекает восстановительный процесс:
Cu 2+ + 2 = Cu 0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Cd 0 + Cu 2+ = Cd 2+ + Cu 0
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
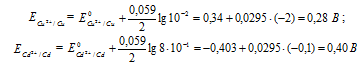
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе 1 молы/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:
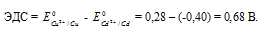
Как работает батарейка (гальванический элемент)
Ответ: 0,68 В.
Задание 248.
Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, а в другом — анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
Решение:
а) Схема гальванического элемента, в котором медь является катодом:
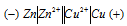
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки — границу раздела двух жидких фаз — пористую перегородку (или соединительную трубку, заполненную раствором электролита). Цинк имеет меньший потенциал (-0,763 В) и является анодом, на котором протекает окислительный процесс:
Zn 0 — 2 = Zn 2+ (1)
Медь, потенциал которой +0,34 В, катод, т.е. электрод, на котором протекает восстановительный процесс:
Cu 2+ + 2 = Сu 0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Zn 0 + Cu 2+ = Zn 2+ + Cu 0
б) Схема гальванического элемента, в котором медь является анодом:
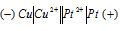
Медь имеет меньший потенциал (+0,34 В) и является анодом, на котором протекает окислительный процесс:
Cu 0 — 2 = Cu 2+ (1)
Платина, потенциал которой +1,19 В, катод, т.е. электрод, на котором протекает восстановительный процесс:
Pt 2+ + 2 = Pt 0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Сu 0 + Pt 2+ = Cu 2+ + Pt 0
Задание 249.
При какой концентрации ионов Сu 2+ (моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода? Ответ: 2,98 . 10 -12 моль/л..
Решение:
Определим концентрацию ионов Cu 2+ , при которой потенциал медного электрода равен 0,00 В, получим:
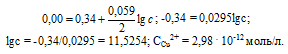
Ответ: 2,98 . 10 -12 моль/л.
Задание 250.
Какой гальванический элемент называют концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, опущенных: первый в 0,01 н., а второй в 0,1 н. растворы AgNO3. Ответ: 0,059 В.
Решение:
Гальванический элемент, работа которого основана на различных концентрациях ионов металла у катода и у анода, называется концентрационным. Обычно катод и анод сделаны из одного и того же металла, опущенных в растворы своей соли разной концентрации. Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы серебряных электродов при разных концентрациях ионов серебра Ag+, получим:
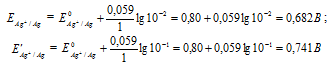
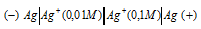
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
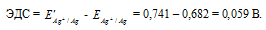
Ответ: 0,059 В.
- Вы здесь:
- Главная

- Задачи

- Химия-Шиманович

- Щелочные металлы | Задачи 335; 336
Источник: buzani.ru
Составьте схемы двух гальванических элементов, в одном из которых серебро было бы анодом, а в другом − катодом. Напишите электродные процессы и рассчитать ЭДС при стандартных условиях
Решение: Составим гальванический элемент, в котором серебро будет катодом. Справочные данные: Поскольку то серебряный электрод в гальваническом элементе будет являться катодом, а стандартный водородный электрод – анодом. Схема гальванического элемента: Электродные процессы: Суммарное уравнение: Составим гальванический элемент, в котором серебро будет анодом. Справочные данные: Поскольку то серебряный электрод в гальваническом элементе будет являться анодом, а золотой электрод – катодом. Схема гальванического элемента: Электродные процессы: Суммарное уравнение:

Похожие готовые решения по химии:
- При электролизе водного раствора Cr2(SO4)3 током силой 2А масса катода увеличилась на 8 грамм. В течение какого времени проводили электролиз?
- Если опустить в разбавленную серную кислоту пластинку из чистого железа, то выделение на ней водорода идет медленно и со временем почти прекращается
- Из заготовки подшипникового антифрикционного сплава (баббита) было взято m=7 пробных кернов, каждый по 500 мг. Надо определить, можно ли рассматривать такое количество как репрезентативную
- Предполагается, что влажность исходной смеси продуктов влияет на плотность конечного продукта. Влажность смеси выбиралась, а плотность конечного продукта измерялась
- Почему при электролизе раствора хлорида меди (II) на катоде выделяется медь, а при электролизе раствора иодида калия − водород?
- Железное изделие покрыто никелем. Какое это покрытие − анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия
- При какой концентрации ионов Cu2+ (моль/л) потенциал медного электрода равен стандартному потенциалу водородного электрода?
- Почему химически чистое железо более стойко против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного
- Вывести аналитическую зависимость теплового эффекта реакции от температуры, если известен тепловой эффект реакции при 298 К. 4. Вычислить при температуре 750 K тепловой эффект реакции
- Начальное число частиц золя составляет 5·108 частиц. Время половинной коагуляции 335 с. Рассчитайте общее число частиц через 100, 200, 250, 350 и 400 с после начала коагуляции
- Найти изменение энтропии g кг вещества при нагревании (охлаждении) в интервале температур от Т1 до Т2, если известны температуры плавления и кипения
- При электролизе водного раствора Cr2(SO4)3 током силой 2А масса катода увеличилась на 8 грамм. В течение какого времени проводили электролиз?
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Telegram и логотип telegram являются товарными знаками корпорации Telegram FZ-LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Источник: www.evkova.org
Схема двух гальванических элементов в одном из которых серебро
Вопрос по химии:
Составить схемы двух гальванических элементов, в одном из которых серебро было бы анодом, а в другом — катодом. Написать электродные процессы и рассчитать ЭДС при стандартных условиях
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
- bookmark_border
- 06.04.2016 03:25
- Химия
- remove_red_eye 6754
- thumb_up 20
Ответы и объяснения 1

- 07.04.2016 22:42
- thumb_up 25
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Источник: online-otvet.ru