Электролиз — совокупность окислительно-восстановительных процессов, протекающих на электродах при прохождении постоянного электрического тока через электрохимическую систему, состоящую из двух электродов и расплава или раствора электролита.
При электролизе химическая реакция осуществляется за счет энергии электрического тока. На катоде, отрицательно заряженном электроде (-), происходит процесс восстановления, на аноде, положительно заряженном электроде (+) — процесс окисления. Восстановительное и окислительное действие электрического тока сильнее действия химических восстановителей и окислителей. Прибор, в котором проводят электролиз, называется электролизёром или электролитической ванной. На характер течения электродных процессов при электролизе большое влияние оказывает состав электролита, растворитель, материал электродов и режим электролиза (напряжение, плотность тока, температура и т.д.).
Различают электролиз расплавов и растворов электролитов. В последнем случае в процессе электролиза будут участвовать молекулы воды.
7. Электролиз
Электролиз расплавов.
Если в расплав хлорида натрия погрузить инертные электроды (угольные, железные) и пропустить постоянный электрический ток, то ионы будут двигаться к электродам: катионы Na + к катоду, анионы Cl — — к аноду.
Окисление происходит на аноде Восстановление происходит на катоде (слова начинаются с гласных «а») (слова начинаются с согласных «к»).
Анионы – отрицательно заряженные ионы. Катионы – положительно заряженные ионы.
Ионы натрия Na + , достигнув катода, принимают от него электроны и восстанавливаются; ионы хлора Сl — , отдав электроны аноду, окисляются. Суммарное уравнение электролиза
(-) катод: Nа + Nа + + е → Na
(+) анод: Сl — 2Сl — — 2е → Сl2
Суммарная схема процесса электролиза расплава NаСl 2NаСl → 2Na + Сl2.
При электролизе расплавов, содержащих кислородсодержащие анионы, на аноде выделяется кислород. Это объясняется образованием при окислении на аноде неустойчивых частиц ОН — , SО4 2- и т.д., сразу разлагающихся на устойчивый оксид неметалла и кислород.
Схема электролиза расплава сульфата натрия может быть представлена следующим образом:
(-) катод: Nа + 2Nа + + 2е → 2 Nа
Суммарная схема процесса электролиза расплава Na2S04
Электролиз растворов.
При рассмотрении электролиза водных растворов следует иметь в виду, что кроме молекул электролита, молекулы воды также могут подвергаться электрохимическому окислению или восстановлению. В этом случае нужно учитывать величину потенциала процесса восстановления ионов водорода, который зависит от концентрации Н + . В нейтральной среде его значение равно -0,41 В. Последовательность разрядки катионов при электролизе можно установить с помощью электрохимического ряда напряжений.
Возможны три случая:
1. Катионы металлов, имеющие величину потенциала значительно более отрицательную, чем -0,41 В (потенциал выделения водорода) не восстанавливаются на катоде (от лития до алюминия включительно), а восстанавливаются молекулы воды;
Аффинаж технического серебра методом электролиза! Простой способ очистки тех. серебра
2. Катионы металлов, имеющие значения стандартных электродных потенциалов близких к значению потенциала выделения водорода (металлы средней части ряда Zn, Сr, Fе, Сd, Ni) восстанавливаются на катоде одновременно с молекулами воды;
3. Катионы металлов, имеющие стандартный электродный потенциал больший, чем потенциал выделения водорода, при электролизе практически полностью восстанавливаются на катоде.
Если водный раствор содержит катионы различных металлов, то при электролизе выделение их на катоде будет протекать в порядке уменьшения алгебраической величины стандартного электродного потенциала. Так, из смеси катионов Аg + , Сu 2+ , Fе 2+ первыми будут восстанавливаться катионы серебра (Е о = + 0,80 В), затем катионы меди (Е о = + 0,34 В) и последними — катионы железа (Е о = — 0,44 В). Характер реакций протекающих на аноде зависит как от присутствия молекул воды, так и от вещества, из которого сделан анод. Различают нерастворимые и растворимые аноды.
Нерастворимые аноды изготавливают из графита, платины. При электролизе нерастворимые аноды не посылают электроны во внешнюю цепь, их пополнение осуществляется в результате окисления анионов или молекул воды. При этом анионы бескислородных кислот при их достаточной концентрации окисляются довольно легко. Если же раствор содержит анионы кислородсодержащих кислот (SO4 2- , NO3 — , СО3 2- , PO4 3- и др.), то на аноде окисляются не эти ионы, а молекулы воды.
В зависимости от рН растворов окисление воды протекает по разному. В щелочной среде имеет место реакция 4ОН — — 4е = О2 + 2Н2О.
В кислой или нейтральной среде 2Н2О + 4е = O2 + 4Н + .
В рассматриваемых случаях электрохимическое окисление воды является энергетически наиболее выгодным процессом. Кислородсодержащие анионы или не способны окисляться, или их окисление протекает при очень высоких потенциалах. Например, потенциал окисления ионов SО4 2-
равен 2,01 В, что значительно превышает потенциал окисления воды 1,23 В.
В случае нерастворимого анода электроны во внешнюю цепь посылает сам анод. Растворимые аноды изготавливают из меди, серебра, цинка, кадмия и др.
Рассмотрим несколько примеров электролиза водных растворов электролитов. Электролиз концентрированного раствора иодида калия с угольными электродами.
В растворе находятся гидротированные ионы К + и J — , а так же молекулы воды. При прохождении тока через раствор катионы К + движутся к катоду, анионы J — — к аноду. Однако реакции, протекающие на электродах, существенно отличаются от реакций, идущих в расплаве соли. Так, на катоде вместо ионов калия (в ряду напряжений он находится до алюминия) восстанавливаются молекулы воды. Схема электролиза раствора КJ с угольными электродами представлена на рисунке.
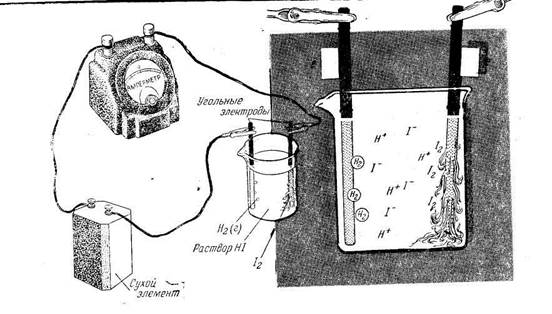
Схема процесса электролиза КJ (раствора)
Схема электролиза КJ → К + + J —
Суммарная схема процесса электролиза 2 КJ + 2Н2О → Н2↑ + 2КOH + J2↑.
В результате электролиза на катоде выделяется водород на аноде — йод, в прикатодном пространстве накапливается гидроксид калия.
Электролиз раствора сульфата калия с угольными электродами. Поскольку калий в ряду напряжений стоит значительно раньше водорода, то у катода будет восстанавливаться вода, выделяться водород и накапливаться ионы ОН — . У анода выделяется кислород и накапливаются ионы Н + . При перемешивании раствора он будет нейтральным. Схема электролиза

Суммарная схема процесса электролиза
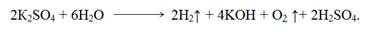
Электролиз водного раствора сульфата калия сводится к электролизу воды
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Схема электролиза на катоде для серебра

димон
Форумчанин
Сообщений: 51
Темы: 3
Понравилось другим: 1 в 1 постах
Понравилось самому: 0
У нас с: Jan 2014
#1
16-01-2014, 14:40 (Последний раз сообщение было отредактировано 06-03-2021, 20:09 пользователем Сергей.)
Ребята подскажите как правильно сделать электролит для электролиза серебра(азотно кислый)

Колобок
Стал неадекватен и посему выдворен
Сообщений: 1,718
Темы: 38
Понравилось другим: 193 в 192 постах
Понравилось самому: 0
У нас с: Jan 2014
#2
16-01-2014, 15:07
И.Н.Масленицкий «Металлургия благородных металлов». 315 стр.
Серебро 120-150 г/л.
Азотная кислота 5-20 г./л.
Напряжение 1-2.5 В.
Сила тока 250-400 А/м.кв.

димон
Форумчанин
Сообщений: 51
Темы: 3
Понравилось другим: 1 в 1 постах
Понравилось самому: 0
У нас с: Jan 2014
#3
16-01-2014, 15:13
Пять раз перечитал этот раздел и сделал следующее. Взял 500мл Азотки разбавил водой 1:1 и растворил в растворе 400гр Ag потом что получилось разбавил до 4х литров профильтровал. Скажите правильно я сделал электролит. Зарание спасибо.

Колобок
Стал неадекватен и посему выдворен
Сообщений: 1,718
Темы: 38
Понравилось другим: 193 в 192 постах
Понравилось самому: 0
У нас с: Jan 2014
#4
16-01-2014, 15:30
Не правильно. Много кислоты, мало серебра.

димон
Форумчанин
Сообщений: 51
Темы: 3
Понравилось другим: 1 в 1 постах
Понравилось самому: 0
У нас с: Jan 2014
#5
16-01-2014, 16:26
но а как правильно? я думаю что свободной азотки не осталось раствор упарил в двое

Колобок
Стал неадекватен и посему выдворен
Сообщений: 1,718
Темы: 38
Понравилось другим: 193 в 192 постах
Понравилось самому: 0
У нас с: Jan 2014
#6
16-01-2014, 16:56
Ну то что упарил вовсе не означает, что там нет большого избытка. Упаривай до кристаллов нитратов серебра, потом разбавляй по нормативам. Из расчёта 400 гр. серебра, это примерно на 2.5 л. Посчитать вроде не трудно.
Я не знаю, что будет если азотку мочевиной загасить, а так бы можно было и мочевиной.

woshod
Сфинкс
Сообщений: 569
Темы: 25
Понравилось другим: 25 в 25 постах
Понравилось самому: 11
У нас с: Jan 2014
#7
16-01-2014, 17:30
NeMonstr . Упаривай до кристаллов нитратов серебра, .
а не долбанет?

Колобок
Стал неадекватен и посему выдворен
Сообщений: 1,718
Темы: 38
Понравилось другим: 193 в 192 постах
Понравилось самому: 0
У нас с: Jan 2014
#8
16-01-2014, 17:31
Нет, почему?

димон
Форумчанин
Сообщений: 51
Темы: 3
Понравилось другим: 1 в 1 постах
Понравилось самому: 0
У нас с: Jan 2014
#9
16-01-2014, 18:07
а почему в 2.5 литра ведь серебра 400 гр значит в 4 литрах разводить и получится 100 г/л прошу прощения но я не знаю по какой формуле считать кислоту и метал для расчета грамм на литр поэтому и прошу помощи
ВКЦ 
Дед Мазай что ли? 






Сообщений: 3,207
Темы: 258
Понравилось другим: 200 в 181 постах
Понравилось самому: 147
У нас с: Nov 2016
#10
16-01-2014, 21:11
Цитата: Теория без практики мертва, практика без теории слепа

с теорией вам помогли, а теперь ваша очередь — пробуйте !
Источник: alhimika.net
§ 18.8. Электролиз
Если в раствор или расплав электролита опустить электроды и пропустить постоянный электрический ток, то ионы будут двигаться направленно: катионы — к катоду (отрицательно заряженному электроду), анионы — к аноду (положительно заряженному электроду).
На катоде катионы принимают электроны и восстанавливаются, на аноде анионы отдают электроны и окисляются. Этот процесс называют электролизом.
| Электролиз — это окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита. |
Простейший пример таких процессов — электролиз расплавленных солей.
Рассмотрим процесс электролиза расплава хлорида натрия (рис. 46).

Рис. 46.
Схема электролиза расплава хлорида натрия(анодное и катодное пространства разделены диафрагмой)
В расплаве идет процесс диссоциации:

Под действием электрического тока катионы натрия Na + движутся к катоду и принимают от него электроны:

Хлорид-анионы С1 — движутся к аноду и отдают электроны:

Суммарное уравнение процессов:

На катоде образуется металлический натрий, на аноде — газообразный хлор.
Главное, что вы должны помнить: в процессе электролиза за счет электрической энергии осуществляется химическая реакция, которая самопроизвольно идти не может.
Сложнее дело обстоит в случае электролиза растворов электролитов.
В растворе соли, кроме ионов металла и кислотного остатка, присутствуют молекулы воды. Поэтому при рассмотрении процессов на электродах необходимо учитывать их участие в электролизе.
Для определения продуктов электролиза водных растворов электролитов существуют следующие правила.
1. Процесс на катоде зависит не от материала катода, из которого он сделан, а от положения металла (катиона электролита) в электрохимическом ряду напряжений, при этом если:
1.1. Катион электролита расположен в ряду напряжений в начале ряда (по Аl включительно), то на катоде идет процесс восстановления воды (выделяется водород Н2↑). Катионы металла не восстанавливаются, они остаются в растворе.
1.2. Катион электролита находится в ряду напряжений между алюминием и водородом, то на катоде восстанавливаются одновременно и ионы металла, и молекулы воды.
1.3. Катион электролита находится в ряду напряжений после водорода, то на катоде восстанавливаются катионы металла.
1.4. В растворе содержатся катионы разных металлов, то сначала восстанавливается катион металла, стоящего в ряду напряжений правее.
2. Процесс на аноде зависит от материала анода и от природы аниона (схема 11).
2.1. Если анод растворяется (железо, цинк, медь, серебро и все металлы, которые окисляются в процессе электролиза), то окисляется металл анода, несмотря на природу аниона.
2.2. Если анод не растворяется (его называют инертным — графит, золото, платина), то:
а) при электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идет процесс окисления аниона;
б) при электролизе растворов солей кислородсодержащих кислот и фторидов на аноде идет процесс окисления воды (выделяется 02Т). Анионы не окисляются, они остаются в растворе;

Попробуем применить эти правила в конкретных ситуациях.
Рассмотрим электролиз раствора хлорида натрия, в случае если анод нерастворимый и если анод растворимый.
а) Анод нерастворимый (например, графитовый).
В растворе идет процесс электролитической диссоциации

Суммарное ионное уравнение

Учитывая присутствие ионов Na + в растворе, составляем молекулярное уравнение:

б) Анод растворимый (например, медный).

Если анод растворимый, то металл анода будет окисляться:

Катионы Cu 2+ в ряду напряжений стоят после (Н + ), поэтому они и будут восстанавливаться на катоде.

Концентрация хлорида натрия NaCl в растворе не изменяется.
Рассмотрим электролиз раствора сульфата меди (II) на нерастворимом аноде:

Суммарное ионное уравнение:


Суммарное молекулярное уравнение с учетом присутствия анионов в растворе:

(серная кислота образуется в анодном пространстве).
Рассмотрим электролиз раствора гидроксида калия на нерастворимом аноде:

Суммарное ионное уравнение:

Суммарное молекулярное уравнение:

В данном случае идет только электролиз воды. Аналогичный результат получим и в случаях электролиза растворов серной кислоты H2SO4, нитрата натрия NaNO3, сульфата калия K2SO4 и др.
- Для получения металлов (алюминий, магний, натрий, кадмий получают только электролизом).
- Для получения водорода, галогенов, щелочей.
- Для очистки металлов — рафинирования (очистку меди, никеля, свинца проводят электрохимическим методом).
- Для защиты металлов от коррозии — нанесения защитных покрытий в виде тонкого слоя другого металла, устойчивого к коррозии (хрома, никеля, меди, серебра, золота), — гальваностегия (рис. 47).
Источник: tepka.ru