Задача 57.
Напишите электронно-графическую формулу для элементов 5-го периода, определите их валентные электроны и охарактеризуйте их с помощью квантовых чисел.
Решение:
Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nl x , где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение – s, p, d, f), x – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n+1 (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
а) Элемент № 37
Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.И. Менделеева, то для 37 элемента — рубидия (Rb – порядковый № 37) электронная формула имеет вид:
Вот как надо чистить Уши 
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4р 6 5s 1
Валентный электрон рубидия 5s 1 — находятся на 5s-подуровне На валентной орбитали атома Rb находится 1 электрон. Поэтому элемент помещают в первую группу периодической системы Д.И.Менделеева.
б) Элемент № 38
Для элемента № 38 — стронция (Sr – порядковый № 38) электронная формула имеет вид:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4р 6 5s 2
Валентные электроны кальция 5s 2 — находятся на 5s-подуровне На валентной орбитали атома Sr находятся 2 электрона. Поэтому элемент помещают во вторую группу периодической системы Д.И.Менделеева.
в) Элемент № 39
Для элемента № 39 — иттрия (Y – порядковый № 39) электронная формула имеет вид:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4р 6 5s 2 4d 1
Валентные электроны иттрия 5s 2 4d 1 — находятся на 5s- и 4d-подуровнях. На валентных орбиталях атома Y находится 3 электрона. Поэтому элемент помещают в третью группу периодической системы Д.И.Менделеева.
г) Элемент № 40
Для элемента № 40 — цирконий (Ti – порядковый № 40) электронная формула имеет вид:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4р 6 5s 2 4d 2
Валентные электроны циркония 5s 2 4d 2 — находятся на 5s- и 4d-подуровнях. На валентных орбиталях атома Zr находится 4 электрона. Поэтому элемент помещают в четвертую группу периодической системы Д.И.Менделеева.
д) Элемент № 41
Для элемента № 41 — ниобия (Nb – порядковый № 41) электронная формула имеет вид:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4р 6 5s 1 4d 4
Валентные электроны ниобия 5s 1 4d 4 — находятся на 5s- и 4d-подуровнях. На валентных орбиталях атома Nb находится 5 электронов. Поэтому элемент помещают в пятую группу периодической системы Д.И.Менделеева. Ниобий в обычных условиях проявляет валентность рпаную 5, поэтому для атома энергетически выгодным является когда все 5 валентных электронов находятся по одному в ячейках 5s- и 4d-подуровнях. Таким образом, в атоме ниобия один s-электрон с 5s-подуровня «проваливается» на 4d-подуровень.
е) Элемент № 42 — молибден (Mo – порядковый № 42) электронная формула имеет вид:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4р 6 5s 1 4d 5
Валентные электроны молибдена 5s 1 4d 5 — находятся на 5s- и 4d-подуровнях. На валентных орбиталях атома Мо находится 6 электронов. Поэтому элемент помещают в шестую группу периодической системы Д.И.Менделеева.
У атома молибдена один электрон с 5s-подуровня переходит на 4d-подуровень и при этом атом молибдена приобретает более устойчивое состояние 5s 1 4d 5 , чем 5s 2 4d 4 . Объясняется это тем, что энергетически выгоднее для атома молибдена когда на 4d-подуровне будет находиться не 4 а 5 электронов — все ячейки заполнены по одному электрону. Таким образом, атому молибдена энергетически выгоднее валентная электроная конфигурация 5s 1 4d 5 , а не 5s 2 4d 4 .
ж) Элемент № 43 — технеций (Тс – порядковый № 43) электронная формула имеет вид:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4р 6 5s 2 4d 5
Валентные электроны технеция 5s 2 4d 5 — находятся на 5s- и 4d-подуровнях. На валентных орбиталях атома Тс находится 7 электронов. Поэтому элемент помещают в седьмую группу периодической системы Д.И.Менделеева.
з) Элемент № 44 — рутений (Ru – порядковый № 44) электронная формула имеет вид:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4р 6 5s 1 4d 7
Валентные электроны рутения 5s 2 4d 7 — находятся на 4s- и 3d-подуровнях. На валентных орбиталях атома Ru находится 8 электронов. Поэтому элемент помещают в восьмую группу периодической системы Д.И.Менделеева. Рутений в соединениях проявляет валентность 4, что указывает на то что в атоме рутения имеетсся 4 неспаренных элелтрона, один на последнем 5s-подуровне и три — на 4d-подуровне. Поэтому энергетически выгодной электронной конфигурацией валентных оболчек атома рутения является 5s 1 4d 7 . а не 5s 2 4d 6 .
к) Элемент № 45 — родий (Rh – порядковый № 45) электронная формула имеет вид:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4р 6 5s 1 4d 8
Валентные электроны родия 5s 1 3d 8 — находятся на 5s- и 4d-подуровнях. На валентных орбиталях атома Rh находится 9 электронов. Поэтому элемент помещают в девятую группу периодической системы Д.И.Менделеева.
У атома родия также как и у атома рутения наблюдается «провал» одного электрона с 5s-подуровня на 4d-подуровень. Это можно объяснить тем, что в своих соединениях родий в основном проявляет валентность 3, что указывает на то что в атоме родия имеетсся 3 неспаренных элелтрона, один на последнем 5s-подуровне и два — на 4d-подуровне. Поэтому энергетически выгодной электронной конфигурацией валентных оболчек атома рутения является 5s 1 4d 8 . а не 5s 2 4d 7 .
л) Элемент № 46 — палладий (Pd – порядковый № 46) электронная формула имеет вид:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4р 6 5s 0 4d 10
Валентные электроны палладия 4d 10 — находятся на 4d-подуровне. На валентной орбитали атома Pd находится 10 электронов. Поэтому элемент помещают в десятую группу периодической системы Д.И.Менделеева. В электронной оболочке элемента палладия наблюдается провал двух электронов с подуровня 5s на уровень 4d. Электронная конфигурация валентных электронов атома палладия 5s 0 4d 10 энергетически более выгодна, чем конфигурации 5s 1 4d 9 или 5s 2 4d 8 . Таким образом, целиком заполненный 4d-подуровень является энергетически выгодным для атома палладия.
м) Элемент № 47 — серебро (Ag – порядковый № 47) электронная формула имеет вид:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4р 6 5s 1 4d 10
Валентные электроны меди 5s 1 4d 10 — находятся на 5s- и 4d-подуровнях. На валентных орбиталях атома Cu находится 11 электронов. Поэтому элемент помещают в одиннадцатую группу периодической системы Д.И.Менделеева.
У атома серебра наблюдается проскок («провал»): один электрон 5s-подуровня переходит на 4d-подуровень. Это объясняется тем, что состояние атома считается более энергетически выгодным, если на d-подуровне находится не 9, а 10 электронов. Потому что энергетически более выгоднее для атома серебра, когда заполнены все пять d-ячеек на 4d-подуровне, но не тогда когда четыре d-ячейки заполнены, а на пятой только один электрон. Для заполнения пятой d-ячейки 3d-подуровня один электрон 5s-подуровня переходит на 4d-подуровнь, как бы «проваливается». Таким образом, целиком заполненный 4d-подуровень является энергетически выгодным для атома серебра.
н) Элемент № 48 — кадмий (Cd – порядковый № 48) электронная формула имеет вид:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4р 6 5s 2 4d 10
Валентные электроны кадмия 5s 2 4d 10 — находятся на 5s- и 4d-подуровнях. На валентных орбиталях атома Cd находится 12 электронов. Поэтому элемент помещают в двенадцатую группу периодической системы Д.И.Менделеева.
о) Элемент № 49 — индий (In – порядковый № 49) электронная формула имеет вид:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4р 6 5s 2 4d 10 5р 1
Валентные электроны индия 5s 2 4d 10 5р 1 — находятся на 4s-, 4d- и 5р-подуровнях. На валентных орбиталях атома In находится 13 электронов. Поэтому элемент помещают в тринадцатую группу периодической системы Д.И.Менделеева.
п) Элемент № 50 — олово (Sn – порядковый № 50) электронная формула имеет вид:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4р 6 5s 2 4d 10 5р 2
Валентные электроны олова 5s 2 4d 10 5р 2 — находятся на 5s-, 4d- и 5р-подуровнях. На валентных орбиталях атома Sn находится 14 электронов. Поэтому элемент помещают в четырнадцатую группу периодической системы Д.И.Менделеева.
р) Элемент № 51 — сурьма (Sb – порядковый № 51) электронная формула имеет вид:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4р 6 5s 2 4d 10 5р 3
Валентные электроны сурьма 5s 2 4d 10 5р 3 — находятся на 5s-, 4d- и 5р-подуровнях. На валентных орбиталях атома Sb находится 15 электронов. Поэтому элемент помещают в пятнадцатую группу периодической системы Д.И.Менделеева.
с) Элемент № 52 — теллур (Te – порядковый № 52) электронная формула имеет вид:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4р 6 5s 2 4d 10 5р 4
Валентные электроны теллура 5s 2 4d 10 5р 4 — находятся на 5s-, 4d- и 5р-подуровнях. На валентных орбиталях атома Se находится 16 электронов. Поэтому элемент помещают в шестнадцатую группу периодической системы Д.И.Менделеева.
с) Элемент № 53 — йод (I – порядковый № 53) электронная формула имеет вид:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4р 6 5s 2 4d 10 5р 5
Валентные электроны йода 5s 2 4d 10 5р 5 — находятся на 5s-, 4d- и 5р-подуровнях. На валентных орбиталях атома I находится 17 электронов. Поэтому элемент помещают в семнадцатую группу периодической системы Д.И.Менделеева.
т) Элемент № 54 — ксенон (Xe – порядковый № 54) электронная формула имеет вид:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4р 6 5s 2 4d 10 5р 6
Валентные электроны ксенона 5s 2 4d 10 5р 6 — находятся на 5s-, 4d- и 5р-подуровнях. На валентных орбиталях атома Xe находится 18 электронов. Поэтому элемент помещают в восемнадцатую группу периодической системы Д.И.Менделеева.
- Вы здесь:
- Главная

- Задачи

- Общая химия

- Строение атомов d-элементов. Задачи 37 — 38
Источник: buzani.ru
Медь серебро и их соединения Электронно-графическая формула

Блестящий, серебристо-белый, мягкий и пластичный металл. Самый электропроводный среди всех металлов.

Нахождение в природе.


Халькозин (медный блеск) Cu 2 S

Халькопирит (Fe. Cu. S 2)

Малахит (Cu. OH)2 CO 3

Аргентит (серебряный блеск) Ag 2 S

Способы получения: 2 Cu. S + 3 O 2 → 2 Cu. O + 2 SO 2 Cu. O + C → Cu + CO Ag 2 S + O 2 → Ag + SO 2
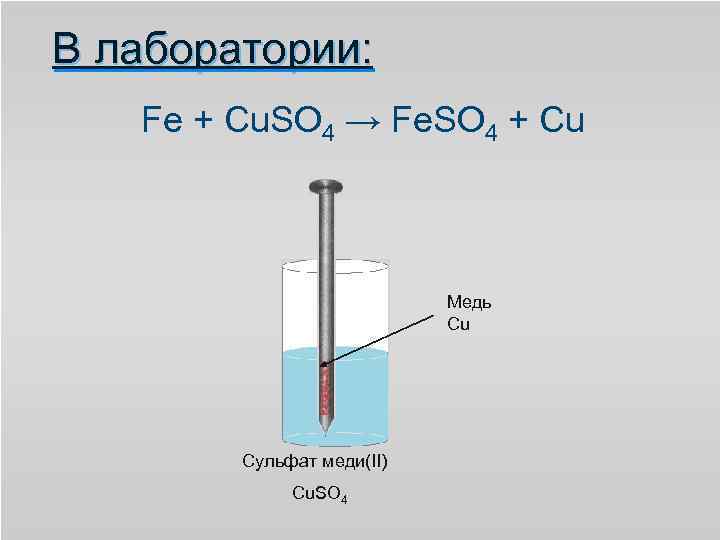
В лаборатории: Fe + Cu. SO 4 → Fe. SO 4 + Cu Медь Cu Сульфат меди(II) Cu. SO 4


Взаимодействие с простыми веществами: Cu + Cl 2 → Cu. Cl 2 Cu + S → Cu. S 2 Cu + S → Cu 2 S 2 Cu + O 2 → 2 Cu. O 4 Cu + O 2 → 2 Cu 2 O (при 400°С) (при t > 400°С) (t=400 — 500°C) (t >1000°C)

Взаимодействие с кислотами: Cu + HCl ≠ Cu + H 2 SO 4(разб. ) ≠ Cu + 2 H 2 SO 4(конц. ) → Сu. SO 4 + SO 2↑ + 2 H 2 O

Взаимодействие с кислотами: 3 Cu + 8 HNO 3(разб. ) → 3 Сu(NO 3)2 + 2 NO↑ + 4 H 2 O Cu + 4 HNO 3(конц. ) → Сu(NO 3)2 + 2 NO 2↑ + 2 H 2 O

Взаимодействие меди с концентрированной азотной кислотой.

Закончите уравнения реакций: Ag + Cl 2 → Ag + S → Ag + HCl → Ag + H 2 SO 4(разб. ) → Ag + H 2 SO 4(конц. ) → Ag + HNO 3(разб. ) → Ag + HNO 3(конц. ) →

2 Cu + H 2 O + CO 2 + O 2 → (Cu. OH)2 CO 3

4 Ag + 2 H 2 S + O 2 → 2 Ag 2 S + 2 H 2 O


Оксид меди (I) Сu 2 O – твердое вещество оранжево-красного цвета Проявляет основные свойства. Гидроксид меди (I) Cu. OH неустойчив.

Оксид меди (II) Сu. O – твердое вещество черного цвета

Получение оксида меди (II): Cu(OH)2 → Cu. O + H 2 O 2 Сu(NO 3)2 → 2 Cu. O + 4 NO 2↑ + O 2↑ (Cu. OH)2 CO 3 → 2 Cu. O + CO 2↑ + H 2 O

Оксид меди (II) проявляет основные свойства: Cu. O + 2 HNO 3 → → Cu(NO 3)2 + H 2 O

Гидроксид меди (II). Cu. O + H 2 O ≠ Cu. SO 4 + 2 Na. OH → → Cu(OH)2↓ + Na 2 SO 4 Cu(OH)2 + 2 HNO 3 → → Cu(NO 3)2 + 2 H 2 O

Окислительные свойства оксида и гидроксида меди (II): Cu. O + H 2 → Cu + H 2 O 2 Cu(OH)2 + CH 3 COH → → Cu 2 O↓ + CH 3 COOH + 2 H 2 O

Ø Кристаллогидрат Сu. SO 4· 5 H 2 O Ø Безводный Сu. SO 4

Гидролиз солей меди (II): Cu. SO 4 + 2 H 2 O ↔ H 2 SO 4 + Cu(OH)2↓ Cu 2+ + SO 42 — + 2 H 2 O ↔ 2 H+ + SO 42 — + Cu(OH)2↓ Cu 2+ + 2 H 2 O ↔ 2 H+ + Cu(OH)2↓ среда кислая

Качественные реакции на катионы Cu 2+: Cu. SO 4 + 4 NH 4 OH → [Cu(NH 3)4]SO 4 + 4 H 2 O синий раствор сульфат тетраамминмеди (II) 2 Cu. SO 4 + K 4[Fe(CN)6] → Cu 2[Fe(CN)6]↓ + 2 K 2 SO 4 красно-бурый осадок гексацианоферрат меди (II)


Оксид серебра (I) Ag 2 O – темно-коричневый порошок. Обладает основными свойствами. 2 Ag. NO 3 + 2 Na. OH → → Ag 2 O + 2 Na. NO 3 + H 2 O

Растворяется в гидроксиде аммония: Ag 2 O + 4 NH 4 OH → → 2[Ag(NH 3)2]OH + 3 H 2 O Используется для реакции «серебряного зеркала» .

Качественные реакции на катион Ag+: Ag. NO 3 + HCl → Ag. Cl↓ + HNO 3 белый творожистый осадок Растворяется в избытке аммиака: Ag. Cl + 2 NH 4 OH → → [Ag(NH 3)2]Cl + 2 H 2 O хлорид диамминсеребра (I)

Качественные реакции на катион Ag+: Ag. NO 3 + KI → Ag. I↓ + KNO 3 светло-желтый осадок

Качественные реакции на катион Ag+: 2 Ag. NO 3 + Na 2 S 2 O 3 → Ag 2 S 2 O 3↓ + 2 Na. NO 3 белый осадок Ag 2 S 2 O 3 + H 2 O → Ag 2 S↓ + H 2 SO 4 черный осадок

Качественные реакции на катион Ag+: 2 Ag. NO 3 + K 2 Cr. O 4 → Ag 2 Cr. O 4↓ + 2 KNO 3 кирпично-красный осадок 2 Ag. NO 3 + 2 KOH → Ag 2 O↓ + H 2 O + 2 KNO 3 грязно-коричневый осадок

Роль меди в организме: Содержание в организме – 150 мг. Входит в состав: Ø Дыхательных ферментов; Ø Белков, участвующих в переносе кислорода кровью. Недостаток – болезнь Менкеса; Избыток – болезнь Вильсона-Коновалова.

Применение в медицине и фармации: Сульфат меди (II) Cu. SO 4 : Ø Антисептическое, вяжущее средство. Ø Используется при коньюнктивитах и заболеваниях органов мочеполовой системы.

Применение в медицине и фармации: Нитрат серебра (ляпис) Ag. NO 3 : Ø Вяжущее и противовоспалительное действие; Ø Прижигающее действие; Протаргол – коллоидный раствор протеината серебра: Ø Антисептическое и противовоспалительное средство; Ø Орошают слизистые оболочки глаз, органов дыхательной и мочеполовой системы.
Источник: present5.com
Схема электронного строения серебра


webkonspect.com — сайт, с элементами социальной сети, создан в помощь студентам в их непростой учебной жизни.
Здесь вы сможете создать свой конспект который поможет вам в учёбе.
Чем может быть полезен webkonspect.com:
- простота создания и редактирования конспекта (200 вопросов в 3 клика).
- просмотр конспекта без выхода в интернет.
- удобный текстовый редактор позволит Вам форматировать текст, рисовать таблицы, вставлять математические формулы и фотографии.
- конструирование одного конспекта совместно с другом, одногрупником.
- webkonspect.com — надёжное место для хранения небольших файлов.
Обзор сайта:
Источник: webkonspect.com