Составьте схему гальванического элемента, имея в расположении Sn, Ag, SnCl2, AgNo3 (стандартные условия )
укажите анод и катод, составьте уравнение электродных процессов, суммарное уравнение реакции.
рассчитайте E0 и Am элемента.
Как изменится значение эдс при концентрации ионов sn2+ равное 0.01 мольл
Липницкая Светлана
В гальваническом элементе анодом становится металл, обладающего меньшим значением электродного потенциала, а катодом – металл с большим значением электродного потенциала. Серебро в электрохимическом ряду напряжений стоит правее, чем олово, следовательно, серебро имеет большее значение электродного потенциала восстановления, чем олово.
Ео (Sn(2+)/Sn) = − 0,136 B
Ео (Ag(+)/Ag) = + 0,799 В
Ео (Ag(+)/Ag) > Ео (Sn(2+)/Sn)
Значит, в данном гальваническом элементе олово будет анодом, а серебро – катодом.
На аноде протекает процесс окисления металла, а на катоде – процесс восстановления металла.
Процессы окисления-восстановления на электродах.
«Электричество из цинка и графита» — Михаил Введенский
Анод (-) Sn(0) — 2е → Sn(2+) │1 — процесс окисления на аноде
Катод (+) Ag(+) + е → Ag(0) │2 — процесс восстановления на катоде
Суммируя реакции на аноде и катоде, получаем уравнение, которое в ионной форме, выражает происходящую в элементе реакцию.
Sn + 2Ag(+) → 2Ag↓ + Sn(2+)
Уравнение токообразующей реакции в молекулярном виде
Sn + 2AgNO3 → Sn(NO3)2 + 2Ag↓
Поскольку в условии оговорены стандартные условия, то электроды опущены в одномолярные растворы своих солей.
Схема гальванического элемента
А (-) | Sn | SnCl2 (1M) || AgNO3 (1M) | Ag | К (+)
Стандартная ЭДС гальванического элемента.
ЭДСо = Ео (катода) – Ео (анода) = Eo(Ag(+)/Ag) – Eo(Sn(2+)/Sn) = + 0,799 – (– 0,136) = 0,935 В
Стандартная ЭДС гальванического элемента соответствует молярной концентрации ионов Ag(2+) и Sn(2+) в растворах электролитах равной 1 моль/л.
Изменение энергии Гиббса.
∆G = − zFE = − 2*96500*0,935 = − 180455 Дж = − 180,455 кДж
z = 2 – число электронов, принявших участие в окислительно-восстановительной реакции.
F = 96500 Кл/моль – постоянная Фарадея
E = 0,935 В — ЭДС окислительно-восстановительной реакции, равная ЭДС гальванического элемента
Максимальная работа гальванического элемента Amax при превращении 1 моль вещества.
Amax = – ∆G = 180,455 кДж
Посчитаем электродный потенциал анода при молярной концентрации ионов [Sn(2+)] = 0,01 моль/л по уравнению Нернста при 298 градусах Кельвина.
Е (анода) = E(Sn(2+)/Sn) = Eo(Sn(2+)/Sn) + (0,059/2)*lg[Sn(2+)] = – 0,136 + 0,0295*lg0,01 = – 0,136 – 0,0295*2 = – 0,195 В
ЭДС гальванического элемента.
Е = Ео (катода) – Ео (анода) = Eo(Ag(+)/Ag) – Eo(Sn(2+)/Sn) = + 0,799 – (– 0,195) = 0,994 В
ЭДС гальванического элемента увеличилась на величину 0,059 В.
ЭДС гальванического элемента будет увеличиваться как при увеличении молярной концентрации ионов Ag(+), так и при уменьшении молярной концентрации ионов Sn(2+).
6 ИСТОЧНИКОВ ПИТАНИЯ СВОИМИ РУКАМИ
Источник: sprashivalka.com
Электродные потенциалы и гальванические элементы
Гальваническим элементом называется многофазная система, состоящая по меньшей мере из двух электродов (полуэлементов). В качестве примера рассмотрим цинк-серебряный гальванический элемент (рис. 1), состоящий из цинкового и серебряного полуэлементов.
Гальванический элемент (рис.1) состоит из растворов, содержащих ионы Zn 2+ и Ag + , разделенных пористой диафрагмой для того, чтобы обеспечить протекание тока без смешения растворов. В каждый из растворов опущен электрод из соответствующего металла. Границу раздела фаз металл – раствор обозначают символом «/», а электролитический контакт растворов – «//». Таким образом, схему рассматриваемого элемента можно представить в виде
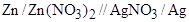
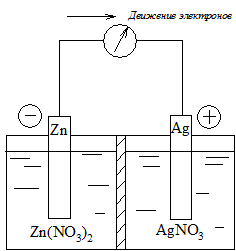
Рис. 1. Схема цинк-серебряного гальванического элемента
В цинковом полуэлементе протекает реакция окисления, электрод называют анодом. При протекании тока масса анода уменьшается за счет его растворения.
В серебряном полуэлементе протекает реакция восстановления, электрод называют катодом. При протекании тока масса катода увеличивается за счет осаждения на его поверхности металла.
Суммарная реакция получается сложением полурекций:
Zn + 2Ag + «Zn 2+ + 2 Ag
Направление протекания самопроизвольного процесса, можно определить из величин электродных потенциалов полуэлементов.
Электродный потенциал это разность потенциалов гальванического элемента, состоящего из исследуемого электрода и электрода сравнения, при условии, что ток во внешней цепи стремится к нулю. Измеренную в таких условиях разность потенциалов называют электродвижущей силой (коротко – э.д.с.).
Стандартным электродом сравнения служит стандартный водородный электрод. Это газовый электрод, состоящий из платиновой проволоки, покрытой слоем платиновой черни, находящийся в атмосфере водорода под давлением 1,013×10 5 Па (1 атм) и погруженный в раствор с активностью ионов Н + равной 1,0 моль/дм 3 . В соответствии с международным соглашением потенциал такого электрода условно принят за нуль при любых температурах.
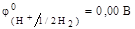
Таким образом, для измерения электродного потенциала необходимо собрать гальванический элемент, состоящий из исследуемого электрода (всегда записывают справа) и стандартного водородного электрода (всегда записывают слева). Например, для цинкового электрода
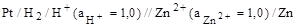
Э.д.с. такого гальванического элемента, называют стандартным электродным потенциалом если измерения проводят при стандартных условиях (активности всех компонентов равны 1,00 моль/дм 3 , Т = 298 К)
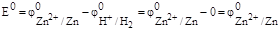
.
Уравнение Нернста. Потенциал электрода зависит от состава электролита и температуры в соответствии с уравнением Нернста:
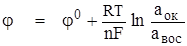
где φ – потенциал в Вольтах, φ о -стандартный электродный потенциал; aок, aвос – активности потенциалопределяющих ионов в окисленном и восстановленном состоянии; n – число электронов, принимающих участие в данной электродной реакции; F = 96480 Кл/моль (постоянная Фарадея); R — универсальная газовая постоянная; Т – температура, К.
При Т = 298 К для металлических электродов уравнение Нернста имеет вид:
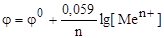
Опыт 1. Изготовление и изучение работы медно-цинкового
гальванического элемента
Реактивы и оборудование. Гальванометр или цифровой вольтметр; химические стаканы на 50 см 3 ; медная и цинковая пластины; электролитический мост, электрические провода, раствор ZnSO4 1,0 М; раствор CuSO4 1,0 М.
Выполнение работы. Собрать медно-цинковый гальванический элемент (элемент Даниэля) в соответствии со схемой Zn/ZnSO4//CuSO4/Cu. Конструкция прибора схематично представлена на рис. 1. Для этого в стаканы налить растворы солей меди и цинка, поместить в них соответствующие электроды и соединить растворы электролитическим мостом. Подключить во внешнюю цепь вольтметр и наблюдать протекание электрического тока.
Запись данных опыта. Зарисовать прибор, составить схему гальванического элемента (см. рис 1), рассчитать ЭДС гальванического элемента по плану:
1. Определить стандартные потенциалы меди и цинка (табл. П. 1), записать уравнения электродных процессов и суммарную реакцию.
2. Указать катод и анод, их заряды, направление движения электронов во внешней цепи и ионов в растворе.
3. Рассчитать э.д.с. стандартного медно-цинкового гальванического элемента.
Источник: infopedia.su
лабораторная. Лабораторная работа. Гальванический элемент

Единственный в мире Музей Смайликов
Самая яркая достопримечательность Крыма

Скачать 30.38 Kb.
Лабораторная работа.
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ.
ЭЛЕКТРОЛИЗ ВОДНЫХ РАСТВОРОВ
Цель работы :
изучение принципа действия гальванического элемента и процессов электролиза водных растворов некоторых солей.
Выполнение работы.
Опыт 1. Изготовление медно − цинкового гальванического элемента
В один микростаканчик налейте почти доверху 1 М раствор сульфата цинка и опустите цинковый стержень, в другой налейте 1 М раствор сульфата меди(II) и опустите медный стержень. Соедините растворы электролитическим ключом, заполненным насыщенным раствором хлорида калия, а опущенные стержни – проводником первого рода с гальванометром. Наблюдайте отклонение стрелки последнего, указывающее на возникновение электрического тока, обусловленного различной величиной электродных потенциалов цинка и меди.
Запишите данные опыта по следующей форме.
Результаты опыта
Е 0 (Cu 2+ /Cu 0 ) = _____ +0,34 В _____ В
Опыт 2. Электролиз водных растворов солей с нерастворимым анодом
Опыты по электролизу водных растворов как с нерастворимыми (инертными) электродами, так и с растворимым анодом проводите в электролизере, представляющем собой U-образную трубку высотой 5 – 6 см и диаметром 0,6 см.
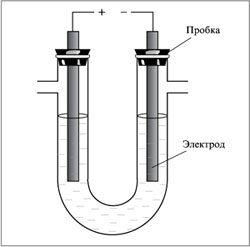
Рисунок 1. Общая схема электролизера.
Электродами служат графитовые стержни и кусочки проволоки из соответствующих металлов, вставленные в резиновые пробки (рисунок 1). Пробки в электролизер вставляйте неплотно. Источником тока является ток от сети, поданный через выпрямитель. Во всех опытах электролизер заполните раствором электролита на 2/3 своего объема и закрепите в штативе. Электролизер и электроды перед каждым опытом тщательно промывайте дистиллированной водой.
Заполните электролизер раствором хлорида олова (II). В оба колена опустите графитовые электроды и соедините их с источником постоянного тока. Через 3 – 4 мин пропускания тока выньте из электролизера графитовый анод, прибавьте в раствор 3 – 4 капли раствора иодида калия и столько же крахмального клейстера и наблюдайте изменение окраски раствора. Запишите данные опыта по следующей форме.
Результаты опыта
Налейте в пробирку на 3/4 ее объема раствор иодида калия и добавьте по 5 – 6 капель фенолфталеина и крахмального клейстера. Перемешайте раствор и перелейте в электролизер. Опустите в оба колена электролизера графитовые электроды и подключите их к источнику постоянного тока. Запишите результаты опыта по следующей форме.
Результаты опыта
Налейте в электролизер раствор сульфата меди. Опустите в одно колено электролизера графитовый электрод и соедините его с катодом постоянного источника тока. В другое колено опустите медный электрод и присоедините его к положительному полюсу (анод). Запишите результаты опыта по следующей форме.
Результаты опыта
Задания для самоконтроля
- Составьте схемы двух гальванических элементов, в одном
из которых никель является катодом, в другом — анодом. Напишите уравнения процессов, протекающих во время работы элементов, и вычислите ЭДС при использовании 1 М растворов солей.
- Какие процессы происходят на электродах цинкового концентрационного гальванического элемента, если один из них погружен в 1М раствор сульфата цинка, а другой – в 10 ─3 М раствор сульфата цинка? В каком направлении движутся электроны во внешней цепи? Составьте схему данного гальванического элемента и рассчитайте его ЭДС.
- Составьте электронные уравнения процессов, происходящих на электродах при электролизе: а) раствора серной кислоты (анод − железный); б) расплава нитрата серебра (электроды угольные). Сколько литров газа выделится в варианте “б”, если электролиз проводить в течение 30 мин при силе тока 13 А? Выход по току составляет 91 %.
Источник: topuch.com