7.3. Гальванический элемент Якоби-Даниэля. ЭДС Превращение химической энергии в электрическую происходит в электрохимических системах, которые называются гальваническими элементами. Гальванический элемент представляет собой замкнутую электрохимическую систему, состоящую из двух электродов. Рассмотрим гальванический элемент Якоби-Даниэля.
Он состоит из медной пластины, погруженной в раствор CuSC4, и цинковой пластины, погруженной в раствор ZnSC4. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой. Схема гальванического элемента: Zn | ZnSO4| | CuSO4| Cu, Zn | Zn 2+ | | Cu 2+ | Cu. На поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие: Zn-2e « Zn 2+ .
Рекомендуемые материалы
Химические свойства p-элементов (Al,Sn,Pb)
299 140 руб.
Химические свойства p-элементов (Al,Sn,Pb)
199 90 руб.
Химические свойства p-элементов (Al,Sn,Pb)
199 90 руб.
Задача 49В задачах (45-58) объясните изменение радиуса в указанном ряду атомов элементов. Составьте полные
Химические процессы, происходящие в аккумуляторах. 10 класс.
Определите энтальпию образования диборана B2H6(г) при T = 298 К из следующих данных: B2H6(г) + 3O2(г) = B2O3(тв) + 3H2O(г), H1°= -2035,6 кДж/моль; 2B(тв) + 3/2 O2(г) = B2O3(тв), H2° = -1273,5 кДж/моль; H2(г) + 1/2 O2(г) = H2O(г), H3° = -241,8 кДж/
В результате протекания этого процесса возникает электродный потенциал цинка. На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие: Сu 2+ + 2е « Сu, поэтому возникает электродный потенциал меди.
Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, поэтому при замыкании внешней цепи, т. е. при соединении цинка с медью метал лическим проводником, электроны будут переходить от цинка к меди. Таким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде.
Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы электродов или не растворится весь цинк (или не высадится на медном электроде вся медь). Итак, при работе элемента Якоби-Даниэля протекают следующие процессы: 1) реакция окисления цинка: Zn — 2е ® Zn 2+.
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами; 2) реакция восстановления ионов меди: Сu 2+ + 2е « Сu. Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами; движение электронов во внешней цепи; движение ионов в растворе: анионов (SO4 -2 ) к аноду, катионов (Cu 2+ , Zn 2+ ) к катоду.
Движение ионов в растворе замыкает электрическую цепь гальванического элемента. Суммируя электродные реакции, получаем: Zn + Cu 2+ = Zn 2+ + Сu. Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т. е. образуется замкнутая электрическая система и в ней возникает электрический ток.
Химия. Лекция 6. Часть 1. Решение задач на электродные потенциалы и электропроводность растворов.
Суммарная химическая реакция, протекающая в гальваническом элементе, называется токообразующей. Электрический ток, возникающий в данной электрохимической системе, численно характеризуется величиной электродвижущей силы (ЭДС) элемента.
Она равна разности электродных потенциалов катода и анода:  (7.3) В стандартных условиях самопроизвольное протекание химической реакции возможно, когда максимальная полезная работа, совершаемая в результате данной реакции, равна отрицательной величине изменения свободной энергии: А =-DG 0 (7.4) В гальваническом элементе совершаемая максимальная электрическая работа в стандартных условиях равна ЭДС элемента, умноженной на количество электричества (nF), т. е. А = nFE 0 , (7.5) где n — число электронов, участвующих в реакции; F- постоянная Фарадея, равная 96500 Кл/моль; E 0 — стандартная ЭДС гальванического элемента (T= 298 К, молярная концентрация электролитов равна 1 моль/дм 3 ). Таким образом, максимальная работа гальванического элемента равна: А =-DG 0 = nFE 0 . (7.6) Стандартная ЭДС гальванического элемента равна:
(7.3) В стандартных условиях самопроизвольное протекание химической реакции возможно, когда максимальная полезная работа, совершаемая в результате данной реакции, равна отрицательной величине изменения свободной энергии: А =-DG 0 (7.4) В гальваническом элементе совершаемая максимальная электрическая работа в стандартных условиях равна ЭДС элемента, умноженной на количество электричества (nF), т. е. А = nFE 0 , (7.5) где n — число электронов, участвующих в реакции; F- постоянная Фарадея, равная 96500 Кл/моль; E 0 — стандартная ЭДС гальванического элемента (T= 298 К, молярная концентрация электролитов равна 1 моль/дм 3 ). Таким образом, максимальная работа гальванического элемента равна: А =-DG 0 = nFE 0 . (7.6) Стандартная ЭДС гальванического элемента равна:  (7.7) Гальванические элементы в зависимости от природы электродов и концентрации электролитов разделяют на химические и концентрационные. Химические гальванические элементы — это такие элементы, где электроды и электролиты различны.
(7.7) Гальванические элементы в зависимости от природы электродов и концентрации электролитов разделяют на химические и концентрационные. Химические гальванические элементы — это такие элементы, где электроды и электролиты различны.
Примером химического гальванического элемента является элемент Якоби-Даниэля. Концентрационные гальванические элементы — это такие элементы, которые состоят из одинаковых электродов, но концентрации электролитов различны, например, серебряные электроды, погруженные в растворы нитрата серебра разной концентрации: Ag | AgNO3 (0,01 моль/дм3) | | AgNO3 (0,1 моль/дм 3 ) | Ag.
Пример 1. Гальванический элемент состоит из металлического цинка, погруженного в раствор нитрата цинка с молярной концентрацией 0,1 моль/дм 3 , и металлического свинца, погруженного в раствор нитрата свинца с молярной концентрацией 0,02 моль/дм 3 Вычислите ЭДС элемента, напишите уравнения электродных процессов, составьте схему элемента. Решение.
Чтобы определить ЭДС элемента, необходимо вычислить электродные потенциалы по уравнению Нернста (7.2):  Находим ЭДС элемента по формуле (7.3):
Находим ЭДС элемента по формуле (7.3):  Поскольку
Поскольку  , то на свинцовом электроде будет происходить восстановление, т. е. он будет служить катодом: Рb 2+ + 2e = Рb. 36. Оценка результатов труда и вознаграждение в организационном поведении — лекция, которая пользуется популярностью у тех, кто читал эту лекцию. На цинковом электроде будет протекать процесс окисления: Zn = Zn 2+ + 2e, т. е. этот электрод будет анодом. Схема рассматриваемого гальванического элемента имеет следующий вид: А (-) Zn | Zn(NO3)2 | | Pb(NO3)2 | Pb (+) К. Ответ: 0,61 В.
, то на свинцовом электроде будет происходить восстановление, т. е. он будет служить катодом: Рb 2+ + 2e = Рb. 36. Оценка результатов труда и вознаграждение в организационном поведении — лекция, которая пользуется популярностью у тех, кто читал эту лекцию. На цинковом электроде будет протекать процесс окисления: Zn = Zn 2+ + 2e, т. е. этот электрод будет анодом. Схема рассматриваемого гальванического элемента имеет следующий вид: А (-) Zn | Zn(NO3)2 | | Pb(NO3)2 | Pb (+) К. Ответ: 0,61 В.
Источник: studizba.com
Гальванические элементы
Если разделить пространственно процессы окисления и восстановления, то окислительно-восстановительную реакцию можно использовать для получения электрической энергии.
Устройство в котором, химическая энергия превращается в электрическую, называется гальваническим элементом. Гальванический элемент образуется из двух металлов, погруженными в раствор электролитов.
Если соединить эти металлы проводником первого рода (металлический провод), то будет образовываться электрический ток, появляющийся вследствие возникновения окислительно-восстановительного процесса. В гальваническом элементе анодом служит электрод, электродный потенциал которого в данном растворе более электроотрицательный. На аноде происходит окисление.
Катодом служит электрод из менее активного металла. На катоде восстановляются положительные ионы металлов, ионы водорода или нейтральные молекулы. В гальваническом элементе анод обозначается знаком «минус», а катод – знаком «плюс». Гальванический элемент показан на рисунке.
Цинковая пластинка опущена в раствор сульфата цинка, медная — в раствор сульфата меди. Пластинки соединены проводом, растворы разделены пористой перегородкой, чтобы не происходило смешение растворов. Электроны по внешней цепи идут от анода к катоду, а по внутренней цепи анионы SO4 2- перемещаются в растворе от меди к цинку, замыкая электрическую цепь гальванического элемента.
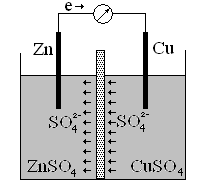
Гальванический элемент записывается в виде электрохимической схемы:
Так как электродный потенциал цинка меньше электродного потенциала меди то цинк будет анодом, а медь – катодом. Цинковая пластинка окисляется, а на поверхности медной пластинки идёт восстановление меди из раствора.
Процессы, протекающие при работе гальванического элемента, следует записать:

K Cu 2+ + 2e = Cu 0
Zn + Cu 2+ = Zn 2+ + Cu
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента. Она равна разности равновесных потенциалов катода и анода:
Для медно-цинкового гальванического элемента в стандартных условиях:
ЭДС = 0,34-(-0,76)=1,1 В
Разность потенциалов образуется не только между разными, но и между одноименными металлами, прогруженными в растворы своих солей с разными концентрациями. Такой гальванический элемент называется концентрационным. Например, никелевый концентрационный гальванический элемент.
Запишем работу такого концентрационного гальванического элемента.
ЭДС = -0,28 – (-0,308) = 0,028 В
Процессы на электродах:
А: Ni 0 — 2е — = Ni 2+
К: Ni 2+ + 2е — = Ni 0
КОНТРОЛЬНЫЕ ЗАДАНИЯ
48. Вычислить ЭДС кадмиево – серебряного гальванического элемента, если концентрация ионов серебра в растворе равна 0,1 моль/л, а ионов кадмия 0,001 моль/л. Напишите уравнения реакций протекающих на электродах.
49. Составьте схемы двух гальванических элементов в одном из которых никель – катод, а в другом анод. Напишите уравнения реакций протекающих при работе этих элементов.
50. Рассчитайте ЭДС гальванического элемента, составленного из железной и свинцовой пластинок, опущенных в 0,1М растворы их солей. Напишите уравнения реакций.
51. Рассчитайте ЭДС концентрационного никелевого гальванического элемента. Концентрация ионов металла в растворах равна 1 моль/л и 0,0001 моль/л. Написать процессы, протекающие на аноде и катоде.
52. Какие процессы происходят у электродов медного коцентрированного гальванического элемента, еслиу одного из электродов концентрация ионов металла равна 1 моль/л, а у другого 0,001 моль/л. в каком направлении движутся электроны во внешней цепи. Чему равна ЭДС?
53. Составьте схему гальванического элемента, состоящего из пластин Zn и Fe погруженных в растворы их солей. Напишите уравнения процессов, протекающих на ионы железа, чтобы ЭДС элемента стала равной нулю при концентрации ионов цинка 0,0001 моль/л.
54. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента, напишите уравнения реакций, протекающих на пластинах.
55. Составьте схему гальванического элемента, состоящего из серебряного электрода, погруженного в 1М раствор нитрата серебра и стандартного водородного электрода. Напишите урaвнения электродных процессов. Чему равна ЭДС элемента?
56. В каком направлении будут перемещаться электроны во внешней цепи следующих гальванических элементов
а) Mg | Mg 2+ | | Pb 2+ | Pb
б) Pb | Pb 2+ | |Cu 2+ | Cu
в) Cu | Cu 2+ | | Ag 2+ | Ag
если все растворы электролитов одномолярные? Какой металл будет растворяться в каждом из этих случаев.
57. Составьте схему гальванического элемента в основе которого лежит реакция, протекающая по уравнению:
Ni + Pb(NO3)2= Ni(NO3)2 + Pb.
Напишите электронные уравнения анодного и катодного процессов, вычислите ЭДС этого элемента при стандартных условиях.
58. ЭДС гальванического элемента, образованного медной пластинкой, погруженной в раствор ее соли с концентрацией ионов меди, равной 0,001 моль/л и хромом, погруженным в раствор его соли равна 1,05 В. определите концентрацию ионов хрома в растворе его соли. Составьте схему гальванического элемента и напишите электронные уравнения электродных процессов.
59. Составьте схему, напишите уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенные в растворы своих солей с концентрацие ионов металлов, равной 1 моль/л. изменится ли ЭДС этого гальванического элемента, если концентрацию каждого из ионов уменьшить до 0,01 моль / л.
60. ЭДС гальванического элемента, состоящего из стандартного водородного электрода и свинцового электрода, погруженного в 1М раствор соли свинца равна 126мВ. При замыкании элемента электроны во внешней цепи перемещаются от свинцового к водородному электроду. Чему равен потенциал свинцового электрода. Составьте схему гальванического элемента и напишите процессы, протекающие на электродах.
61. Какие процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора.
62. Какие процессы протекают на электродах при зарядке и разрядке кадмиево-никелевого аккумулятора.
63. Какие процессы протекают на электродах при зарядке и разрядке железно-никелевого аккумулятора.
64. Составьте схемы двух гальванических элементов в одном из которых хром был бы анодом, а в другом – катодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на электродах.
65. Составьте схему гальванического элемента, состоящего из алюминиевого электрода, погруженного в 1М раствор нитрата алюминия и стандартного водородного электрода. Напишите уравнения электродных процессов и вычислите ЭДС гальванического элемента.
66. В каком направлении будут перемещаться электроны во внешней цепи алюминий – цинкового гальванического элемента. Концентрации ионов в растворах равны 0,1 моль/л. Составьте схему гальванического элемента, напишите уравнения процессов, протекающих на электродах, вычислите ЭДС.
67. В серебряно-цинковом элементе, применяемом для питания различной аппаратуры, протекает реакция
рассчитать стандартную ЭДС, написать уравнение процесса.
Источник: studopedia.su
Составить схему гэ написать уравнения эдс
Решение типовых задач. Пример 1. В ГЭ катодом является висмут
- I Психологические принципы, задачи и функции социальной работы
- I. ГИМНАСТИКА, ЕЕ ЗАДАЧИ И МЕТОДИЧЕСКИЕ ОСОБЕННОСТИ
- I. ЗАДАЧИ ПЕДАГОГИЧЕСКОЙ ПРАКТИКИ
- I. Решение логических задач средствами алгебры логики
- I. Розв’язати задачі
- I. Ситуационные задачи и тестовые задания.
- I. Цель и задачи дисциплины
- II. Основные задачи и функции
- II. Основные задачи и функции
- II. Решение логических задач табличным способом
- II. ЦЕЛИ, ЗАДАЧИ И ПРИНЦИПЫ ДЕЯТЕЛЬНОСТИ ВОИ
- II. Цель и задачи государственной политики в области развития инновационной системы
Пример 1. В ГЭ катодом является висмут. Выберите металл, который может быть анодом. Составьте схему ГЭ. Напишите процессы, протекающие на электродах этого ГЭ, и рассчитайте его ЭДС для стандартных условий.
Пользуясь рядом стандартных электродных потенциалов, выберем металл, который может быть анодом. . Следовательно, любой металл, имеющий меньшее значение φ0, может служить анодом. Например, олово. φ0 Sn2+/ Sn0 = — 0,136 В.
Составим схему ГЭ, напишем процессы, протекающие на электродах, и рассчитаем ЭДС в стандартных условиях.
При составлении схемы ГЭ необходимо помнить, что электрод с меньшим значением электродного потенциала является анодом, на нем протекает процесс окисления, он заряжается отрицательно, электрод с большим значением электродного потенциала является катодом, на нем протекают процессы восстановления, он заряжается положительно.
Электрохимическая схема ГЭ.
(-) Sn | SnCL2 || Bi(NO3)3 | Bi (+)
Электронные уравнения процессов, протекающих на электродах.
Олово – металл с меньшим значением φ0 будет анодом, на нем протекает процесс окисления.
Висмут, имеющий большее значение φ0 является катодом, на нем протекает процесс восстановления.
Для определения ЭДС ГЭ из потенциала катода следует вычесть потенциал анода ε = φ к — φ А. (13)
При концентрации солей висмута и олова равном 1 моль/л, ЭДС будет равна разности их потенциалов:
ЭДС = φ0 Bi3+/Bi0 — φ0 Sn2+/Sn0 = +0,216 – (- 0,136) = 0, 352 B
Пример 2. Гальванический элемент состоит из стандартного водородного электрода и никелевого электрода, опущенного в раствор своей соли с концентрацией его ионов 0,001 моль/л. Составить схему ГЭ. Написать электронные уравнения процессов, протекающих на электродах, и рассчитать ЭДС.
Ni2+ / Ni0 = — 0,25 B
2Н+ / Н2 = 0,00 B. Следовательно, никель будет анодом, водородный электрод – катодом.
Электрохимическая схема данного ГЭ
(-) Ni|NiSO4|| H2SO4| Pt, H2 (+).
Процессы, протекающие на электродах, выражаются электронными уравнениями:
Так как концентрация ионов никеля в растворе равна 0,001 моль/л, то пользуясь формулой Нернста
где φ0 – стандартный электродный потенциал металла;
n — заряд иона металла;
— концентрация ионов металла в растворе.
Найдем электродный потенциал для никеля.
ЭДС = 0 – (- 0,337) = 0,337В.
Пример 3. Составить схему гальванического элемента, в котором электродами являются магниевая и цинковая пластинки, опущенные в растворы их ионов с активной концентрацией 1 моль/л. Какой металл является анодом, какой катодом? Напишите уравнение окислительно-восстановительной реакции, протекающей в этом гальваническом элементе, и вычислите его ЭДС.
Схема данного гальванического элемента
(-) Mg | Mg2+ || Zn2+ | Zn (+)
Вертикальная линия обозначает поверхность раздела между металлом и раствором, а две линии – границу раздела двух жидких фаз – пористую перегородку или соединительную трубку, заполненную раствором электролита.
Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс:
Цинк, потенциал которого – 0,763 В, — катод, т.е. электрод, на котором протекает восстановительный процесс:
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов:
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе 1 моль/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:
Пример 4. Стандартный электродный потенциал никеля (- 0,25) больше, чем кобальта (-0,277). Изменится ли это соотношение, если измерить потенциал никеля в растворе его ионов с концентрацией 0,001 моль/л, а потенциалы кобальта – в растворе с концентрацией 0,1 моль/л.
Решение: Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста (14)
φ0 – для никеля и кобальта соответственно равны – 0,25 и – 0,277 В. Определим электродные потенциалы этих металлов при заданных концентрациях:
Таким образом, при изменившейся концентрации потенциал кобальта стал больше потенциала никеля.
Пример 5. Магниевую пластинку опустили в раствор его соли. При этом электродный потенциал магния оказался равен – 2,41 В. Вычислите концентрацию ионов магния (в моль/л).
Подобные задачи также решаются на основании уравнения Нернста (14)
,[сМg2+] = 4,4 . 10–2 моль/л
Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Студалл.Орг (0.005 сек.)
Задачи к разделу Электродные процессы, Гальванический элемент
В настоящем разделе представлены типовые задачи на гальванические элементы: Определение ЭДС гальванического элемента, составление схемы гальванического элемента, определение энергии химической реакции в кДж.
Задача 1. Вычислите значение э.д.с. гальванического элемента:
(-) Mg / MgSO4 // CuSO4 / Cu (+)
Напишите процессы на аноде и катоде, реакцию, генерирующую ток, и определите в кДж энергию химической реакции, превращающуюся в электрическую.
Решение.
Дана схема гальванического элемента, из которой видно, что анодом является магний, а катодом — медь
(-) Mg / MgSO4 // CuSO4 / Cu (+)
А: Mg 0 -2e — = Mg 2+
К : Cu 2+ +2e — = Cu
Mg 0 + Cu 2+ = Mg 2+ + Cu
Вычислим ЭДС гальванического элемента:
ЭДС =0,337 + 2,37 = 2,71 В
ΔG 0 298 = -nFE = -2∙96500∙2,71 = — 523030 Дж = — 523 кДж
Задача 2. Рассчитайте ЭДС гальванического элемента, составленного из стандартного водородного электрода и свинцового электрода, погруженного в 0,01 М раствор PbCl2. На каком электроде идёт процесс окисления, а на каком — восстановление?
Решение.
В данной паре потенциал свинца имеет более отрицательное значение, поэтому анодом является свинец:
А: Pb 0 -2e — = Pb 2+
К: 2 H + +2 e — = H 2
Pb 0 + 2H + = Pb 2+ + H2
Определим электродный потенциал свинца:
E = -0,126 + (0,059/2)∙lg0,01 = -0,185 В
Вычислим ЭДС гальванического элемента:
ЭДС = 0 + 0,185 = 0,185 В
Задача 3. По уравнению токообразующей реакции составьте схему гальванического элемента:
Ni + СuSO4 = NiSO4 + Cu Напишите уравнения анодного и катодного процессов. Рассчитайте стандартную ЭДС.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Ni2+/Ni и E 0 Cu2+/Cu
В данной паре потенциал никеля имеет более отрицательное значение, поэтому анодом является никель:
А: Ni 0 -2e — = Ni 2+
К: Cu 2+ +2 e — = Cu 0
Ni 0 + Cu 2+ = Ni 2+ + Cu 0
Ni 0 + CuSO4 = NiSO4 + Cu 0
Составим схему гальванического элемента:
(-) Ni 0 |NiSO4 || CuSO4|Cu 0 (+)
Рассчитаем стандартную ЭДС реакции:
ЭДС = 0,337 – (- 0,250) = 0,587 В
Задача 4. Составьте схему гальванического элемента из магния и свинца, погруженных в растворы их солей с концентрацией ионов:
[Mg 2+ ] = 0,001 моль/л, [Pb 2+ ] = 1 моль/л. Напишите уравнения реакций, протекающих на катоде и аноде. Рассчитайте стандартную ЭДС этого элемента.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Mg2+/Mg и E 0 Pb2+/Pb
В данной паре потенциал магния имеет более отрицательное значение и является анодом:
А: Mg 0 -2e — = Mg 2+
К: Pb 2+ +2 e — = Pb 0
Mg 0 + Pb 2+ = Mg 2+ + Pb 0
Составим схему гальванического элемента:
(-) Mg 0 |Mg 2+ || Pb 2+ |Pb 0 (+)
Применяя уравнение Нернста, найдем EPb2+/Pb и EMg2+/Mg заданной концентрации:
Рассчитаем стандартную ЭДС реакции
ЭДС = -0,126 – (-2,46) = 2,334 В
Задача 5. Как изменится (увеличится, уменьшится) или останется постоянной масса пластины из кобальта, погруженной в раствор, содержащий соли Fe (II), Mg, Ag (I). Напишите молекулярные уравнения реакций.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Mg2+/Mg, E 0 Co2+/Co, E 0 Fe2+/Fe, E 0 Ag+/Ag
Протекание реакции возможно при условии, когда E 0 восст 0 ок.
В нашем случае восстановителем является кобальт и условие E 0 восст 0 ок соблюдается только для пары
Co 0 + Ag + = Co 2+ + Ag 0
Молекулярное уравнение, например:
В процессе пластина из кобальта будет растворяться, но одновременно на ее поверхности будет осаждаться серебро.
Из уравнения реакции видно, что при взаимодействии 1 моль кобальта, образуется 2 моль серебра.
Мольная масса кобальта M(Co) = 59 г/моль, мольная масса серебра M(Ag) = 108 г/моль.
Найдем массы металлов:
n = m/M, m = n∙M
m(Ag) = 2∙108 = 216 г.
Таким образом, масса осажденного серебра больше, чем масса растворенного кобальта, т.е. масса пластины из кобальта увеличится.
В случаях, когда пластина опущена в раствор соли железа или соли магния ее масса не изменится, т.к. кобальт не вытесняет эти металлы из их солей. Т.е. реакции не происходит и масса пластины остается неизменной.
Задача 6. Составьте схему гальванического элемента, уравнения полуреакций анодного и катодного процессов, молекулярное уравнение реакции, проходящей при работе гальванического элемента, анодом которого является никель. Подберите материал для катода. Рассчитайте стандартную ЭДС этого гальванического элемента.
Решение.
По условию задачи материал анода известен – никель. Электродный потенциал анода всегда имеет более отрицательное значение, т.е. анод состоит из более активного металла, чем катод.
Поэтому нам надо подобрать такой металл, значение потенциала которого, будет иметь большее значение, чем значение электродного потенциала никеля. Например, медь:
Составим уравнения полуреакций анодного и катодного процессов и молекулярное уравнение реакции, проходящей при работе гальванического элемента.
А: Ni 0 -2e — = Ni 2+
К: Cu 2+ +2 e — = Cu 0
Ni 0 + Cu 2+ = Ni 2+ + Cu 0
Ni 0 + CuSO4 = NiSO4 + Cu 0
Составим схему гальванического элемента:
(-) Ni 0 |NiSO4 || CuSO4|Cu 0 (+)
Рассчитаем стандартную ЭДС реакции
Дана схема ГЭ: Mn | MnSO4 || Bi2(SO4)3 | Bi Определить анод и катод, написать схемы электродных процессов. Определить ЭДС.
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,247
- разное 16,834
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Источник: al-shell.ru