Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
- Обратная связь
- Правила сайта
Источник: www.soloby.ru
Невероятный гальванический элемент
Схема гальванического элемента магния с алюминием
Задача 4.
Схема гальванического элемента : Al/Al2(SO4)3//AgNO3/Ag.
Указать анод и катод, написать электродные процессы, суммарное уравнение реакции и рассчитать электродвижущую силу элемента при 298К, если
[A l3+ ] = 0,0001 моль/л, [Аg + ] = 0,1моль/л.
Решение:
Решение:
Серебро, потенциал которого (+0,80 В) более электроположительный, чем у алюминия (-1,66 В) — катод, т. е. электрод, на котором протекает восстановительный процесс:
Алюминий имеет меньший потенциал (-1,66 В) является анодом, на котором протекает окислительный процесс:
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов, получим:
Для расчета значения потенциалов, используем уравнение Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе.
Е(Ag) = +0,80 + (0,059/1)lg0,1 = +0,74 B;
Е(Al) = -1,66 + (0,059/3)lg0,0001 = -1,74 B.
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
Задача 65.
Составить схему гальванического элемента, в котором алюминий будет катодом. Написать электродные процессы, суммарное уравнение процесса.
Решение:
Cхема гальванического элемента, в котором алюминий будет катодом может иметь вид:
Алюминий, потенциал которого (-1,66 В) более электроположительный, чем у магния (-2,38 В) — катод, т. е. электрод, на котором протекает восстановительный процесс:
Магний имеет меньший потенциал (-2,38 В) является анодом, на котором протекает окислительный процесс:
Cуммарное уравнение процесса:
Гальванические элементы. Практическая часть. 10 класс.
3Mg 0 + 2Al 3+ = 3Mg 2+ + 2Al 0
Задача 66.
Составить схему гальванического элемента, в котором протекает реакция: Ag + + Cl – = AgCl. Рассчитать стандартную ЭДС элемента при 25o C, G o и константу равновесия реакции.
Решение.
1. Схема гальванического элемента имеет вид:
2. Электродные процессы:
Правый электрод: Ag + +1 = Ag; E o = +0,799 В;
Левый электрод: AgCl + 1 = Ag + + Cl – ; E o = +0,222 В;
Общая реакция: Ag + + Cl – = AgCl; E o = +0,557 В.
3. Рассчитаем энергию Гиббса процесса:
Для расчета G o используем формулу:
G o = —nFE o , где
n — количество электронов, участвующих в процессе, 1 электрон; F — универсальная газовая постоянная, 96485 Кл.моль-1; Eo — окислительно-восстановительный потенциал процесса, +0,557 В.
G o = —nFE o = -(96485 Кл.моль-1) . (0,557 В) = -53,742 кДж. моль-1.
4. Расчет константы равновесия реакции:
Для расчета используем формулу:
К = exp–G o /RT = exp[ -53,742/(8,31 . 298,15)] = 2,6 . 109
Как рассчитать ЭДС гальванического элемента
Решение задач на составление схемы гальванического элемента
Задание 251.
При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод — в 0,01 М растворе сульфата никеля. Ответ: 0,0295 В.
Решение:
Гальванический элемент, электроды которого сделаны из одного и того же металла будет работать при условии, что электроды будут опущены в растворы солей с разной концентрацией. Схема гальванического элемента, в котором один никелевый электрод находится в 0,001М растворе, а другой – в 0,01М растворе сульфата никеля имеет вид:
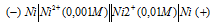
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность).
Определим электродные потенциалы никелевых электродов при разных концентрациях ионов серебра Ni 2+ , получим:
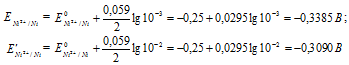
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
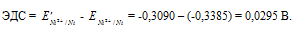
Ответ: 0,0295 В.
Задание 252.
Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Рb 2+ ] = [Мg 2+ ] = 0,01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз? Ответ: 2,244 В.
Решение:
Схема гальванического элемента
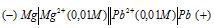
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки — границу раздела двух жидких фаз — пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (—2,37 В) и является анодом, на котором протекает окислительный процесс:
Мg 0 — 2 = Mg 2+ (1)
Свинец, потенциал которой -0,127 В — катод, т.е. электрод, на котором протекает восстановительный процесс:
Pb 2+ + 2 = Pb 0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
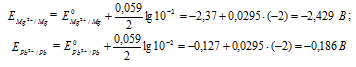
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
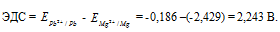
Если концентрацию каждого из ионов Mg 2+ и Pb 2+ увеличить в одинаковое число раз, то ЭДС гальванического элемента не изменится, так как при этом соответственно будут уменьшаться численные значения потенциалов металлов, а разница между значениями их не изменится. Например, при увеличении концентрации ионов в 100 раз концентрация их примет значения 1 моль/л, а потенциалы электродов станут равными стандартным потенциалам металлов, то ЭДС = -0,127 – (-2,37) = 2,243 В.
Ответ: 2,243 В.
Задание 253.
Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом — анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
Решение:
а) Схема гальванического элемента, в котором никель является катодом:
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки — границу раздела двух жидких фаз — пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс:
Mg 0 — 2 = Mg 2+ (1)
Никель, потенциал которой -0,25 В — катод, т.е. электрод, на котором протекает восстановительный процесс:
Ni 2+ + 2 = Ni 0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
б) Схема гальванического элемента, в котором никель является анодом:
Никель имеет меньший потенциал (-0,25 В) и является анодом, на котором протекает окислительный процесс:
Ni 0 — 2 = Ni 2+ (1)
Медь, потенциал которой (+0,34 В) — катод, т.е. электрод, на котором протекает восстановительный процесс:
Сu 2+ + 2 = Сu 0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Задание 254.
Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на аноде и на катоде.
Решение:
Стандартные электродные потенциалы железа и серебра соответственно равны -0,44 В и +0,80 В. Исходя из того, что железо имеет более электроотрицательный потенциал, чем водород 0,00 В, то между железом и раствором серной кислоты проходит реакция (железо вытесняет водород из кислоты), и железная пластинка при этом будет уменьшаться по массе:
Исходя из того, что серебро имеет более электроположительный потенциал, чем водород, то между серебром и раствором серной кислоты реакция не проходит. Но так как железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты, то между ними будет проходить окислительно-восстановительный процесс, в котором железная пластина будет анодом, а серебряная – катодом.
На аноде протекает процесс:
На катоде серебряной пластинке будут разряжаться ионы водорода:
(-) Fe | Fe 2+ || 2H + | H2, Ag ( + )
Задание 255.
Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией [Мg 2+ ] = [Cd 2+ ] = 1 моль/л. Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить до 0,01 моль/л? Ответ: 1,967 В.
Решение:
Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс:
Mg 0 — 2 = Mg 2+ (1)
Кадмий, потенциал которой (-0,403 В) — катод, т.е. электрод, на котором протекает восстановительный процесс:
Cd 2+ + 2 = Cd 0 (2)
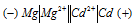
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
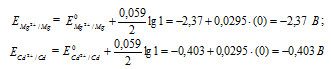
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
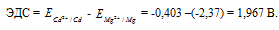
Рассчитаем электродные потенциалы магния и кадмия при концентрации их ионов в растворе равной 0,01 моль/л:
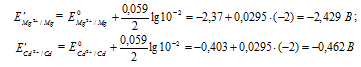
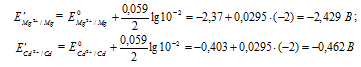
Таким образом, ЭДС гальванического элемента при равном уменьшении концентрации ионов металлов в их растворах не изменяется.
Источник: remnabor.net
Схема гальванического элемента магния и серебра
7.3 РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ ПО ТЕМЕ “ОСНОВЫ ЭЛЕКТРОХИМИИ”
(для нехимических специальностей)
1. Определите, какой из электродов является катодом в гальваническом элементе, образованном стандартными электродами:
Ag|Ag + или Mn|Mn 2+ ;
Co|Co 2+ или Na|Na + .
Катодом (т.е. электродом, на котором протекает процесс восстановления) в гальваническом элементе будет электрод, имеющий большее значение стандартного электродного потенциала (см. таблицу 4 приложения).
E 0 Ag|Ag + = 0,799 В ; E 0 Mn|Mn 2+ = –1,179 В. В данной паре катодом является Ag|Ag + .
A (–) Mn|Mn 2+ || Ag + | Ag (+) K
E 0 Co|Co 2+ = – 0,277 В ; E 0 Na|Na + = –2,714 В. В данной паре катодом является Co|Co 2+ .
C хема гальванического элемента:
A (–) Na|Na + || Co 2+ | Co (+) K
2. На основании стандартных электродных потенциалов (таблица 4 приложения) определите, какой из следующих гальванических элементов имеет наибольшую ЭДС:
а) Zn|Zn 2+ || Ni 2+ |Ni; б) Cd|Cd 2+ || Ni 2+ |Ni
в) Al|Al 3+ || Ni 2+ |Ni ; г) Mg|Mg 2+ || Ni 2+ |Ni .
а) ЭДС = Е 0 Ni|Ni 2+ – Е 0 Zn|Zn 2+ = – 0,250 – (–0,763) = 0,513 В ;
б) ЭДС = Е 0 Ni|Ni 2+ – Е 0 Cd|Cd 2+ = – 0,250 – (–0,403) = 0,153 В ;
в) ЭДС = Е 0 Ni|Ni 2+ – Е 0 Al|Al 3+ = –0,250 – (–1,663) = 1,413 В ;
г) ЭДС = Е 0 Ni|Ni 2+ – Е 0 Mg|Mg 2+ = –0,250 –(–2,363) = 2,113 В.
В случае г) ЭДС гальванического элемента будет наибольшей.
3. Вычислите электродный потенциал магния погруженного в раствор MgSO4 с концентрацией ионов Mg 2+ , равной 0,01 моль/ л .
Вычисление электродного потенциала металла при любой концентрации его ионов (моль/л) в растворе производится по уравнению Нернста. Для магниевого электрода:
E = E 0 + = –2,363 + = –2,422 В.
4. Вычислите ЭДС гальванического элемента, состоящего из двух электродов: Ti | Ti 2+ (0,01 моль/л) || Ni 2+ (1 моль/л) | Ni .
В данном гальваническом элементе катод — Ni 2+ | Ni , а анод — Ti|Ti 2+ .
А (–) Ti | Ti 2+ || Ni 2+ | Ni (+) К
Процессы на электродах:
(–) А : Ti – 2e — = Ti 2+ ;
(+) K: Ni 2+ + 2e — = Ni.
По уравнению Нернста рассчитываем значение электродного потенциала анода.
E Ti|Ti 2+ = E 0 Ti|Ti 2 + + = –1,630 + = –1,689 В ;
Значение электродного потенциала катода равно величине стандартного электродного потенциала никелевого электрода, так как концентрация ионов Ni 2+ в растворе составляет 1 моль/ л .
E Ni|Ni 2+ = E 0 Ni|Ni 2+ = – 0,250 В ;
ЭДС = –0,250 – ( –1,689) = 1,439 В.
5. Какой из следующих процессов протекает при электролизе водного раствора NaI на графитовом аноде?
а ) Na – e — = Na + ; б ) 2I – – 2e — = I2 ;
При электролизе водных растворов солей в нейтральной среде на аноде возможны два процесса окисления:
1. процесс окисления анионов соли (кислотного остатка) :
2. процесс электрохимического окисления молекул воды:
В данном случае на аноде при электролизе будут окисляться иодид-анионы, т.к. для электрохимического окисления воды необходима большая положительная поляризация анода.
Ответ: 2I – – 2e — = I2
6. Какое вещество и в каком количестве выделится на катоде при электролизе раствора Hg (NO3)2 (анод графитовый) в течение 10 минут при силе тока 8А?
При электролизе водных растворов солей в нейтральной среде на катоде возможно протекание двух восстановительных процессов. Один из них – восстановление катионов металла:
Другой возможный процесс – восстановление водорода из молекул воды:
В данном случае на катоде будут восстанавливаться катионы ртути, т.к. этот металл входит в группу малоактивных металлов, и для его восстановления необходима меньшая отрицательная поляризация электрода, чем для восстановления водорода.
На катоде: Hg 2+ + 2e — = Hg ;
Количество выделившейся ртути, согласно законам Фарадея, равно:
mHg = I t (сек)= · 8 · 600 = 5 г .
Источник: www.chem-astu.ru