Решение задач на составление схемы гальванического элемента
Задание 251.
При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод — в 0,01 М растворе сульфата никеля. Ответ: 0,0295 В.
Решение:
Гальванический элемент, электроды которого сделаны из одного и того же металла будет работать при условии, что электроды будут опущены в растворы солей с разной концентрацией. Схема гальванического элемента, в котором один никелевый электрод находится в 0,001М растворе, а другой – в 0,01М растворе сульфата никеля имеет вид:
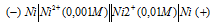
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Задачи на гальванический элемент. Продукты в ОВР. Ч.5-4.

Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность).
Определим электродные потенциалы никелевых электродов при разных концентрациях ионов серебра Ni 2+ , получим:
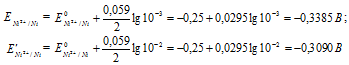
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
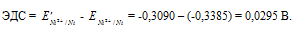
Ответ: 0,0295 В.
Задание 252.
Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Рb 2+ ] = [Мg 2+ ] = 0,01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз? Ответ: 2,244 В.
Решение:
Схема гальванического элемента
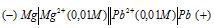
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки — границу раздела двух жидких фаз — пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (—2,37 В) и является анодом, на котором протекает окислительный процесс:
Мg 0 — 2 = Mg 2+ (1)
Свинец, потенциал которой -0,127 В — катод, т.е. электрод, на котором протекает восстановительный процесс:
Pb 2+ + 2 = Pb 0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Гальванические элементы. Практическая часть. 10 класс.
Mg 0 + Pb 2+ = Mg 2+ + Pb 0
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
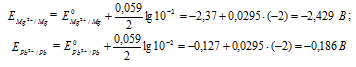
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
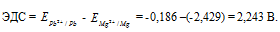
Если концентрацию каждого из ионов Mg 2+ и Pb 2+ увеличить в одинаковое число раз, то ЭДС гальванического элемента не изменится, так как при этом соответственно будут уменьшаться численные значения потенциалов металлов, а разница между значениями их не изменится. Например, при увеличении концентрации ионов в 100 раз концентрация их примет значения 1 моль/л, а потенциалы электродов станут равными стандартным потенциалам металлов, то ЭДС = -0,127 – (-2,37) = 2,243 В.
Ответ: 2,243 В.
Задание 253.
Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом — анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
Решение:
а) Схема гальванического элемента, в котором никель является катодом:
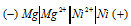
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки — границу раздела двух жидких фаз — пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс:
Mg 0 — 2 = Mg 2+ (1)
Никель, потенциал которой -0,25 В — катод, т.е. электрод, на котором протекает восстановительный процесс:
Ni 2+ + 2 = Ni 0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Mg 0 + Ni 2+ = Mg 2+ + Ni 0
б) Схема гальванического элемента, в котором никель является анодом:
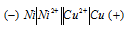
Никель имеет меньший потенциал (-0,25 В) и является анодом, на котором протекает окислительный процесс:
Ni 0 — 2 = Ni 2+ (1)
Медь, потенциал которой (+0,34 В) — катод, т.е. электрод, на котором протекает восстановительный процесс:
Сu 2+ + 2 = Сu 0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Ni 0 + Cu 2+ = Ni 2+ + Cu 0
Задание 254.
Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на аноде и на катоде.
Решение:
Стандартные электродные потенциалы железа и серебра соответственно равны -0,44 В и +0,80 В. Исходя из того, что железо имеет более электроотрицательный потенциал, чем водород 0,00 В, то между железом и раствором серной кислоты проходит реакция (железо вытесняет водород из кислоты), и железная пластинка при этом будет уменьшаться по массе:
Исходя из того, что серебро имеет более электроположительный потенциал, чем водород, то между серебром и раствором серной кислоты реакция не проходит. Но так как железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты, то между ними будет проходить окислительно-восстановительный процесс, в котором железная пластина будет анодом, а серебряная – катодом.
На аноде протекает процесс:
На катоде серебряной пластинке будут разряжаться ионы водорода:
(-) Fe | Fe 2+ || 2H + | H2, Ag ( + )
Задание 255.
Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией [Мg 2+ ] = [Cd 2+ ] = 1 моль/л. Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить до 0,01 моль/л? Ответ: 1,967 В.
Решение:
Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс:
Mg 0 — 2 = Mg 2+ (1)
Кадмий, потенциал которой (-0,403 В) — катод, т.е. электрод, на котором протекает восстановительный процесс:
Cd 2+ + 2 = Cd 0 (2)
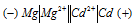
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
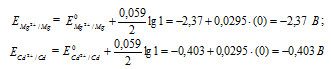
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
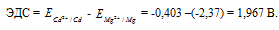
Рассчитаем электродные потенциалы магния и кадмия при концентрации их ионов в растворе равной 0,01 моль/л:
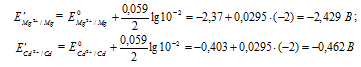
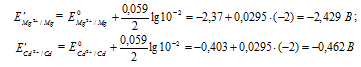
Таким образом, ЭДС гальванического элемента при равном уменьшении концентрации ионов металлов в их растворах не изменяется.
Ответ: 1,967 В.
- Вы здесь:
- Главная

- Задачи

- Химия-Шиманович

- Углерод и его соединения | Задания 387; 388
Источник: buzani.ru
Алгоритм составления схемы гальванического элемента.
- Записать схемы электродов.
- Используя уравнение Нернста рассчитать величины электродных потенциалов.
- Определить, зная, что φк φа, электрод-анод и электрод-катод.
- Составить схему гальванического элемента, используя принятую форму записи.
- Записываем уравнения катодной, анодной и суммарной реакций, идущих в элементе.
- Рассчитать ЭДС гальванического элемента.
Пример 1. Составить схему гальванического элемента, анодом которого является магний, погруженный в раствор соли с концентрацией 0,01М. Решение. 1. Записываем схему электрода: Mg|Mg2+
- По уравнению. Нернста рассчитываем величину электродного потенциала:

- Так как в условии задачи не указан материал, из которого изготовлен катод, то используя соотношение φк φа, выбираем металл с более положительным потенциалом. Например, цинковый электрод. Значение потенциала выбранного электрода определяем по таблице «Стандартные электродные потенциалы металлов при 25 0 С».
Следовательно,  .
.
- Записываем схему гальванического элемента:
А(-)Mg|Mg2+||Zn2+|Zn(+)K
- Записываем электродные реакции:
А(-) Mg 2e — Mg 2+ K(+) Zn 2+ + 2e — Zn 0 Суммарная реакция: Mg 0 + Zn 2+ Mg 2+ + Zn 0
- Рассчитываем ЭДС гальванического элемента:
 Пример 2. Составьте схему гальванического элемента, состоящего из водородного электрода, погруженного в раствор с рН =3 и железного электрода, погруженного в раствор соли с концентрацией 0.1М. Рассчитайте ЭДС элемента. Решение. 1. Записываем схемы электродов: Водородный – 2Н+| Н2(Pt); Железный –Fe|Fe2+
Пример 2. Составьте схему гальванического элемента, состоящего из водородного электрода, погруженного в раствор с рН =3 и железного электрода, погруженного в раствор соли с концентрацией 0.1М. Рассчитайте ЭДС элемента. Решение. 1. Записываем схемы электродов: Водородный – 2Н+| Н2(Pt); Железный –Fe|Fe2+
- По уравнению Нернста рассчитываем величину электродного потенциала железного электрода:
 Используя уравнение Нернста (4) рассчитываем величину электродного потенциала водородного электрода:
Используя уравнение Нернста (4) рассчитываем величину электродного потенциала водородного электрода: 
- Используя соотношение φк φа определяем электрод-анод.
Так как величина φ-потенциала железного электрода меньше следовательно этот электрод является анодом.
- Записываем схему гальванического элемента:
А(-)Fe|Fe2+||2H+|H2(+) K
- Рассчитываем ЭДС гальванического элемента.
 Задания для самоконтроля
Задания для самоконтроля
- Составьте схему гальванического элемента, состоящего из никелевого электрода-катода, погруженного в раствор соли с концентрацией 0.02М. Напишите уравнения электродных реакций и вычислите ЭДС гальванического элемента.
- Составьте схему гальванического элемента, состоящего из медного электрода, погруженного в раствор соли меди с концентрацией 0.01М и железного электрода, погруженного в раствор соли железа с концентрацией 0.1М. Напишите уравнения электродных реакций. Вычислите ЭДС гальванического элемента.
- Составьте схему гальванического элемента, состоящего из стандартного водородного электрода и ртутного электрода. Рассчитайте его ЭДС при [Hg 2+ ]=0,1 М. Напишите уравнения электродных реакций.
- Составьте схему и рассчитайте ЭДС концентрированного гальванического элемента, составленного из двух железных электродов, погруженных в раствор соли железа с концентрациями 1 М и 0,01 М. Напишите уравнения электродных реакций.
- В гальваническом элементе протекает химическая реакция
Zn+NiSO4=ZnSO4+Ni. Напишите его схему и уравнения электродных реакций. Вычислите ЭДС этого элемента при стандартных условиях. Какой металл вместо никеля можно взять, чтобы увеличить ЭДС?
- Составьте схему гальванического элемента, состоящего из водородного электрода, погруженного в раствор с pH=5, и марганцевого электрода, погруженного в раствор соли марганца с концентрацией 0,2 М. Напишите уравнения электродных реакций и рассчитайте его ЭДС.
- Составьте схему гальванического элемента, состоящего из водородного электрода, погруженного в раствор с pH=10, и серебряного электрода, погруженного в раствор соли серебра с концентрацией 0,01 М. Напишите уравнения электродных реакций и рассчитайте его ЭДС.
06.08.2019 1 Mб 3 file_466445.rtf
Ограничение
Для продолжения скачивания необходимо пройти капчу:
Источник: studfile.net
9.2 Гальванический элемент
Гальванический элемент – это химический источник тока, в котором энергия, выделяющаяся при протекании на электродах окислительно-восстановительной реакции, непосредственно преобразуется в электрическую энергию.
Принцип работы гальванического элемента можно рассмотреть на примере элемента Даниэля – Якоби (рис 9.2).

Рис. 9.2. Схема гальванического элемента Даниэля – Якоби
Здесь I – стакан, содержащий раствор ZnSO4 в воде с погруженной в него цинковой пластинкой; II – стакан, содержащий раствор CuSO4 в воде с погруженной в него медной пластинкой; III – солевой мостик (электролитический ключ), который обеспечивает перемещение катионов и анионов между растворами; IV – вольтметр (нужен для измерения ЭДС, но в состав гальванического элемента не входит).
Стандартный электродный потенциал цинкового электрода 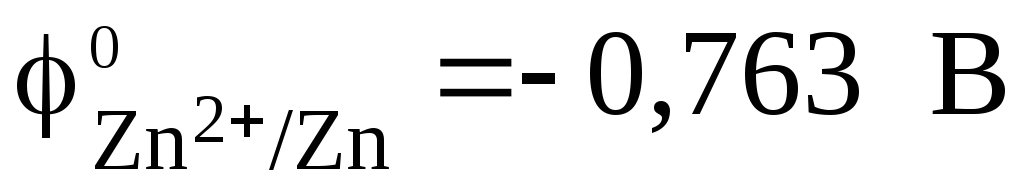 . Стандартный электродный потенциал медного электрода
. Стандартный электродный потенциал медного электрода 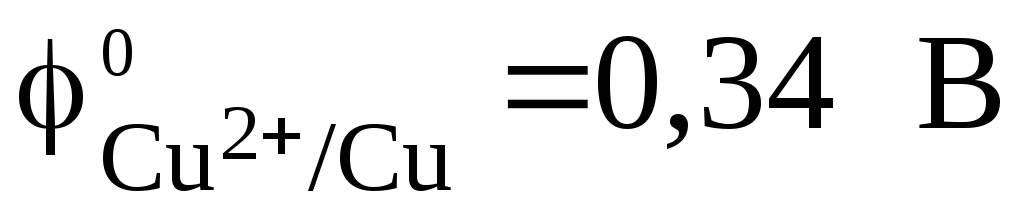 . Так как
. Так как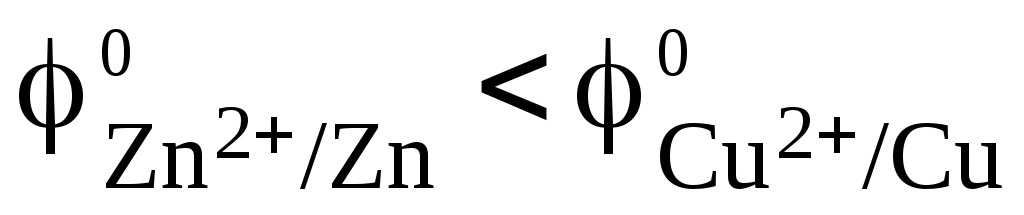 , то атомы цинка будут окисляться:
, то атомы цинка будут окисляться:
Электрод, на котором идет реакция окисления или который посылает катионы в электролит, называется анодом. У рассматриваемого гальванического элемента в роли анода выступаетцинковыйэлектрод. Так как стандартный электродный потенциал цинка ниже, чем у меди, цинковому электроду приписывается условный заряд «–», а медному – «+».
Электроны, освободившиеся в результате окисления, по внешней цепи переходят на медь (возникает электрический ток).
На медном электроде происходит процесс восстановления катионов электролитаCu 2+ :
Электрод, на котором идет реакция восстановления или который принимает катионы из электролита, называется катодом.
Через электролитический ключ происходит движение ионов в растворе: анионов SO4 2– к аноду, катионовZn 2+ к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
Складывая уравнения процессов, протекающих на электродах, получаем суммарное уравнение окислительно-восстановительной реакции, протекающей в гальваническом элементе:
или, с учетом анионов раствора:
В общем случае, суммарное уравнение окислительно-восстановительной реакции, протекающей в произвольном гальваническом элементе, можно представить в виде:
где индексы А и К относятся к металлам анода и катода соответственно.

Символическая запись (схема) гальванического элемента имеет вид:
Часто вместо растворов обозначают только катионы, содержащиеся в растворе:

Схема гальванического элемента Даниэля– Якоби имеет вид:
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой(ЭДС) элементаЕ. Она вычисляется по формуле;
где φк и φа – электродные потенциалы катода и анода соответственно.
Величина ЭДС элемента Даниэля – Якоби при стандартных условиях равна:
Е= +0,34 – (–0,76) = 1,10 В.
Электродвижущая сила Ехарактеризует способность гальванического элемента совершать электрическую работу во внешней цепи.
Электрическая работа определяется максимальной полезной работой, совершаемой химической реакцией, которая равна изменению изобарно-изотермического потенциала ∆Gпроцесса. Связь между величиной ∆Gи ЭДС описывается уравнением:
∆G= –nFE,
где n – число электронов в элементарном окислительно-восстановительном акте, F – число Фарадея.
Величина изменения изобарно-изотермического потенциала токообразующей реакции при стандартных условиях ∆G 0 связана с константой равновесия этой реакцииКравнсоотношением

Гальванические элементы являются первичными (однократно используемыми) химическими источниками тока (ХИТ). Вторичными (многократно используемыми) ХИТ являются аккумуляторы. Процессы, протекающие при разряде и заряде аккумуляторов, взаимнообратны.
Гальванические элементы, у которых электроды выполнены из одного и того же металла и опущены в растворы своих солей разной концентрации, называются концентрационными. Функцию анода в таких элементах выполняет металл, опущенный в раствор соли с меньшей концентрацией, например:

Пример 1.Составьте схему гальванического элемента, в основе которого лежит реакция:Mg+ZnSO4 =MgSO4+Zn.Что является катодом и анодом в этом элементе? Напишите уравнения процессов, протекающих на этих электродах. Рассчитайте ЭДС элемента при стандартных условиях. Вычислите константу равновесия для токообразующей реакции.
В таблице находим значения стандартных электродных потенциалов систем Zn/Zn 2+ иMg/Mg 2+ :



Поскольку , то магниевый электрод выполняет функцию анода, а цинковый – катода. Схема гальванического элемента имеет вид:

На аноде идет процесс окисления:

На катоде – восстановление катионов среды:

Стандартная ЭДС гальванического элемента
Е= φ 0 к– φ 0 а= –0,763 – (–2,37) = 1,607 В.
По уравнениям (9.5) и (9.6) вычислим константу равновесия токообразующей реакции:

Потенцируя, находим Кравн= 3,5 ∙10 54 .
Поскольку К>>1, то токообразующая реакция практически необратима.
Пример 2.Составьте схему гальванического элемента, состоящего из цинкового и серебряного электродов, погруженных в растворы их солей. Концентрации ионов в растворах:CZn 2+ = 0,1 моль/л,CAg + = 0,01 моль/л. Укажите, какой электрод является катодом, а какой – анодом. Напишите уравнения реакций, протекающих на электродах, а также суммарное уравнение токообразующей реакции в гальваническом элементе. Рассчитайте ЭДС этого элемента.
Так как концентрации ионов не равны единице, то вначале рассчитаем потенциалы электродов, используя формулу Нернста. Если в условии задачи отсутствует значение температуры, то ее принимают равной стандартной температуре Т= 298 К. Поэтому будем использовать уравнение (9.2):

Подставим числовое значение концентрации в формулу Нернста, используя данные таблицы 9.1:
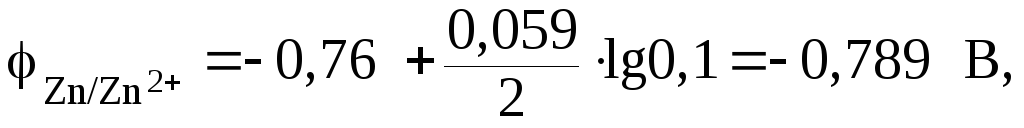


Из расчета видно, что . Поэтому цинковый электрод выполняет функцию анода, а серебряный – катода.
Схема гальванического элемента:
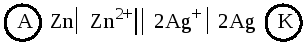
Вычислим ЭДС элемента по формуле (9.4):
Теперь запишем электродные реакции. На аноде происходит процесс окисления:

а на катоде – процесс восстановления:

Складывая уравнения электродных процессов (с учетом равенства числа принимаемых и отдаваемых электронов), получаем суммарное уравнение токообразующей реакции: Zn+ 2Ag + =Zn 2+ + 2Ag.
221–226Напишите уравнения катодного и анодного процессов и составьте схему гальванического элемента, при работе которого протекает следующая реакция (см. таблицу). На основании значений стандартных электродных потенциалов рассчитайте константу равновесия данной реакции и ЭДС элемента.
Источник: studfile.net