Гальванический элемент – устройство, в котором химическая энергия окислительно-восстановительных процессов преобразуется в электрическую.
Гальванический элемент состоит из двух электродов и ионного проводника между ними. В качестве электродов используются металлы, уголь и другие вещества, обладающие электронной проводимостью (проводники 1-го рода). Отдельный электрод в гальваническом элементе иногда называют полуэлементом.
Ионным проводником (проводником 2-го рода) служат растворы или расплавы электролитов. Для обеспечения работы гальванического элемента, электроды соединяют друг с другом металлическим проводником, называемым внешней цепью. В качестве ионного проводника используется «соляный мостик» – изогнутая (U-образная) стеклянная трубка, заполненная насыщенным раствором хлорида калия KCl. Внутреннюю цепь составляет собственно гальванический элемент.
Существуют определенные правила записи электрохимических систем:
· слева располагают электрод, имеющий более отрицательный потенциал (знак «–»), справа – электрод, имеющий более положительный потенциал (знак «+»):
Почему нельзя скручивать алюминиевый и медный провод.
или в ионной форме:
Al │ Al 3 + ║ Ni 2+ │Ni;
· растворы отделяют вертикальной пунктирной линией, если они контактируют друг с другом:
Pt, H2│HCl ¦ CuCl2│Cu;
двумя вертикальными линиями – если между ними находится соляный мостик:
Zn │ Zn 2+ ║ Ag + │Ag.
Гальванический элемент может быть сделан из двух одинаковых электродов, помещенных в растворы с различными концентрациями солей (активностями катионов). Металлический электрод, помещенный в более разбавленный раствор, выполняет функцию отрицательного, а помещенный в более концентрированный – положительного электрода. Такая разновидность гальванического элементаназывается концентрационным гальваническим элементом. Схема концентрационного гальванического элемента также может быть записана в виде:
(–) Zn | Zn 2+ || Zn 2+ | Zn (+).
Составим гальванический элемент, состоящий из двух металлов, Al и Ni, погруженных в растворы собственных солей (рис. 8.1).
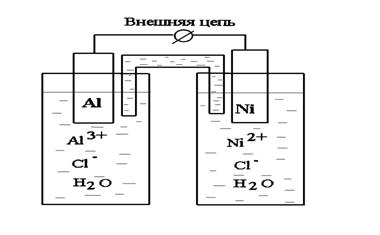 |
Рис. 8.1. Схема гальванического элемента
Составление схем гальванических элементов
Задача 4.
Схема гальванического элемента : Al/Al2(SO4)3//AgNO3/Ag.
Указать анод и катод, написать электродные процессы, суммарное уравнение реакции и рассчитать электродвижущую силу элемента при 298К, если
[A l3+ ] = 0,0001 моль/л, [Аg + ] = 0,1моль/л.
Решение:
Решение:
Серебро, потенциал которого (+0,80 В) более электроположительный, чем у алюминия (-1,66 В) — катод, т. е. электрод, на котором протекает восстановительный процесс:
Алюминий имеет меньший потенциал (-1,66 В) является анодом, на котором протекает окислительный процесс:
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов, получим:
Гальванический элемент
Al 0 + 3Ag + = 3Ag 0 + Al 3+
Для расчета значения потенциалов, используем уравнение Нернста:
Е = Е 0 + (0,059/n)lgC где
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе.
Е(Ag) = +0,80 + (0,059/1)lg0,1 = +0,74 B;
Е(Al) = -1,66 + (0,059/3)lg0,0001 = -1,74 B.
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
ЭДС = +0,74 — (-1,74) = +2,48 B.
Задача 65.
Составить схему гальванического элемента, в котором алюминий будет катодом. Написать электродные процессы, суммарное уравнение процесса.
Решение:
Cхема гальванического элемента, в котором алюминий будет катодом может иметь вид:
Алюминий, потенциал которого (-1,66 В) более электроположительный, чем у магния (-2,38 В) — катод, т. е. электрод, на котором протекает восстановительный процесс:
Магний имеет меньший потенциал (-2,38 В) является анодом, на котором протекает окислительный процесс:
Cуммарное уравнение процесса:
3Mg 0 + 2Al 3+ = 3Mg 2+ + 2Al 0
Задача 66.
Составить схему гальванического элемента, в котором протекает реакция: Ag + + Cl – = AgCl. Рассчитать стандартную ЭДС элемента при 25o C, G o и константу равновесия реакции.
Решение.
1. Схема гальванического элемента имеет вид:
Ag|AgCl|Cl – ||Ag + |Ag
2. Электродные процессы:
Правый электрод: Ag + +1 = Ag; E o = +0,799 В;
Левый электрод: AgCl + 1 = Ag + + Cl – ; E o = +0,222 В;
Общая реакция: Ag + + Cl – = AgCl; E o = +0,557 В.
3. Рассчитаем энергию Гиббса процесса:
Для расчета G o используем формулу:
G o = -nFE o , где
n — количество электронов, участвующих в процессе, 1 электрон; F — универсальная газовая постоянная, 96485 Кл.моль-1; Eo — окислительно-восстановительный потенциал процесса, +0,557 В.
G o = -nFE o = -(96485 Кл.моль-1) . (0,557 В) = -53,742 кДж. моль-1.
4. Расчет константы равновесия реакции:
Для расчета используем формулу:
К = exp–G o /RT = exp[ -53,742/(8,31 . 298,15)] = 2,6 . 109
- Вы здесь:
- Главная

- Задачи

- Общая химия

- Приготовление буферных растворов. Задачи 45 — 47
Источник: buzani.ru
Помогите составить схемы работы гальванических элементов
Ео (Zn(2+)/Zn) = − 0,76 В
Eo(Al(3+)/Al) = – 1,700 B
В гальваническом элементе анодом становится металл, обладающего меньшим значением электродного потенциала, а катодом – металл с большим значением электродного потенциала. Поскольку цинк в электрохимическом ряду напряжений стоит правее, чем алюминий, то цинк имеет большее значение электродного потенциала восстановления, чем алюминий. Значит, в данном гальваническом элементе цинковый электрод будет катодом, а алюминиевый – анодом.
На аноде протекает процесс окисления металла, а на катоде – процесс восстановления металла.
Процессы окисления-восстановления на электродах.
Анод (-) Al(0) – 3е → Al(3+) │2 — процесс окисления на аноде
Катод (+) Zn(2+) + 2е → Zn(0) │3 — процесс восстановления на катоде
Суммируя реакции на аноде и катоде, получаем уравнение, которое в ионной форме, выражает происходящую в элементе реакцию.
2Al + 3Zn(2+) → 3Zn + 2Al(3+)
Схема гальванического элемента
А (-) | Al | Al(3+) || Zn(2+) | Zn | K(+)
Стандартная ЭДС гальванического элемента
Е = Е (катода) – Е (анода) = Ео (Zn(2+)/Zn) – Eo(Al(3+)/Al) = − 0,76 – (– 1,70) = 0,94 В
Стандартная ЭДС гальванического элемента соответствует одномолярным концентрациям ионов Al(3+) и Zn(2+).
Если концентрации ионов Al(3+) и Zn(2+) отличны от одномолярных, то электродные потенциалы анода и катода находятся по уравнению Нернста при 298 градусах Кельвина.
Е (анода) = Е (Al(3+)/Al) = Ео (Al(3+)/Al) + (0,059/3)*lg[Al(3+)]
Е (катода) = Е (Zn(2+)/Zn) = Ео (Zn(2+)/Zn) + (0,059/2)*lg[Zn(2+)]
Источник: sprashivalka.com