Гальванический элемент состоит из серебряного электрода, погруженного в 1 M раствор АgNO3, и стандартного водородного электрода. Напишите уравнения электродных процессов и суммарной реакции, происходящих при работе элемента. Чему равна его ЭДС?
Решение: Справочные данные: Поскольку то серебряный электрод в гальваническом элементе будет являться катодом, а стандартный водородный электрод – анодом. Схема гальванического элемента (примем, стандартный водородный электрод опущен в растворе 0,5 М серной кислоты Электродные процессы: Анод Суммарное уравнение: Будем считать, что нитрат серебра в водном растворе полностью распался на ионы. Тогда молярная концентрация ионов Ag(+) в растворе. Поскольку в гальваническом элементе молярные концентрации ионов равны 1,0 M, то электродные потенциалы анода и катода равны стандартным электродным потенциалам водородного и серебряного электродов соответственно.

Гальваника. Родирование погружное и карандашом.
Похожие готовые решения по химии:
- Ток одной и той же силы проходит через растворы AgNO3 и СuSO4. В результате выделилось 0,64 г меди. Найдите массу серебра, выделенного из раствора за тот же промежуток времени. Напишите электродные процессы.
- Медь не вытесняет кислород из разбавленных кислот. Почему? Однако, если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода
- При какой концентрации ионов серебра (моль/л) потенциал серебряного электрода составит 95% от величины его стандартного электродного потенциала?
- Почему при электролизе раствора хлорида меди (II) на катоде выделяется медь, а при электролизе раствора иодида калия − водород?
- Давление пара раствора, содержащего 31,5 г Ca(NO3)2 в 500 г раствора, равно 1903,5 Па при 17 °С. Давление пара воды при этой температуре равно 1937 Па. Вычислите кажущуюся степень диссоциации нитрата кальция в этом растворе.
- Составьте схемы двух гальванических элементов, в одном из которых медь служила бы катодом, а в другом – анодом. Напишите уравнения реакций, происходящих при работе
- Водный раствор содержит смесь нитратов меди (II), железа (II), свинца (II) и натрия одинаковой концентрации. В какой последовательности будут выделяться металлы при электролизе?
- Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
- Из бензола получите п-нитроанилин. Назовите органические вещества, полученные в процессе синтеза. Напишите реакции, протекающие при взаимодействии п-нитроанилина
- Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
- Напишите уравнения реакций: 1) окисления Д-глюкозы; 2) восстановления Д-глюкозы и Д-фруктозы. б) На мальтозу подействуйте аммиачным раствором оксида серебра
- Для вещества, имеющего строение
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Гальванический карандаш Нанесение слоя золота и серебра
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Telegram и логотип telegram являются товарными знаками корпорации Telegram FZ-LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Источник: www.evkova.org
Серебряный электрод и его уравнение
Составление уравнений электродных процессов и суммарной реакции, происходящей при работе гальванического элемента
Задача 652.
Гальванический элемент состоит из серебряного электрода, погруженного в 1 М раствор AgNO3, и стандартного водородного электрода. Написать уравнения электродных процессов и суммарной реакции, происходящей при работе элемента. Чему равна его э.д.с.?
Решение:
(2H+/H2) = 0,00 B; (Ag + /Ag) = 0,80 B. Поскольку (2H + /H2) + /Ag), то водородный электрод будет служить отрицательным полюсом (электродом) и электроны будут перемещаться во внешней цепи от водородного электрода к серебряному электроду, т. е. водород является анодом – электродом, на котором протекает окислительный процесс:
Серебро, потенциал которой +0,80 В, — катод, т.е. электрод, на котором протекает восстановительный процесс:
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов, получим
H20 + 2Ag + = 2H + + 2Ag 0
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т.е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
(Ag + /Ag) — (2H + /H2) = 0,80B — 0,00B = +0,80 B
Ответ: +0,80В.
Задача 653.
Э. д. с. гальванического элемента, состоящего из стандартного водородного электрода и свинцового электрода, погруженного в 1 М раствор соли свинца, равна 126 мВ. При замыкании элемента электроны во внешней цепи перемещаются от свинцового к водородному электроду. Чему равен потенциал свинцового электрода? Составить схему элемента. Какие процессы протекают на его электродах?
Решение:
(2H + /H2) = 0,00 B. По условии задачи электроны во внешней цепи гальванического элемента перемещаются от свинцового к водородному электроду, значит, на свинцовом электроде протекает окислительный процесс:
А на водородном – восстановительный:
Таким образом, свинцовый электрод будет анодом, а водородный – катодом.
Уравнение окислительно-восстановительного процесса, протекающего при работе данного гальванического элемента, можно получить, сложив электронные процессы на электродах:
Pb 0 + 2H + = Pb 2+ + H2 0
Для расчета электродного потенциала свинца, можно использовать уравнение определения ЭДС гальванического элемента:
Подставив в уравнение данные задачи, получим:
Е = (2H + /H2) — (Pb 2+ /Pb);
(Pb 2+ /Pb) = (2H+/H2) — E = 0,00 — 126 = -126м В (-0,126 B)
Ответ: -0,126В.
Задача 654.
Рассчитать электродные потенциалы магния в растворе его соли при концентрациях иона Mg 2+ 0,1, 0,01 и 0,001 молы/л.
Решение:
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация (при точных измерениях активность) гидратированных ионов металла в растворе. Е 0 для магния равен -2,34 В.
Определим электродные потенциалы магния в растворах при разных значениях концентрации его ионов:
а) Mg 2+ = 0,1 молы/л.
б) Mg 2+ = 0,01 молы/л.
в) Mg 2+ = 0,001 молы/л.
Ответ: а) 2,37 В; б) 2,40 В; в) 2,43 В.
Серебряный электрод и его уравнение
Электроды второго рода представляют собой металлические электроды, покрытые слоем труднорастворимой соли того же металла. При погружении в раствор соли одноименного аниона его потенциал будет определяться активностью иона в растворе.
а) Хлорсеребряный электрод (ХСЭ) Ag, AgCl|Cl – представляет собой серебряный проводник, покрытый твердым AgCl, который погружен в насыщенный раствор KCl.
Серебро электрохимически взаимодействует со своим ионом:
| Ag + + e – = Ag. |
Уравнение Нернста для этого процесса:
Однако в присутствии труднорастворимого AgCl активность ионов серебра очень мала и ее трудно определить. Но активность ионов Ag + связана с легко задаваемой в данной системе активностью ионов Cl – произведением растворимости хлорида серебра ПРAgCl:
Подставляя это выражение в (7.2)
получим уравнение Нернста для хлорсеребряного электрода:
Потенциалопределяющими являются ионы хлора, а электродный процесс может быть представлен уравнением
б) Каломельный электрод (КЭ) Hg, Hg2Cl2|Cl – – это ртуть, находящаяся в контакте с пастой из смеси ртути и каломели Hg2Cl2, которая, в свою очередь, соприкасается с насыщенным раствором KCl.
Принцип действия каломельного электрода тот же, что и хлорсеребряного.
Источник: all-equa.ru
Схема гальванического элемента состоящего из серебра
СХЕМА РАБОТЫ ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА И ТИПОВЫЕ ЗАДАЧИ
Фундаментальные законы физики и химии, и в том числе, закон сохранения массы и энергии вещества, находят свое подтверждение на уровне перемещения мельчайших частиц – электронов, массами которых в химии обычно пренебрегают.
Речь идет об окислительно-восстановительных процессах, сопровождающихся переходом электронов от одних веществ (восстановителей) к другим (окислителям). Причем вещества могут обмениваться электронами, непосредственно соприкасаясь друг с другом.
Однако существует множество случаев, когда прямого контакта веществ не происходит, а процесс окисления-восстановления все равно идет. А если он идет самопроизвольно, то при этом еще и энергия выделяется. Ее человек с успехом использует для выполнения электрической работы.
Реализуется такая возможность в гальваническом элементе, схема работы которого, а также расчеты, связанные с ним, рассматриваются в данной статье.
Простейший гальванический элемент: схема работы
Гальванический элемент – это прибор, позволяющий при посредстве химической реакции получить электрическую энергию.
Пластинка металла и вода: простые взаимоотношения
Давайте сначала разберемся, что происходит с пластинкой металла, если опустить ее в воду?
Процесс схож с диссоциацией соли: диполи воды ориентируются к ионам металла и извлекают их из пластины. Но почему же тогда не происходит растворения самой пластины в воде? Все дело в строении кристаллической решетки.
Кристаллы соли состоят из катионов и анионов, поэтому диполями воды извлекаются из решетки и те, и другие.
У металла же кристаллическая решетка представлена атомами-ионами. Внутри нее всегда происходит превращение атомов в катионы за счет отщепления валентных электронов и обратный процесс: катионы снова превращаются в атомы, присоединяя электроны. Электроны являются общими для всех ионов и атомов, присутствующих в кристаллической решетке металла.
Процессы внутри металлической кристаллической решетки в обобщенном виде можно показать так:
В итоге, вода, окружающая пластинку – это уже не собственно вода, а раствор, составленный из молекул воды и перешедших в нее из пластины ионов металла. На пластине же возникает избыток электронов, которые скапливаются у ее поверхности, так как сюда притягиваются гидратированные катионы металла.

Возникает так называемый двойной электрический слой.

Бесконечно катионы металла с пластины в раствор уходить не будут, поскольку существует и обратный процесс: переход катионов из раствора на пластину. И он будет идти до тех пор, пока не наступит динамическое равновесие:

На границе раздела «металлическая пластина – раствор» возникает разность потенциала, которая называется равновесным электродным потенциалом металла.
Пластинка металла и раствор его соли: к чему приводит такое соседство
А что произойдет, если металлическую пластинку поместить не в воду, а в раствор соли этого же металла, например, цинковую пластинку Zn в раствор сульфата цинка ZnSO4?
В растворе сульфата цинка уже присутствуют катионы цинка Zn 2+ . Таким образом, при погружении в него цинковой пластины возникнет избыточное количество этих катионов, и уже известное нам равновесие (см. выше) сместится влево. Все это приведет к тому, что отрицательный заряд на пластинке будет иметь меньшее значение, так как меньшее количество катионов с нее будет переходить в раствор. Как результат – более быстрое наступление равновесия и менее значительный скачок потенциала.
Потенциал металла в растворе его же соли в момент равновесия записывают так:

Металл, погруженный в раствор электролита, называют электродом, обратимым относительно катиона.
Цинк – достаточно активный металл. А если речь будет идти о медной пластинке Cu, погруженной в раствор, например, сульфата меди (II) CuSO4?
Медь – металл малоактивный. Двойной электрический слой, конечно же, появится и в этом случае. Но! Катионы из пластинки в раствор переходить не будут. Наоборот, катионы меди (II) Cu 2+ из раствора соли начнут встраиваться в кристаллическую решетку пластинки и создавать положительный заряд на ее поверхности.
Сюда же подойдут сульфат-анионы SO4 2- и создадут вокруг нее отрицательный заряд. То есть распределение зарядов в данном случае будет совершенно противоположным, чем на цинковой пластинке.

Это общая закономерность: пластинки из малоактивных металлов при погружении в раствор их солей всегда заряжаются положительно.
Как устроен гальванический элемент Даниэля-Якоби, или Так где же все-таки электрический ток?
Известно, что электрический ток – это направленное движение заряженных частиц (электронов).
На активном металле скапливаются электроны, а поверхность малоактивного металла, заряжается положительно. Если соединить проводником (например, металлической проволокой) оба металла, то электроны с одного перейдут на другой, а двойной электрический слой перестанет существовать. Это будет означать возникновение электрического тока.
Причем, ток возникает за счет окислительно-восстановительного процесса: активный металл окисляется (так как отдает электроны малоактивному), а малоактивный металл восстанавливается (так как принимает электроны от активного). Металлы друг с другом не соприкасаются, а взаимодействуют через посредника: внешнего проводника. Данная схема и есть схема гальванического элемента. Именно так устроен и работает гальванический элемент Даниэля-Якоби:
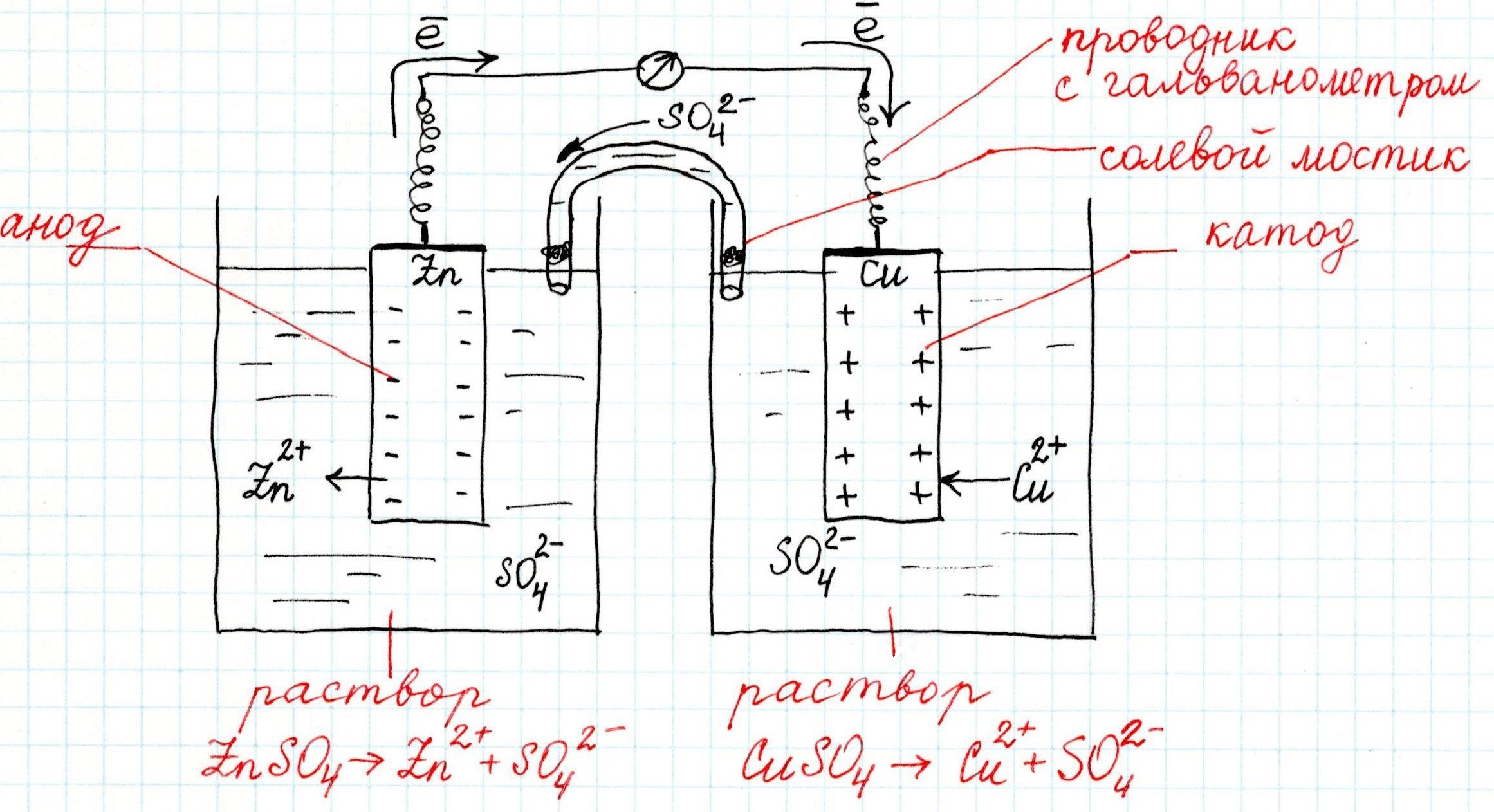
В схеме элемента показан «солевой мостик». Он представляет собой трубку, в которой присутствует электролит, не способный взаимодействовать ни с электродами (катодом или анодом), ни с электролитами в пространствах у электродов. Например, это может быть раствор сульфата натрия Na2SO4. Подобный мостик нужен для того, чтобы уравновешивать (нейтрализовать) заряды, образующиеся в растворах гальванического элемента.
Таким образом, возникшая электрическая цепь замыкается: анод → проводник с гальванометром → катод → раствор в катодном пространстве → «солевой мостик» → раствор в анодном пространстве → анод.
Анод – электрод, на котором происходит окисление (цинковая пластинка):

Электроны цинка Zn отправляются по внешней цепи (то есть по проводнику) на катод.
Катод – электрод, на котором происходит восстановление (медная пластинка):

Катионы меди Cu 2+ , пришедшие на пластинку из раствора сульфата меди (II), получают электроны цинкового анода.
В общем виде весь процесс окисления-восстановления в гальваническом элементе выглядит так:

Для любого гальванического элемента можно составить запись в виде схемы. Например, для приведенного элемента Даниэля-Якоби она будет выглядеть так:
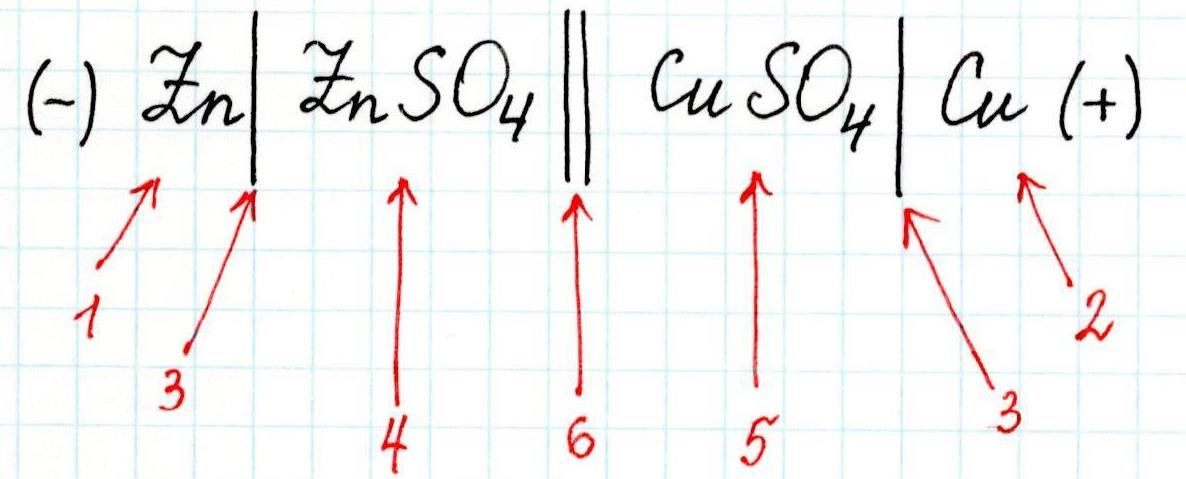
3 – скачок потенциала (граница раздела фаз);
4 – электролит в анодном пространстве;
5 – электролит в катодном пространстве;
6 – граница между растворами (солевой мостик).

Или сокращенно:
Типовые задачи на схему гальванического элемента: примеры решения
По вопросу, рассмотренному в данной статье, возможны два основных вида задач.
Задача 1. Составьте схему гальванического элемента, в котором протекает реакция:

Решение:

Задача 2. Напишите электродные и суммарные уравнения реакций, протекающих в гальваническом элементе:

Решение:

Итак, разобрав принцип работы гальванического элемента, мы научились записывать схему его работы и определять основные процессы на электродах.
Составление уравнений электродных процессов и суммарной реакции, происходящей при работе гальванического элемента
Задача 652.
Гальванический элемент состоит из серебряного электрода, погруженного в 1 М раствор AgNO3, и стандартного водородного электрода. Написать уравнения электродных процессов и суммарной реакции, происходящей при работе элемента. Чему равна его э.д.с.?
Решение:  (2H+/H2) = 0,00 B;
(2H+/H2) = 0,00 B;  (Ag + /Ag) = 0,80 B. Поскольку
(Ag + /Ag) = 0,80 B. Поскольку  (2H + /H2) + /Ag), то водородный электрод будет служить отрицательным полюсом (электродом) и электроны будут перемещаться во внешней цепи от водородного электрода к серебряному электроду, т. е. водород является анодом – электродом, на котором протекает окислительный процесс:
(2H + /H2) + /Ag), то водородный электрод будет служить отрицательным полюсом (электродом) и электроны будут перемещаться во внешней цепи от водородного электрода к серебряному электроду, т. е. водород является анодом – электродом, на котором протекает окислительный процесс:
Серебро, потенциал которой +0,80 В, — катод, т.е. электрод, на котором протекает восстановительный процесс:
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов, получим
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т.е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
(Ag + /Ag) — (2H + /H2) = 0,80B — 0,00B = +0,80 B
Ответ: +0,80В.

Задача 653.
Э. д. с. гальванического элемента, состоящего из стандартного водородного электрода и свинцового электрода, погруженного в 1 М раствор соли свинца, равна 126 мВ. При замыкании элемента электроны во внешней цепи перемещаются от свинцового к водородному электроду. Чему равен потенциал свинцового электрода? Составить схему элемента. Какие процессы протекают на его электродах?
Решение:
(2H + /H2) = 0,00 B. По условии задачи электроны во внешней цепи гальванического элемента перемещаются от свинцового к водородному электроду, значит, на свинцовом электроде протекает окислительный процесс:
А на водородном – восстановительный:
Таким образом, свинцовый электрод будет анодом, а водородный – катодом.
Уравнение окислительно-восстановительного процесса, протекающего при работе данного гальванического элемента, можно получить, сложив электронные процессы на электродах:
Для расчета электродного потенциала свинца, можно использовать уравнение определения ЭДС гальванического элемента:
E = (катод) — (анод)
Подставив в уравнение данные задачи, получим:
Е =  (2H + /H2) —
(2H + /H2) —  (Pb 2+ /Pb);
(Pb 2+ /Pb);  (Pb 2+ /Pb) =
(Pb 2+ /Pb) =  (2H+/H2) — E = 0,00 — 126 = -126м В (-0,126 B)
(2H+/H2) — E = 0,00 — 126 = -126м В (-0,126 B)
Ответ: -0,126В.
Задача 654.
Рассчитать электродные потенциалы магния в растворе его соли при концентрациях иона Mg 2+ 0,1, 0,01 и 0,001 молы/л.
Решение:
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация (при точных измерениях активность) гидратированных ионов металла в растворе. Е 0 для магния равен -2,34 В.
Определим электродные потенциалы магния в растворах при разных значениях концентрации его ионов:
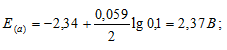
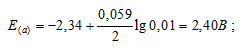
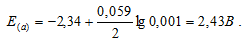
Ответ: а) 2,37 В; б) 2,40 В; в) 2,43 В.
Источник: remnabor.net