Теория Бора позволила разрешить очень важный вопрос о расположении электронов в атомах различных элементов и установить зависимость свойств элементов от строения электронных оболочек их атомов.
В настоящее время разработаны схемы строения атомов всех химических элементов. При построении этих схем ученые исходили из богатейшего опытного материала, накопленного при изучении оптических и рентгеновых спектров, а также из общих соображений об устойчивости различных комбинаций электронов. Но основной путеводной нитью служил им периодический закон.
Нужно, однако, иметь в виду, что все эти схемы отнюдь не являются чем-то законченным, твердо установленным; они пред ставляют собой лишь более или менее достоверную гипотезу,позволяющую объяснить многие физические и химические свойства элементов.
Презентация «Строение электронных оболочек атомов» 8 класс

Габриелян О. С. 8 класс §9 «Строение электронных оболочек атомов»

Ядро Электронный слой Строение электронных оболочек атомов
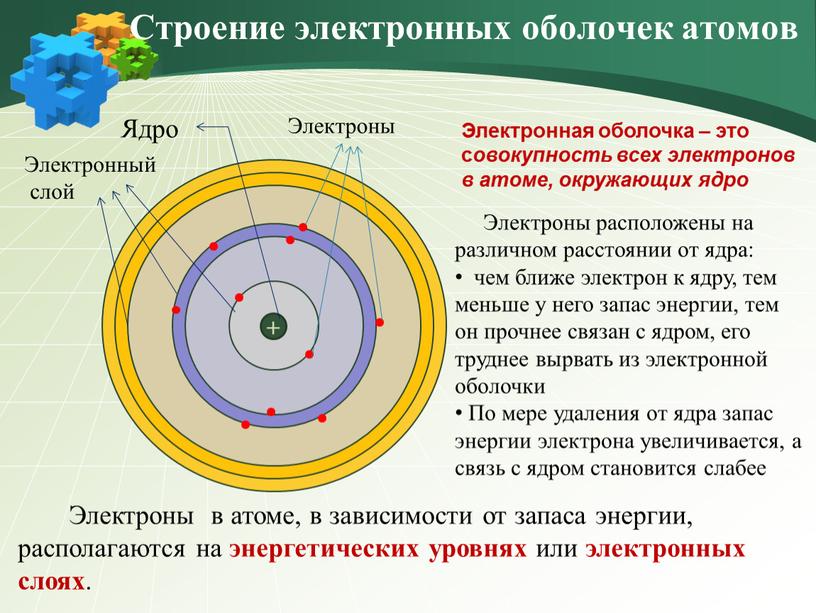
Строение электронных оболочек атомов
Электроны расположены на различном расстоянии от ядра:
чем ближе электрон к ядру, тем меньше у него запас энергии, тем он прочнее связан с ядром, его труднее вырвать из электронной оболочки
По мере удаления от ядра запас энергии электрона увеличивается, а связь с ядром становится слабее
Электронная оболочка – это совокупность всех электронов в атоме, окружающих ядро
Электроны в атоме, в зависимости от запаса энергии, располагаются на энергетических уровнях или электронных слоях.
Число электронных слоёв в атоме равно номеру периода в котором находится элемент
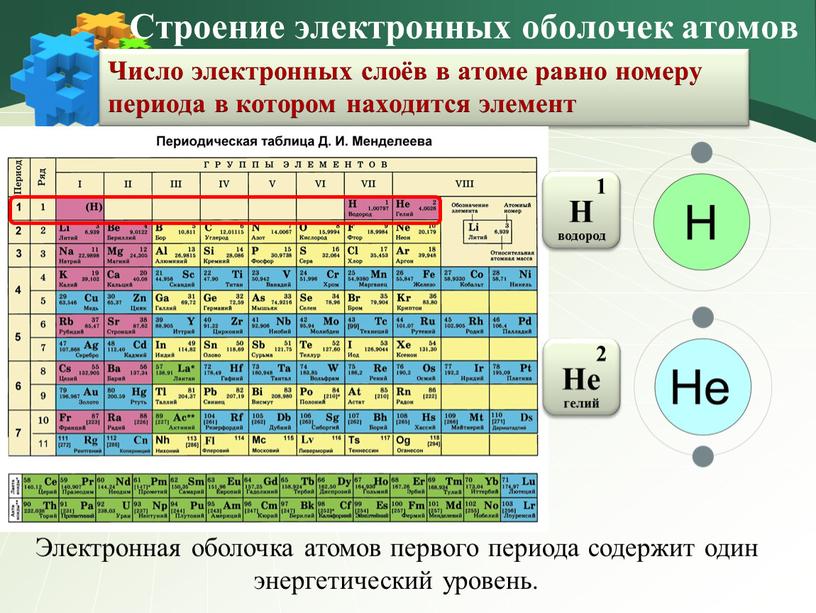
Число электронных слоёв в атоме равно номеру периода в котором находится элемент
Строение электронных оболочек атомов
Электронная оболочка атомов первого периода содержит один энергетический уровень.
Электронная оболочка атомов второго периода содержит по два энергетических уровня
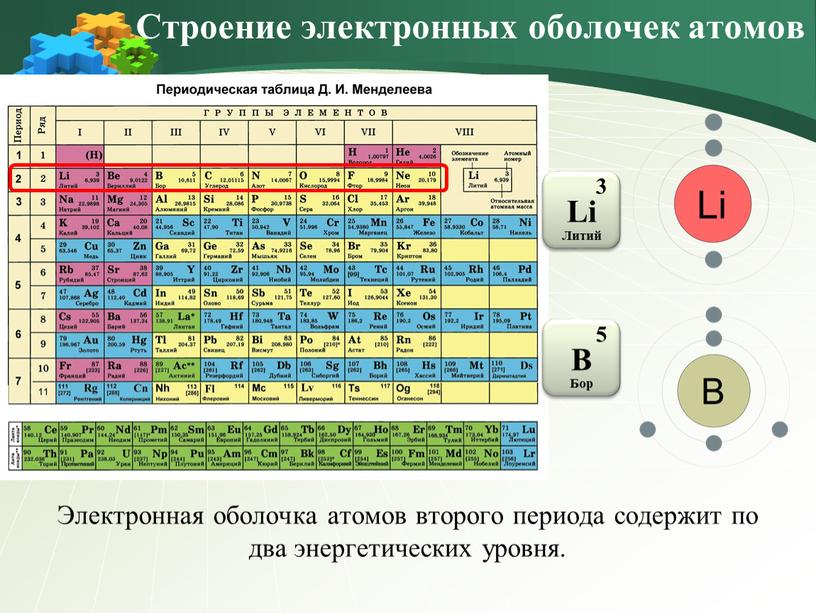
Электронная оболочка атомов второго периода содержит по два энергетических уровня.
Строение электронных оболочек атомов
Электронная оболочка атомов третьего периода содержит по три энергетических уровня
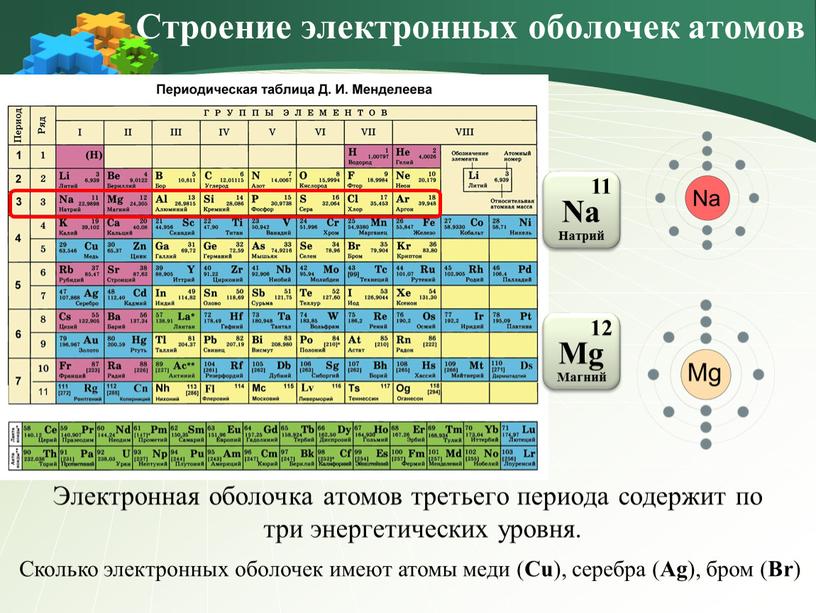
Электронная оболочка атомов третьего периода содержит по три энергетических уровня.
Строение электронных оболочек атомов
Сколько электронных оболочек имеют атомы меди (Cu), серебра (Ag), бром (Br)
Максимальное число электронов, находящихся на энергетическом уровне можно определить по следующей формуле: 1 эн

Максимальное число электронов, находящихся на энергетическом уровне можно определить по следующей формуле:
1 эн.ур. : 2 • 12 = 2
2 эн.ур. : 2 • 22 = 8
3 эн.ур. : 2 • 32 = 18
4 эн.ур. : 2 • 42 = 32
Строение электронных оболочек атомов
номер энергетического уровня
Энергетические уровни, содержащие максимальное число электронов, называются завершенными. Они обладают повышенной устойчивостью и стабильностью
Энергетические уровни, содержащие меньшее число электронов, называются незавершенными
Составим схемы строения электронных оболочек атомов химических элементов 1 периода

Составим схемы строения электронных оболочек атомов химических элементов 1 периода
Строение электронных оболочек атомов
Составим схемы строения электронных оболочек атомов химических элементов 2 периода
Составим схемы строения электронных оболочек атомов химических элементов 3 периода
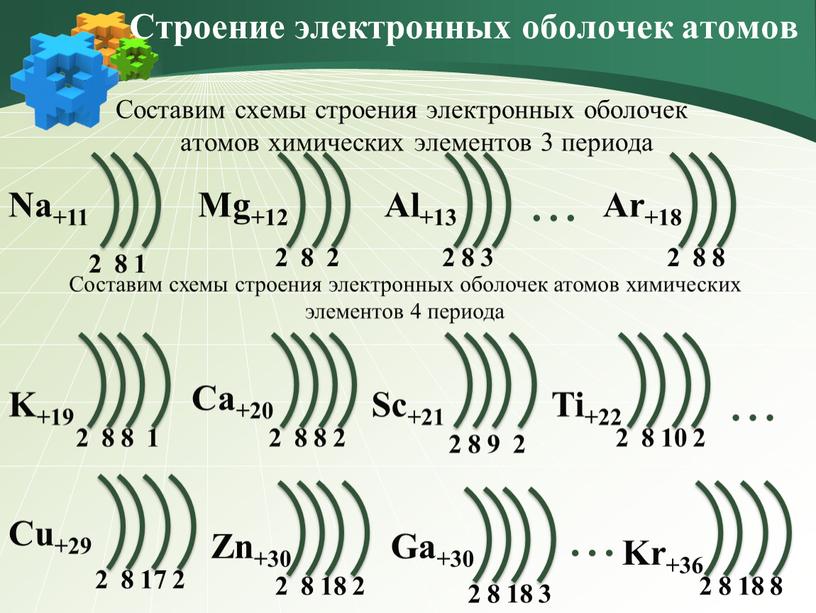
Составим схемы строения электронных оболочек атомов химических элементов 3 периода
Строение электронных оболочек атомов
Составим схемы строения электронных оболочек атомов химических элементов 4 периода
Строение электронных оболочек атомов
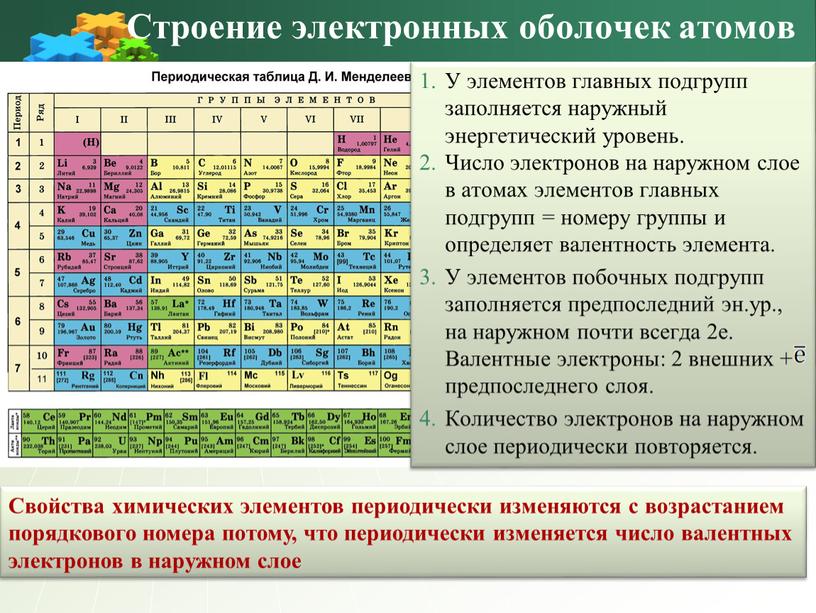
Строение электронных оболочек атомов
У элементов главных подгрупп заполняется наружный энергетический уровень.
Число электронов на наружном слое в атомах элементов главных подгрупп = номеру группы и определяет валентность элемента.
У элементов побочных подгрупп заполняется предпоследний эн.ур., на наружном почти всегда 2е. Валентные электроны: 2 внешних + предпоследнего слоя.
Количество электронов на наружном слое периодически повторяется.
Свойства химических элементов периодически изменяются с возрастанием порядкового номера потому, что периодически изменяется число валентных электронов в наружном слое
Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называют орбиталью
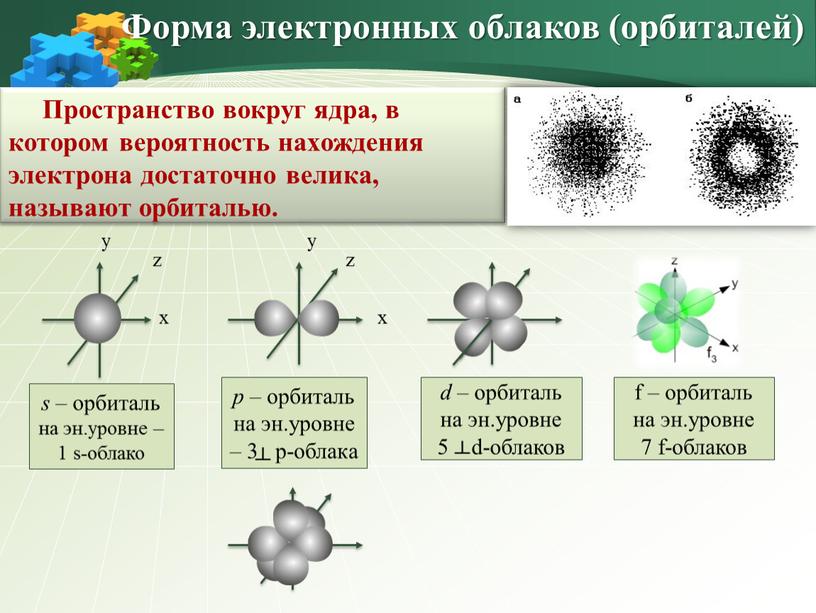
Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называют орбиталью.
Форма электронных облаков (орбиталей)
s – орбиталь
на эн.уровне – 1 s-облако
р – орбиталь
на эн.уровне – 3 р-облака
d – орбиталь
на эн.уровне
5 d-облаков
f – орбиталь
на эн.уровне
7 f-облаков
Электроны вращаются вокруг своей оси
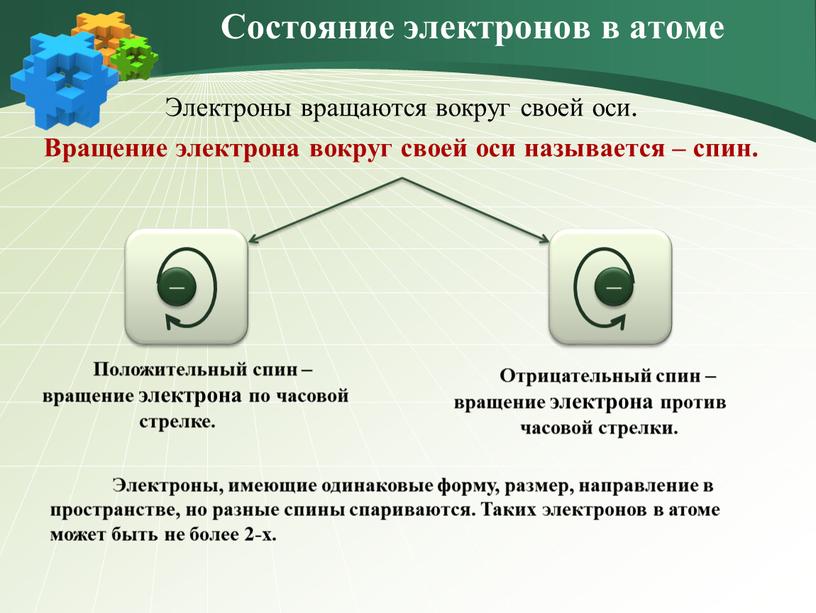
Электроны вращаются вокруг своей оси.
Вращение электрона вокруг своей оси называется – спин.
Состояние электронов в атоме
Положительный спин –
вращение электрона по часовой
стрелке.
Отрицательный спин –
вращение электрона против
часовой стрелки.
Электроны, имеющие одинаковые форму, размер, направление в пространстве, но разные спины спариваются. Таких электронов в атоме может быть не более 2-х.
Энергетические уровни делятся на подуровни: s, p, d, f

Энергетические уровни делятся на подуровни: s, p, d, f.
Число подуровней равно номеру уровня. Каждый новый уровень
начинается с s-подуровня.
1 эн.ур. – 1 подуровень: s – 1s-облако — 2 электрона
2 эн.ур. – 2 подуровня: s – 1s-облако — 2 электрона
р – 3р-облака — 6 электронов
3 эн.ур. – 3 подуровня: s – 1s-облако — 2 электрона
р – 3р-облака — 6 электронов
d – 5d-облаков — 10 электронов
4 эн.ур. – 4 подуровня s – 1s-облако — 2 электрона
р – 3р-облака — 6 электронов
d – 5d-облаков — 10 электронов
f – 7f-облаков — 14 электронов
Строение электронных оболочек атомов
Источник: znanio.ru
Строение электронных оболочек атомов — ГДЗ Габриелян Сладков 8 класс рабочая тетрадь
1. Совокупность электронов в атоме называется электронной оболочкой.
2. Электроны на электронной оболочке атома располагаются по электронным слоям, или энергетическим уровням.

3. Номер периода соответствует числу электронных слоев в атоме химического элемента.
4. Номер группы соответствует числу электронов на внешнем энергетическом уровне.
5. Запишите схемы строения электронных оболочек атомов химических элементов с порядковыми номерами с 1-го по 10-й в таблице Д.И. Менделеева, а также калия и кальция.

ЧАСТЬ 2.
1. В приведенном перечне: мышьяк, теллур, германий, йод, селен, полоний, астат, — число элементов, в атомах которых по шесть электронов на внешнем энергетическом уровне, равно:
1) одному
2) двум
3) трем
4) четырем
2. Атомы химических элементов 4-го периода имеют одинаковое число:
1) электронов и на внешнем энергетическом уровне
2) нейтронов
3) энергетических уровней
4) протонов
3. Установите соответствие между символом химического элемента (в заданном порядке) и числом электронов на внешнем энергетическом уровне его атома. Из букв, соответствующих правильным ответам, вы составите название установки, которая позволит человечеству еще глубже познать строение атома: коллайдер.

4. Установите соответствие между символом химического элемента (в заданном порядке) и числом энергетических уровней в электронной оболочке атома. Из букв, соответствующих правильным ответам, вы составите название частиц, в свою очередь, состоят протоны и нейтроны: кварки.

5. Верны ли следующие суждения?
А. Число электронов в электронной оболочке атома Cl равно 7.
Б. Число электронов на внешнем энергетическом уровне атома Br равно 35.
4) Оба суждения неверны.
6. Вычеркните «лишний» химический элемент из ряда P, Be, S, N, Ne , Ca, H.
По признаку завершенности внешнего электронного слоя атома.
7. Предложите алгоритм оставления электронной схемы атома химического элемента.
1. Определить общее число электронов на оболочке по порядковому номеру;
2. Определить число энергетических уровней по номеру периоды;
3. Определить число вншних электронов по номеру группы;
4. Рассчитать число электронов на предпоследнем уровне, предварительно указав число электронов на всех уровнях.
8. Сравните строение электронных оболочек атомов Ca и Mg.
1) сходство : на внешнем уровне есть одинаковое число электронов, равное 2.
кальций 2e8e8e2e, магний 2e8e2e.
2) различие : в числе энергетических уровней, у кальция 4, у магния 3.
Источник: gdz-himiya.ru