Все словари русского языка: Толковый словарь, Словарь синонимов, Словарь антонимов, Энциклопедический словарь, Академический словарь, Словарь существительных, Поговорки, Словарь русского арго, Орфографический словарь, Словарь ударений, Трудности произношения и ударения, Формы слов, Синонимы, Тезаурус русской деловой лексики, Морфемно-орфографический словарь, Этимология, Этимологический словарь, Грамматический словарь, Идеография, Пословицы и поговорки, Этимологический словарь русского языка.
Уважаемый пользователь, сайт развивается и существует только на доходы от рекламы — пожалуйста, отключите блокировщик рекламы.
щёлочноземельные металлы
Энциклопедический словарь
Щёлочноземе́льные мета́ллы — химические элементы Са, Sr, Ba, Ra. Названы так потому, что их оксиды — «зе́мли» (по терминологии алхимиков) — сообщают воде щелочную реакцию. Иногда к щёлочноземельным металлам относят также Be и Mg.
ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ — ЩЕЛОЧНОЗЕМЕ́ЛЬНЫЕ МЕТА́ЛЛЫ, химические элементы Ве, Мg, Ca, Sr, Ba, Ra. Названы так потому, что их оксиды — «земли» (по терминологии алхимиков) — сообщают воде щелочную реакцию.
Химия 9 класс (Урок№24 — Щелочноземельные металлы. Важнейшие соединения и их применение.)
Иллюстрированный энциклопедический словарь
ЩЁЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ: кальций Ca, стронций Sr, барий Ba, радий Ra. Химически активны, при обычных условиях реагируют с водой. Соли щёлочноземельных металлов, кроме Ra, широко распространены в природе в виде минералов, например гипс CaSO4´2H2O.
Полезные сервисы
щелочноземельные металлы
Энциклопедия Кольера
ПОДГРУППА IIA
БЕРИЛЛИЙ, МАГНИЙ И ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ КАЛЬЦИЙ, СТРОНЦИЙ, БАРИЙ, РАДИЙ
Строго говоря, эта подгруппа состоит из двух типов элементов. Бериллий и магний элементы коротких периодов более сходны между собой, чем с другими четырьмя элементами, которые собственно и образуют семейство щелочноземельных металлов. Фактически, бериллий и в меньшей степени магний более сходны с первыми элементами подгруппы IIIA.
Особенностью электронного строения любого элемента подгруппы IIA является наличие двух электронов на внешнем слое и внутренняя электронная структура по типу предыдущего благородного газа. Способность отдавать два внешних валентных электрона возрастает в подгруппе с увеличением атомного радиуса и атомного номера элемента. Максимальная степень окисления составляет II, но имеются сведения о существовании соединений со степенью окисления I. Такие соединения неустойчивы и диспропорционируют с образованием свободного металла и иона М(II).
Физические и химические свойства. Все элементы подгруппы IIA химически активны и поэтому в свободном состоянии в природе не существуют. Щелочноземельные металлы энергично реагируют с водой, вытесняя водород и образуя гидроксиды, как и щелочные металлы. Магний взаимодействует только с кипящей водой, а бериллий не реагирует даже с парами при высокой температуре.
Бериллий отличается от остальных элементов подгруппы и даже от магния по химическим и многим физическим свойствам. Такое отличие характерно для всех элементов, начинающих подгруппы А, что объясняется малым радиусом иона и соответственно высокой зарядовой плотностью. Особенности и отличия свойств бериллия приведены ниже.
Щелочноземельные металлы — Все свойства!
Физические свойства. Бериллий очень твердый материал и способен оставлять царапины на стекле; твердость других элементов подгруппы уменьшается, и барий по твердости близок к свинцу (табл. 3).
Кристаллическая структура. Различие в физических свойствах всех металлов этой подгруппы объясняется различием их кристаллической структуры, а кальций имеет две модификации.
Взаимодействие с кислотами. Все эти элементы реагируют с разбавленными растворами минеральных кислот (типа HCl), а бериллий растворяется менее энергично. Соли бериллия (продукты реакций бериллия с кислотами, например, BeCl2) имеют более ковалентную связь, чем соли других металлов этой подгруппы, и поэтому обладают в растворе меньшей электропроводностью. В водных растворах соли бериллия гидратированы благодаря малому радиусу иона Be2+ и сильному взаимодействию с дипольными молекулами воды. Бериллий в отличие от других металлов плохо реагирует с азотной кислотой, так как на поверхности образуется защитная пассивирующая пленка BeO.
Карбонаты. Невозможно образование BeCO3 в растворе из-за сильного взаимодействия иона Be2+ c кислородом воды или OH. По той же причине и карбонат магния MgCO3, образующийся в растворе, содержит некоторую долю ассоциированного с ним основания Mg(OH)2. Другие металлы образуют в этих условиях средние карбонаты. Связь BeO в карбонате бериллия BeОCO2 настолько прочна, что эта соль способна разлагаться на BeO и CO2.
Оксиды и гидроксиды. При взаимодействии с кислородом Be и Mg образуют оксиды МО, а другие, более активные металлы, могут образовывать и пероксиды, например BaO2. Пероксиды могут образовываться и по реакции гидроксидов Ca, Sr и Ba с H2O2. Растворимость гидроксидов возрастает по мере увеличения радиуса иона и ослабления притяжения между ионом металла и гидроксид-ионом.
Комплексообразование. Ион Be2+ обладает высоким химическим сродством к ионам или молекулам, имеющим электронную пару. Например, 2 иона :Cl:предоставляют две электронные пары для образования химической связи в :Cl:Be:Cl:, 4 электрона распределяются на 2s- и 2p-гибридизованных орбиталях, формируя линейное строение молекулы BeCl2 с ковалентными свойствами. Be2+ способен удерживать большее число электронных пар, образуя различные комплексные ионы с координационным числом 4 (наиболее стабильные лиганды гидроксид-ион, альдегид, эфир, дикарбоновые кислоты, дикетоны). Be2+, как и другие члены подгруппы IIA, образует устойчивые комплексы с этилендиаминтетрауксусной кислотой (ЭДТА). Благодаря прочности комплексов с ЭДТА эта кислота часто используется для анализа содержания кальция и магния
Источники сырья и применение. Все металлы подгруппы и их соединения находят различное промышленное применение. Бериллий получают из минерала берилла, отделяя гидроксид от сопутствующего алюминия. Гидроксид переводят в хлорид или фторид, и металл получают электролизом расплава галогенида.
Добавки бериллия к меди приводят к получению твердого, не искрящего, прочного сплава, который широко используется в специальных пружинах и инструментах для работы во взрывоопасной атмосфере. Металл прозрачен для рентгеновского излучения и поэтому из него изготовляют окна в рентгеновских трубках.
Ядро бериллия имеет низкое поперечное сечение захвата нейтронов, поэтому бериллий используется как оболочка урановых стержней в ядерных реакторах. Получение металлического магния важный технологический процесс. Металл трудно обрабатывать и сваривать из-за его воспламеняемости. Многие сплавы магния находят применение в промышленности.
Чистый металл получают из морской воды или богатых рассолов осаждением в виде Mg(OH)2. Гидроксид прокаливают, образующийся оксид переводят в хлорид MgCl2, который подвергают электролизу, выделяя чистый магний. Для этих же целей можно получать оксид магния прокаливанием доломита, содержащего MgCO3. Во время Второй мировой войны был разработан процесс получения Mg восстановлением MgO угольной пылью и парами нефти.
Остальные металлы этой подгруппы получают электролизом расплавов их солей, они также имеют несколько крупных областей применения. Так, прокаливание известняка (минерал, содержащий CaCO3, MgCO3 и силикаты) с целью получения оксида кальция негашеной извести является многотоннажным производством. При частичной гидратации получается гашеная известь.
Оба продукта применяются в производстве цемента, штукатурки и строительного раствора. Сульфат кальция соcтава CaSO4Ч0,5H2O известен как гипс, который при смешении с водой затвердевает с небольшим расширением в результате образования CaSO4*2H2O. См. также КАЛЬЦИЙ.
Радий. Радий существенно отличается от остальных элементов подгруппы IIA: он радиоактивен, при его распаде испускаются a- и g-частицы. По свойствам он близок к барию, особенно по растворимости (кроме растворимости хлоридов), химической активности и физическим свойствам. Радий и его соединения применяются в промышленности светящихся красок. Урановая смолка (урановая руда) содержит следы радия и служит основным источником мировой добычи радия, всего несколько сот граммов.
Источник: sanstv.ru
Щелочноземельные металлы
Щелочноземельными эти металлы называют, т.к. они содержатся во всех минералах земли — поэтому «земельные», а «щелочные» — т.к. они придают воде щелочную реакцию.
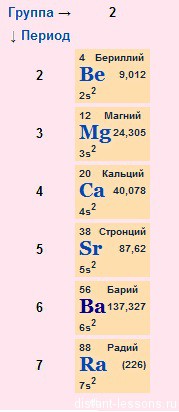
Строение электронных оболочек
Электронное строение внешнего слоя у всех этих элементов одинаково – на нем всего 2 электрона на s-подуровне:
n S 2
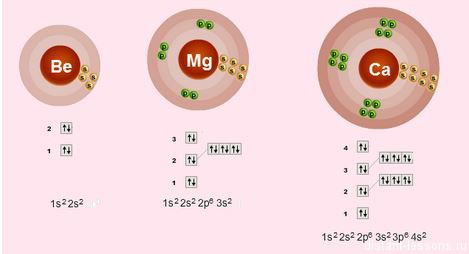
Что это означает?
- Валентности элементов = 2, т.е. каждый атом может образовывать 2 связи.
- Степень окисления элементов = +2 – металлические свойства – это способность отдавать электроны
- Сверху вниз в подгруппе радиус атома увеличивается, следовательно, электроны все слабее притягиваются к ядру атома, следовательно, сверху вниз металлические свойства увеличиваются – Ba более сильный металл, чем Be.
- Как следствие этого сверху вниз в подгруппе усиливаются восстановительные свойства.
Физические свойства щелочно-земельных металлов

Общие характеристики:
- все металлы сероватого цвета,
- твердые, ножом, как щелочные металлы, их уже, конечно, не порежешь
- плотность больше 1,
- на воздухе элементы достаточно устойчивы, но покрываются оксидной пленкой,
- окрашивают пламя в разный цвет (это используют для получения разных цветов пламени в пиротехнике):
Ca — в кирпично-красный
- Электро- и теплопроводны
Химические свойства металлов
Имеет смысл рассмотреть химические свойства по таблице классификации неорганических соединений.
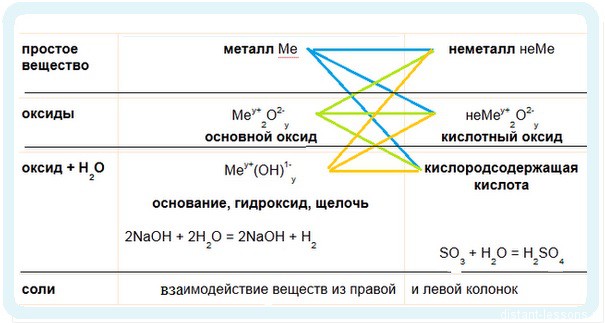
1. Идем по синим стрелочкам — взаимодействие металлов:
Металлы традиционно проявляют металлические — восстановительные свойства.

2. Идем по зеленым стрелочкам — реакции для оксидов

3. Идем по оранжевым стрелочкам
![]()
Обратите внимание, что гидроксиды щелочноземельных металлов либо малорастворимы, либо нерастворимые, поэтому их образование может служить качественной реакцией.
Be(OH)2 — амфотерный гидроксид, он может реагировать как с основаниями, так и с кислотами!
3. Щелочноземельные металлы с водородом также образуют гидриды.
![]()
Как мы уже говорили, сверху вниз в подгруппе металлические свойства элементов возрастают. Водород, хоть и находится в первой группе при реакции с щелочноземельными металлами будет проявлять отрицательную степень окисления.
Как определить качественные реакции? Загляните в таблицу растворимости!
Be(OH)2 — гелеобразный белый осадок;
Сa(OH)2 — белый осадок;
Mg(OH)2 — белесый осадок;
Фториды — белесо-бесцветные осадки;
Сульфиты и сульфаты — белые осадки.
Как видите, цвета осадков не отличаются цветовым разнообразием
Получение щелочно-земельных металлов
Обычно щелочноземельные металлы получают электролизом расплавов их солей:
CaCl2 (электролиз) → Ca + Cl2
Источник: distant-lessons.ru
Щелочноземельные металлы

Щелочноземельные металлы — простые вещества, группа элементов таблицы Менделеева, имеющие сходные свойства. К ним относят бериллий, магний, кальций, стронций, барий и радий. Название группы объясняется тем, что элементы способны образовывать щелочи, а их оксиды похожи некоторыми свойствами на окислы алюминия и железа, которые раньше называли «землями».
Щелочноземельные металлы отличаются химической активностью, поэтому в чистом виде не встречаются. Входят в состав минералов. Больше всего на Земле кальция — он содержится в мраморах, гранитах, известняках. Барий и радий встречаются редко. Радий всегда сопутствует урановым рудам.
Все элементы — твердые вещества, ножом можно резать только стронций. Все — серебристо-серые, обладают такими классическими металлическими свойствами, как электропроводность и теплопроводность.
Химическая активность возрастает по мере увеличения размера атома, от бериллия к радию. Бериллий покрывается на воздухе оксидной пленкой и дальше уже вступает в реакции только со фтором или при очень высоких температурах. Магний тоже окисляется на поверхности и далее ведет себя достаточно пассивно. Кальций постепенно весь окисляется во влажном воздухе, горит, стоит его слегка нагреть, растворяется в воде. Барий, стронций и радий на воздухе взаимодействуют не только с кислородом, но и с азотом, поэтому для хранения их помещают в герметичные емкости и заливают керосином.
 |
 |
 |
| Кальций окись | Магний металлический (стружка) | Магнесальт (бишофит) |
Щелочноземельные металлы растворяются в кислотах, образуют соли. С водой образуют щелочи, сила которых растет от магния к радию. Все, кроме бериллия и магния, легко реагируют с неметаллами.
Cа и Mg являются важными биогенными элементами. Кальций нужен для скелета, зубов животных и людей, работы мышц; регулирует свертываемость крови.
Магний содержится в живых клетках, он есть в хлорофилле, способствует функционированию ферментных реакций, нервной системы, синтезу нуклеиновых кислот. В очень небольших количествах в нашем организме есть и стронций. Барий, радий, бериллий и их соединения токсичны для всего живого.

- Бериллий входит в состав большого количества минералов, например, изумруда, аквамарина, гелиодора. Используется при выпуске сплавов, в том числе для атомных станций; топлива для ракет.
- Кальций — составная часть многих стройматериалов. Востребован в производстве огнеупорных материалов, топлива, лекарственных веществ.
- Магний — легкий металл, хорошо поддающийся обработке ковкой, прокатом и т.п. Обладает восстановительными свойствами, востребованными в металлотермии. Входит в состав многих современных магниевых сплавов; из них изготавливают листы, профили, детали, для которых имеет значение вес, например, корпуса ноутбуков, смартфонов. Магниевые сплавы нужны в авиационной, автомобильной, электронной, космической, военной, приборостроительной отраслях. Магний содержится в магнезите, бишофите (магнесальте), карналлите, доломите и др. Соли магния определяют жесткость воды, их много в морской воде.
- Стронций и его соли содержатся как примеси во многих минералах. Промышленное значение имеют целестин и стронцианит. Основные сферы применения — радиоэлектроника; металлургия (легирование сплавов, удаление серы из сталей, чугуна, меди); атомная энергетика; пиротехника (окрашивает пламя в ярко-красный цвет); производство магнитных материалов, чистого урана, сверхпроводящей керамики; изготовление вакуумных приборов, химических источников тока. Изотоп стронция применяется в медицине как средство против злокачественных опухолей.
- Барий добывают из таких минералов, как барит, витерит. Соединения бария применяются в атомной энергетике, вакуумных приборах, для получения оптических линз, стекол для урановых стержней, пьезоэлектрических приборов, сверхпроводящей керамики; источников тока; металлических жидких теплоносителей. Сульфат бария не водорастворим, поэтому не токсичен. Используется в рентгеноскопии как контрастное вещество.
- Радий — самый редкий элемент из группы щелочноземельных металлов. К настоящему времени, ученые всего мира смогли получить лишь 1,5 кг чистого вещества. Радиоактивен. Востребован в ядерных исследованиях, в медицинских целях для облучения опухолей. В 70-х годах на основе радия часто делали светящиеся краски для подсветки элементов приборов, стрелок и т.п. Сейчас от этой практики отказались, так как радий очень опасен для человека, даже в микроскопических дозах.
141009, Московская область г.Мытищи, Олимпийский пр-кт, 2Б
Источник: pcgroup.ru