Кремний – четырнадцатый элемент Периодической таблицы. Обозначение – Si от латинского «silicium». Расположен в третьем периоде, IVА группе. Относится к неметаллам. Заряд ядра равен 14.
Кремний – один из самых распространенных в земной коре элементов. Он составляет 27% (мас.) доступной нашему исследованию части земной коры, занимая по распространенности второе место после кислорода. В природе кремний встречается только в соединениях: в виде диоксида кремния SiO2, называемого кремниевым ангидридом или кремнеземом, в виде солей кремниевых кислот (силикатов). Наиболее широко в природе распространены алюмосиликаты, т.е. силикаты, в состав которых входит алюминий. К ним относятся полевые шпаты, слюды, каолин и др.
Как углерод, входя в состав всех органических веществ, кремний является важнейшим элементом растительного и животного царства.
В обычных условиях кремний представляет собой вещество темно-серого цвета (рис. 1). По внешнему виду похож на металл. Тугоплавок – температура плавления равна 1415 o С. Характеризуется высокой твердостью.
Nathan Evans — Wellerman (Sea Shanty)

Рис. 1. Кремний. Внешний вид.
Атомная и молекулярная масса кремния
Относительной молекулярная масса вещества (Mr) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (Ar) — во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Поскольку в свободном состоянии кремний существует в виде одноатомных молекул Si, значения его атомной и молекулярной масс совпадают. Они равны 28,084.
Аллотропия и аллотропные модификации кремния
Кремний может существовать в виде двух аллотропных модификаций: алмазоподобной (кубической) (устойчивая) и графитоподобной (неустойчивая). Алмазоподобный кремний находится в твердом агрегатном состоянии, а графитоподобный – в аморфном. Они также различаются по внешнему виду и химической активности.
Кристаллический кремний представляет собой вещество темно-серого цвета с металлическим блеском, а аморфный – порошок бурого цвета. Вторая модификация обладает большей реакционной способностью, чем первая.
Изотопы кремния
Известно, что в природе кремний может находиться в виде трех стабильных изотопов 28 Si, 29 Si и 30 Si. Их массовые числа равны 28, 29 и 30 соответственно. Ядро атома изотопа кремния 28 Si содержит четырнадцать протонов и четырнадцать нейтронов, а изотопов 29 Si и 30 Si – такое же количество протонов, пятнадцать и шестнадцать нейтронов соответственно.
Существуют искусственные изотопы кремния с массовыми числами от 22- х до 44-х, среди которых наиболее долгоживущим является 32 Si с периодом полураспада равным 170 лет.
Ионы кремния
На внешнем энергетическом уровне атома кремния имеется четыре электрона, которые являются валентными:
PSY — GENTLEMAN M/V
1s 2 2s 2 2p 6 3s 2 3р 2 .
В результате химического взаимодействия кремний может отдавать свои валентные электроны, т.е. являться их донором и превращаться в положительно заряженный ион, или принимать электроны от другого атома, т.е. быть акцептором, и превращается в отрицательно заряженный ион:
Молекула и атом кремния
В свободном состоянии кремний существует в виде одноатомных молекул Si. Приведем некоторые свойства, характеризующие атом и молекулу кремния:
Энергия ионизации атома, эВ
Радиус атома, нм
Сплавы кремния
Кремний используется в металлургии. Он служит составной частью многих сплавов. Важнейшие из них – это сплавы на основе железа, меди и алюминия.
Примеры решения задач
| Задание | Сколько потребуется оксида кремния (IV), содержащего 0,2 массовых примесей, чтобы получить 6,1 г силиката натрия. |
| Решение | Запишем уравнение реакции получения силиката натрия из оксида кремния (IV): |
Найдем количество вещества силиката натрия:
M(Na2SiO3) = 2×Ar(Na) + Ar(Si) + 3×Ar(O) = 2×23 + 28 + 3×16 = 122 г/моль.
Масса оксида кремния (IV) (без примесей) будет равна:
M(SiO2) = Ar(Si) + 2×Ar(O) = 28 + 2×16 = 28 + 32 = 60 г/моль.
Тогда масса оксида кремния (IV), необходимая для реакции будет равна:
| Задание | Какую массу силиката натрия можно получить при сплавлении оксида кремния (IV) с 64,2 г соды, массовая доля примесей в которой составляет 5%? |
| Решение | Запишем уравнение реакции получения силиката натрия путем сплавления соды и оксида кремния (IV): |
Определим теоретическую массу соды (рассчитывается по уравнению реакции):
M(Na2CO3) = 2×Ar(Na) + Ar(C) + 3×Ar(O) = 2×23 + 12 + 3×16 = 106 г/моль.
Найдем практическую массу соды:
Рассчитаем теоретическую массу силиката натрия:
M(Na2SiO3) = 2×Ar(Na) + Ar(Si) + 3×Ar(O) = 2×23 + 28 + 3×16 = 122 г/моль.
Пусть практическая масса силиката натрия равна х г. Составим пропорцию:
Отсюда х будет равен:
х = 122 × 61 / 106 = 70,2 г.
Значит масса выделившегося силиката натрия равна 70,2 г.
Источник: ru.solverbook.com
Элементы IVА группы. Кремний
В чайном сервизе твоей бабушки обязательно найдется кремний, так как диоксид кремния входит в состав стекла. Ну а загорать на пляже без песочка (SiO2) ну просто невозможно (песок встречается на каждом шагу).
Кремний
Кремний встречается во многих веществах и предметах, которые нас окружают. Достаточно вспомнить только солнечные батареи, которые служат альтернативным источником энергии!
Так что же из себя представляет кремний? Он, как и углерод, находится в IVA-группе и имеет конфигурацию внешнего электронного слоя 3s 2 3p 2 .
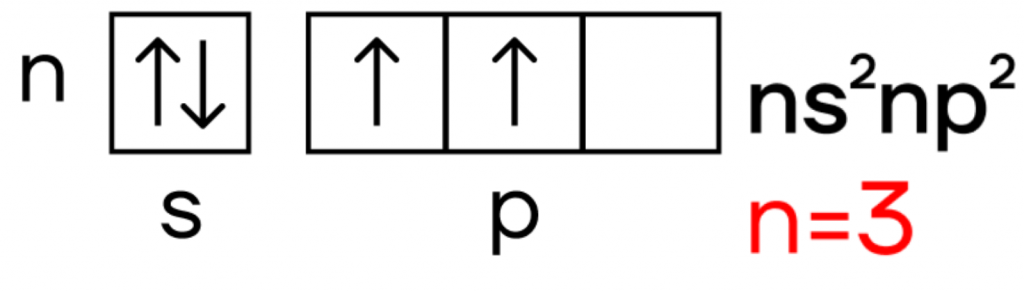
В возбужденном состоянии электроны на s-орбитали распариваются, и один из них переселяется на p-орбиталь. В результате, атом приобретает конфигурацию ns 1 np 3 .
В возбужденном состоянии число неспаренных атомов кремния возрастает до четырех, и кремний приобретает валентность IV:
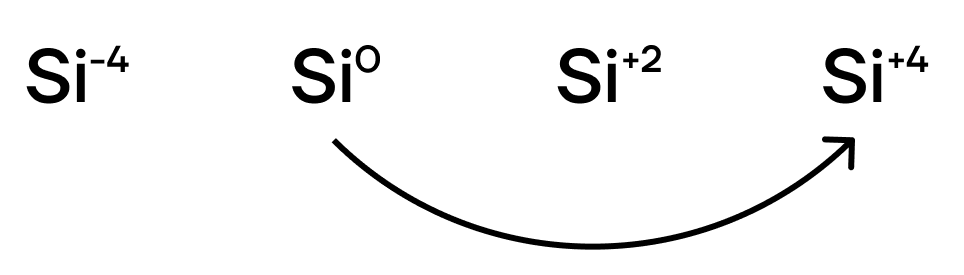
У кремния возможны следующие степени окисления: -4, +2, +4.
Физические свойства
| Кремний — второй по распространенности элемент на Земле (после кислорода). Кремний встречается только в виде сложных веществ, таких как горный хрусталь, кварц, кремнезем. |

Кристаллическая решётка простого вещества кремния — атомная, сам кремний представляет собой вещество темно-серого цвета с металлическим блеском. Является полупроводником.
Химические свойства кремния
У кремния относительно низкая электроотрицательность. А что это значит? Это значит, что он будет яро проявлять восстановительные свойства, даже ещё более выраженные чем у углерода! Поэтому из неметаллов будет вступать в реакции с типичными окислителями, повышая свою степень окисления до +4:
- Реакция со щелочами
В отличие от других неметаллов, реагирующих со щелочами, кремний является в этих реакциях только восстановителем, повышая степень окисления до +4:
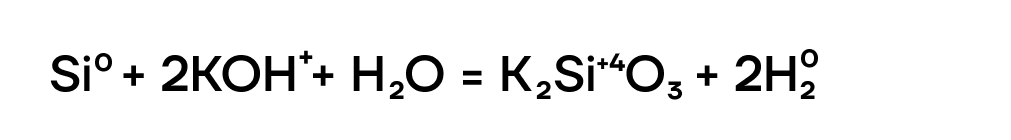
- А с окислителями реакция идет?
Конечно! Но не со всеми. Отобрать электроны «слабенький» кремний способен только у самых слабых — у металлов. Как и углерод, кремний реагирует в основном с металлами активными и средней активности, образуя силициды:
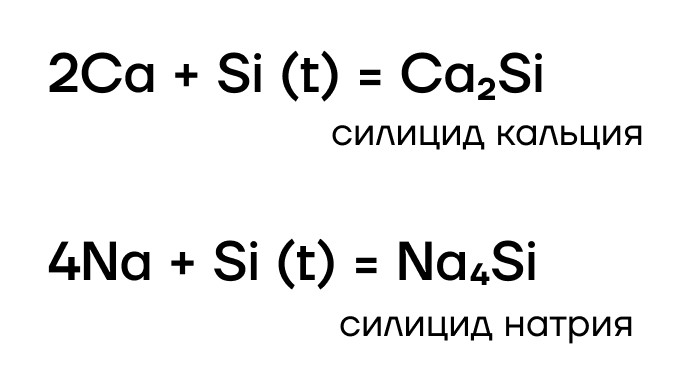
Как и многие другие бинарные соединения, силициды металлов могут гидролизоваться:
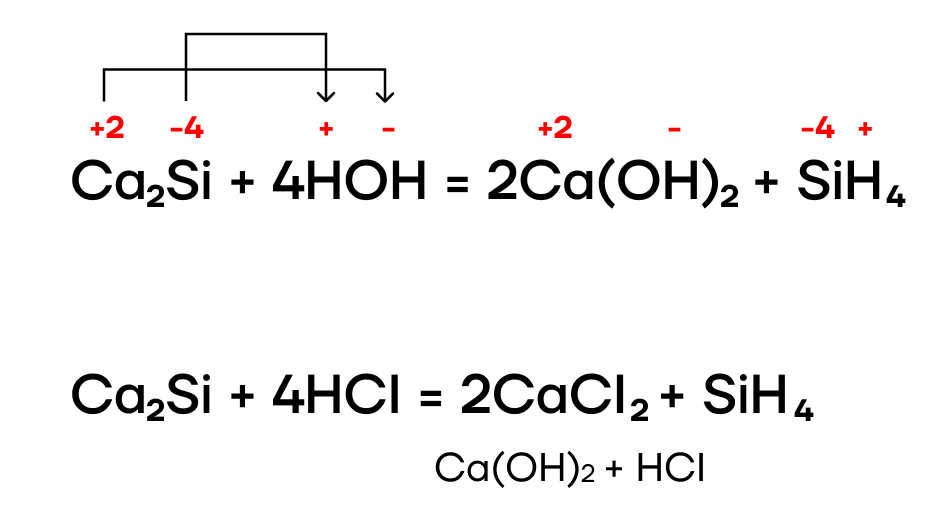
Образующийся бесцветный газ с неприятным запахом — силан — за счёт степени окисления кремния -4 проявляет восстановительные свойства и способен реагировать с окислителями (например, с кислородом):
(оксид кремния(IV) входит в состав песка, который мы видим на улице)
Получение кремния
Кремний в основном получают восстановлением из диоксида кремния SiO2 сильными восстановителями: углеродом, металлами:
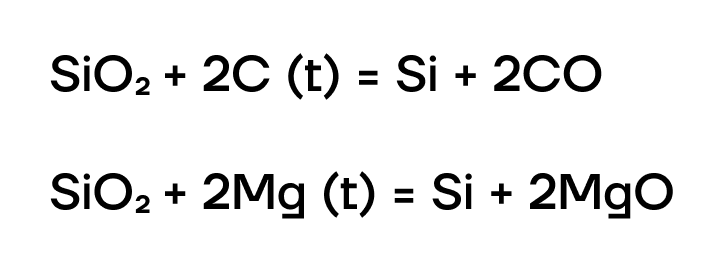
Оксид кремния (IV) — кремнезём SiO2
Диоксид кремния — кислотный оксид, главный компонент почти всех земных горных пород. Из кремнезема и силикатов состоит почти 90 % массы литосферы.
Почему же диоксид кремния такой исключительный? Да все потому, что это — единственный кислотный оксид, который не реагирует с водой! Как следствие, ему соответствует нерастворимая кремниевая кислота H2SiO3.
Как кислотный оксид, SiO2 проявляет кислотные свойства, а значит, способен взаимодействовать с веществами, проявляющими основные свойства, с образованием солей — силикатов:
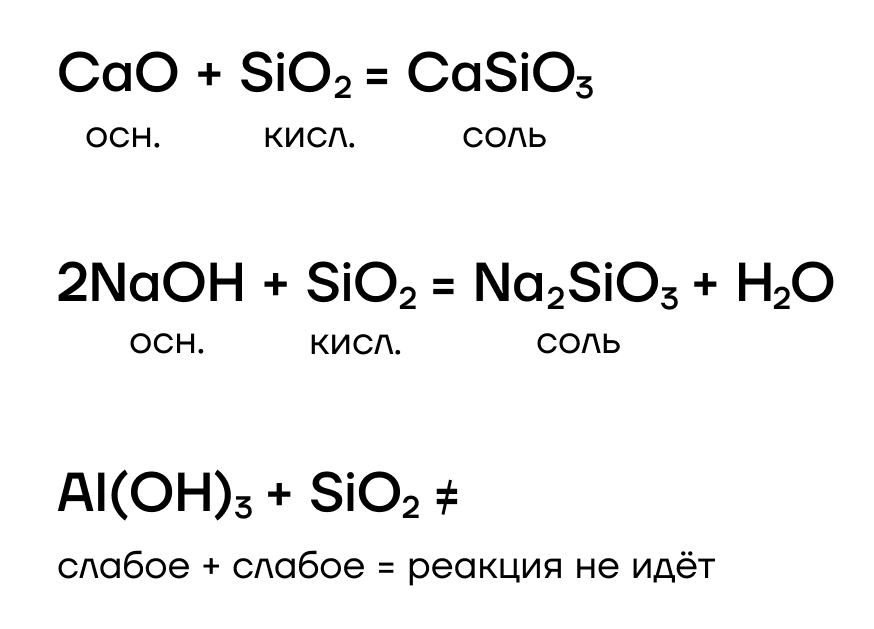
- А в реакции вытеснения вступает?
Да! SiO2 в реакциях вытеснения — условно «сильный» оксид, способный вытеснять условно «слабые» (CO2, SO2) из их солей при сплавлении (t):
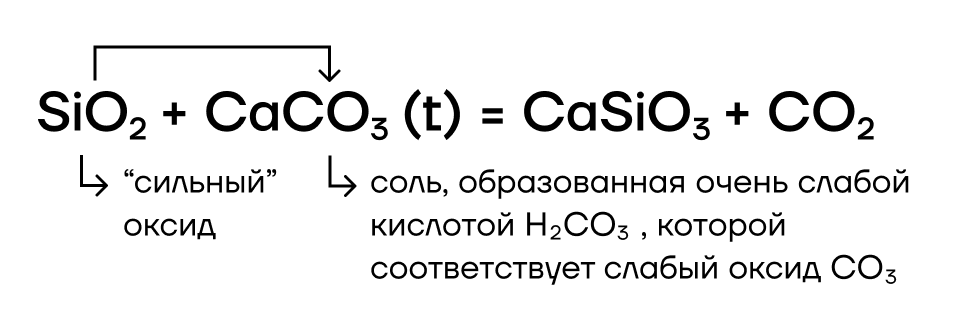
За счёт высокой степени окисления кремния +4 SiO2 проявляет слабо выраженные окислительные свойства и может вступать в ОВР, как правило, только с очень сильными восстановителями (например, углеродом или металлами):
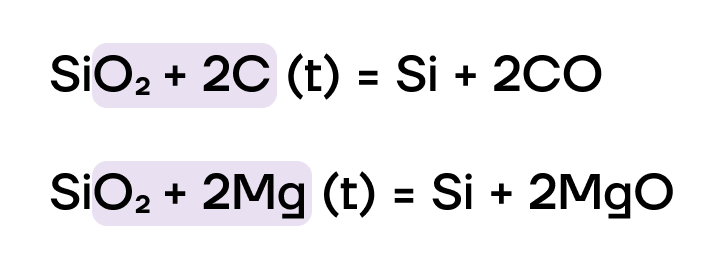
Единственная и неповторимая — кремниевая кислота и силикаты

Кремниевая кислота, хоть и нерастворима, но всё-таки проявляет кислотные свойства, взаимодействуя с сильными основаниями (щелочами):
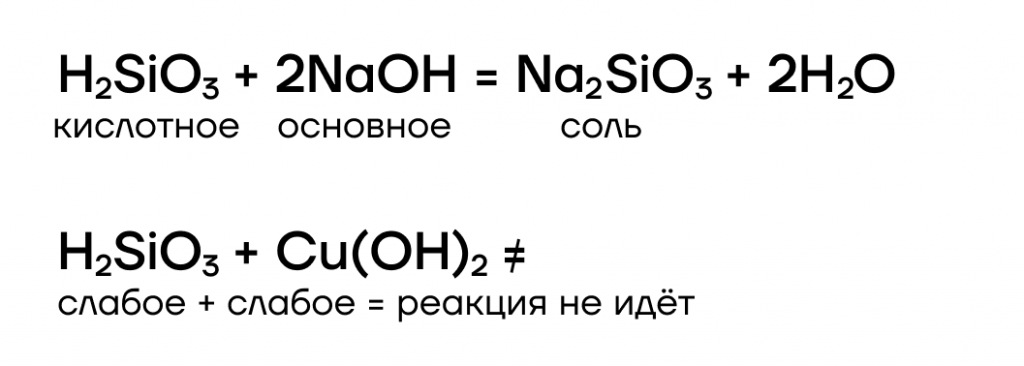
| А ещё силикаты различных металлов образуют красивые нитевидные кристаллы, которые используются в эксперименте « силикатный сад»! |
Её соли — силикаты, как и другие соли, являются электролитами, а значит, способны вступать в РИО с другими электролитами: солями, основаниями, кислотами:
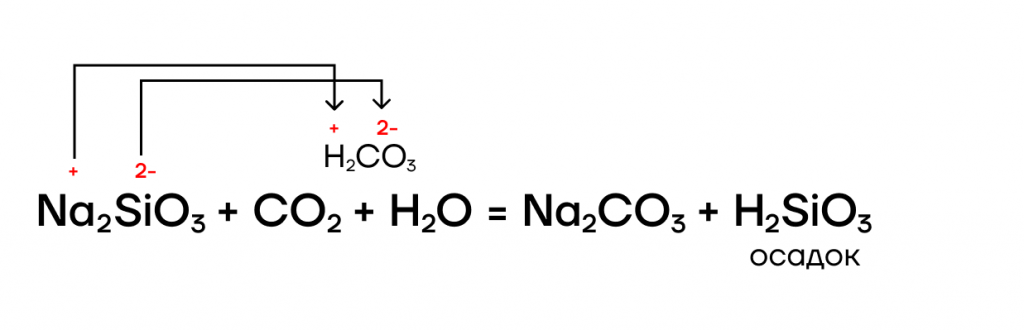
Как нерастворимый гидроксид, кремниевая кислота способна разлагаться при нагревании на воду и соответствующий оксид:
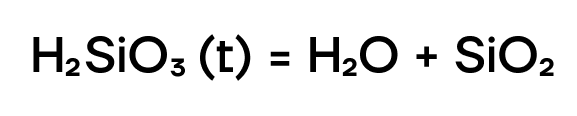
Фактчек
- Кремний — химический элемент IVA группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 14.
- Возможные степени окисления кремния: -4, +2, +4.
- Электронная конфигурация атома кремния: 1s22s 2 2p 6 3s 1 3p 3 .
- Кремний за счёт низкой электроотрицательности ярко проявляет восстановительные свойства.
- Кремний образует множество соединений, в том числе оксид кремния SiO2 — кислотный оксид, который соответствует кремниевой кислоте H2SiO3. Соли кремниевой кислоты называются силикатами.
Проверь себя
Задание 1.
Сколько неспаренных электронов содержит атом кремния в возбужденном электронном состоянии?
- 1 электрон;
- 2 электрона;
- 3 электрона;
- 4 электрона.
Задание 2.
С каким из следующих простых веществ не реагирует кремний?
Задание 3.
С каким из перечисленных веществ будет реагировать диоксид кремния?
- Карбонат натрия;
- Сульфат калия;
- Хлорид рубидия;
- Ортофосфат кальция.
Задание 4.
Какое свойство отличает кремниевую кислоту от других кислот?
- Она содержит атомы кислорода;
- При комнатной температуре кремниевая кислота — жидкость;
- Она нерастворима в воде;
- Она проявляет амфотерные свойства.
Задание 5.
Как называются бинарные соединения кремния и металлов?
- Силаны;
- Силициды;
- Силикаты;
- Силоксаны.
Ответы: 1. — 4; 2. — 3; 3. — 1; 4. — 3; 5. — 2.
Источник: umschool.net
Кремний

В состав песка, глины, горных пород входит простой неметалл – кремний. Это хрупкое кристаллическое вещество, вступающее в реакции с металлами и неметаллами и использующееся для изготовления стекла.
Электронное строение
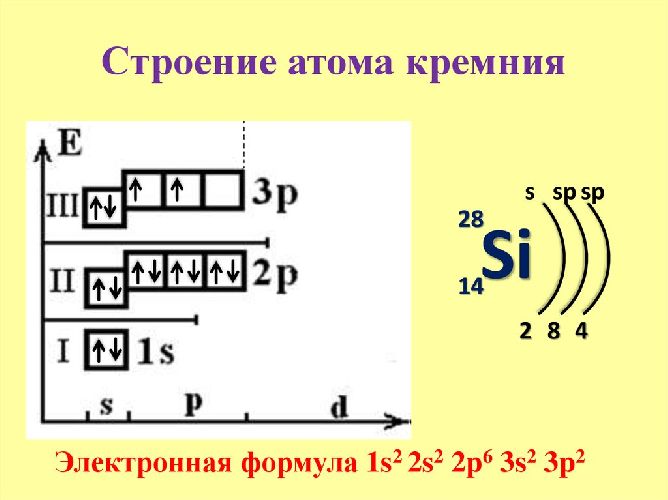
Кремний (Si) – занимает 14 клетку в таблице Менделеева. Элемент располагается в IV группе, третьем периоде. Следовательно, вокруг положительно ядра с 14 протонами движется 14 отрицательно заряженных электронов на трёх энергетических уровнях.
Кремний относится к элементам p-семейства. Электронная формула кремния – 1s 2 2s 2 2p 6 3s 2 3p 2 . На внешнем энергетическом уровне располагается четыре электрона – пара электронов на 3s-уровне и два неспаренных электрона на 3p-уровне.
Благодаря распределению электронов атом проявляет степень окисления +2. За счёт свободной 3d-орбитали атом может переходить в возбуждённое состояние. Один электрон с s-уровня переходит на d-орбиталь. В этом случае атом проявляет степень +4. Однако в реакциях с металлами кремний является окислителем и проявляет степень окисления -4.
Простое вещество в чистом виде встречается редко за счёт активности элемента. Распространён в составе песка – диоксида кремния (SiO2). В зависимости от примесей (железо, марганец, медь) образует кварц, агат, аметист, кремень и другие горные породы.

Физическое описание
Кремний – хрупкий химический элемент тёмного серого цвета. Обладает металлическим блеском за счёт кубической гранецентрированной кристаллической решётки, напоминающей строением алмаз. Однако кремний в отличие от алмаза – менее прочное вещество из-за большей длины связи между атомами.
Основные физические свойства кремния:
- полупроводник;
- температура плавления – 1414°C;
- температура кипения – 3265°C;
- плотность при нормальных условиях – 2,33 г/см 3 ;
- твёрдость по шкале Мооса – 7.
Кремний выделяют из песка путём прокаливания с углём или металлами. Например, с алюминием: 3SiO2 + 4Al → 3Si + 2Al2O3.
Химические свойства
Благодаря схеме строения атома кремний обладает свойствами окислителя и восстановителя. Взаимодействуя с металлами, кремний принимает электроны, т.е. является окислителем. В реакциях с неметаллами кремний отдаёт электроны и является восстановителем.
Основные химические свойства описаны в таблице.
Реакция
Описание
Уравнение
Реагирует при нагревании
Только с фтором реагирует без нагревания. Остальные реакции протекают при повышенных температурах
При обычных условиях реагирует только с плавиковой кислотой. С остальными веществами – при нагревании
Реагирует только со смесью азотной и плавиковой кислот
Образуются силикат и водород
Применение
Кремний в составе песка используется для изготовления стекла и цемента. Изготовлением материалов из кремния занимается силикатная промышленность, выпускающая:
- кирпич;
- кафельную плитку;
- фаянс;
- фарфор;
- силикатный клей.
В чистом виде кремний используется для производства:
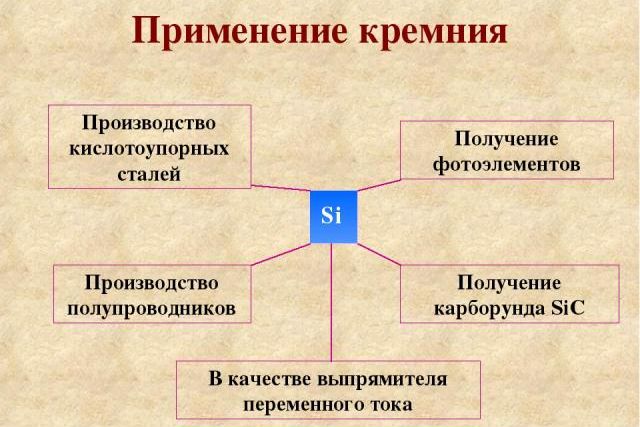
- электронных приборов;
- микросхем;
- солнечных батарей;
- зеркал.
Что мы узнали?
Из урока 9 класса узнали, что кремний – неметалл, проявляющий в реакции свойства окислителя или восстановителя. Это твёрдый хрупкий неметалл, сходный по кристаллическому строению с алмазом. В чистом виде практически не встречается в природе. Взаимодействуя с кислородом, образует песок, являющийся основой всех горных пород.
При нормальных условиях реагирует только с фтором, остальные реакции требуют нагревания. Кремний реагирует с металлами, неметаллами, щелочами. Из элемента изготавливают строительные материалы, микросхемы, стекло.
Источник: obrazovaka.ru