Свойства. Конфигурация внешней электронной оболочки атома кремния 3s 2 3р 2 . В соединениях проявляет степень окисления +4, редко +1, +2, +3, -4; электроотрицательность по Полингу 1,90, потенциалы ионизации Si 0 → Si + →Si 2+ → Si 3+ →Si 4+ соответственно равны 8,15, 16,34, 33,46 и 45,13 эВ; атомный радиус 110 пм, радиус иона Si 4+ 40 пм (координационное число 4), 54 пм (координационное число 6).
Кремний — тёмно-серое твёрдое хрупкое кристаллическое вещество с металлическим блеском. Кристаллическая решётка кубическая гранецентрированная; tпл 1414 °С, tкип 2900 °С, плотность 2330 кг/м 3 (при 25 °С).
Теплоёмкость 20,1 Дж/(моль∙К), теплопроводность 95,5 Вт/(м∙К), диэлектрическая проницаемость 12; твёрдость по Моосу 7. При обычных условиях кремний — хрупкий материал; заметная пластическая деформация наблюдается при температурах выше 800 °С. Кремний прозрачен для ИК-излучения с длиной волны больше 1 мкм (коэффициент преломления 3,45 при длине волны 2-10 мкм). Диамагнитен (магнитная восприимчивость — 3,9∙10 -6 ). Кремний — полупроводник, ширина запрещённой зоны 1,21 эВ (0 К); удельное электрическое сопротивление 2,3∙10 3 Ом∙м (при 25 °С), подвижность электронов 0,135-0,145, дырок — 0,048-0,050 м 2 /(В с). Электрические свойства кремния очень сильно зависят от наличия примесей. Для получения монокристаллов кремния с проводимостью р-типа используют легирующие добавки В, Al, Ga, In (акцепторные примеси), с проводимостью n-типа — Р, As, Sb, Bi (донорные примеси).
Откуда взялись химические элементы?
Кремний на воздухе покрывается оксидной плёнкой, поэтому при низких температурах химически инертен; при нагревании выше 400 °С взаимодействует с кислородом (образуются оксид SiO и диоксид SiO2), галогенами (кремния галогениды), азотом (кремния нитрид Si3N4), углеродом (кремния карбид SiC) и др. Соединения кремния с водородом — силаны — получают косвенным путём. Кремний взаимодействует с металлами с образованием силицидов.
Мелкодисперсный кремний — восстановитель: при нагревании взаимодействует с парами воды с выделением водорода, восстанавливает оксиды металлов до свободных металлов. Кислоты-неокислители пассивируют кремний вследствие образования на его поверхности нерастворимой в кислотах оксидной плёнки. Кремний растворяется в смеси концентрированной HNO3 с HF, при этом образуется кремнефтороводородная кислота: 3Si + 4HNO3 + 18HF = 3Н2[SiF6] + 4NO + 8Н2О. Кремний (особенно мелкодисперсный) взаимодействует со щелочами с выделением водорода, например: Si + 2NaOH + Н2О = Na2SiO3 + 2Н2. Кремний образует различные кремнийорганические соединения.
Биологическая роль. Кремний относится к микроэлементам. Суточная потребность человека в кремнии 20-50 мг (элемент необходим для правильного роста костей и соединительных тканей). В организм человека кремний попадает с пищей, а также с вдыхаемым воздухом в виде пылеобразного SiO2. При длительном вдыхании пыли, содержащей свободный SiO2, возникает силикоз.
Получение. Кремний технической чистоты (95-98%) получают восстановлением SiO2 углеродом или металлами. Высокочистый поликристаллический кремний получают восстановлением SiCl4 или SiHCl3 водородом при температуре 1000-1100 °С, термическим разложением Sil4 или SiH4; монокристаллический кремний высокой чистоты — зонной плавкой или по методу Чохральского. Объём мирового производства кремния около 1600 тысяч т/год (2003).
Что такое химический элемент
Применение. Кремний — основной материал микроэлектроники и полупроводниковых приборов; используется при изготовлении стёкол, прозрачных для ИК-излучения. Кремний является компонентом сплавов железа и цветных металлов (в малых концентрациях кремний повышает коррозионную стойкость и механическую прочность сплавов, улучшает их литейные свойства; в больших концентрациях может вызвать хрупкость); наибольшее значение имеют железные, медные и алюминиевые кремнийсодержащие сплавы. Кремний применяют в качестве исходного вещества для получения кремнийорганических соединений и силицидов.
Лит.: Баранский П. И., Клочков В. П., Потыкевич И. В. Полупроводниковая электроника. Свойства материалов: Справочник. К., 1975; Дроздов А. А., Зломанов В. П., Мазо Г. Н., Спиридонов Ф. М. Неорганическая химия. М., 2004. Т. 2; Шрайвер Д., Эткинс П. Неорганическая химия. М., 2004. Т. 1-2; Кремний и его сплавы.
Екатеринбург, 2005.
Источник: knowledge.su
Как называется в химии элемент Si?

Для ученика средней школы должно быть ясно и понятно что это элемент кремний. Конечно можно посмотреть и таблице Менделеева. Необходимо заметить, что это один из самых распространенных на земле элементов, так как он входит в состав песка.
комментировать
в избранное ссылка отблагодарить
Galin sanna [5.2K]
8 лет назад
Химический элемент Si — silicium (читается силициум) или кремний — неметалл, по химическим свойствам близок к углероду. Составляет 27,6-29,5% массы земной коры. в природе чаще всего встречается в виде диоксида кремня SiO2 (песок, кварц, кремень, полевые шпаты). Чуть менее распространены силикаты и алюмосиликаты.
Источник: www.bolshoyvopros.ru
Кремний общая характеристика химического элемента

Кремний – химический элемент таблицы Менделеева. Попробуем разобраться, что же такое кремний – металл или неметалл?
Какова его природа, общая характеристика и свойства не только в физике, но и в химии? Как реагирует с другими веществами? Какие соединения образуют? Каковы области применения этого элемента?
Общая характеристика
Обозначение этого элемента в таблице Менделеева – Si (silicium – «силициум»). В таблице он стоит в четвертой группе третьего периода. Является неметаллом.

Первое название этого элемента силиций. В середине 19 века его стали называть «кремнием».
Основные особенности:
- Второй по распространенности элемент таблицы Менделеева.
- Аналог углерода – это элемент (а также его генетический ряд) со своими специфическими особенностями.
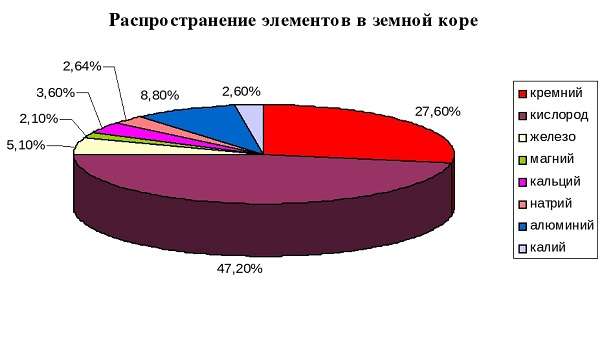
Где можно взять кремний? В основном, в природе он находится в земле в виде оксидов и других структур горных пород (кварц, силикат и т. д.).
Состав и структура кремния
Рассмотрим основные параметры этого элемента в таблице.
| Признак | Характеристика |
| Атомная масса | 28,086 а. е. м. |
| Молекулярная (молярная) масса | 28,086 г/моль |
| Размер атома / заряд ядра | 14 |
| Валентность | 2,4 |
| Степень окисления | ±4, -2 |
| Плотность | 2,33 г/см3 |
| Температура плавления | 1688 К |
| Химическая связь | ковалентная неполярная |
| Кристаллическая решетка | атомная |
У кремния есть 3 изотопа: Si (28), Si (29), Si (30).
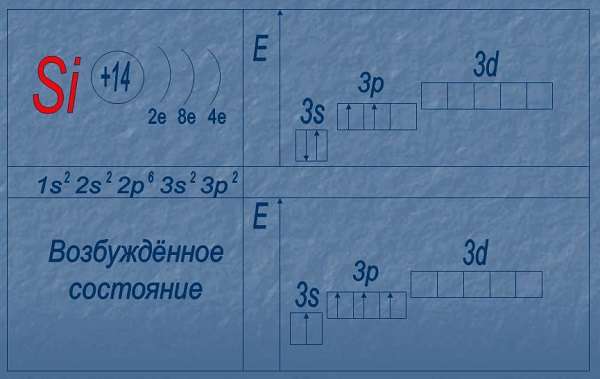
Электронное строение атома кремния показано на картинке:
Физические свойства
Строение атома кремния, из которого состоит большинство материалов, позволяет доказать ученым наличие аллотропии у этого элемента.
Выделяют 2 модификации:
- аморфный,
- кристаллический.

Первый представляет собой порошок коричневого цвета, который плавится при температуре свыше 1400 градусов Цельсия.
Второй – кристаллизованный кремний темно-серого оттенка с блестящей поверхностью.

По сравнению с предыдущим, обладает высокими показателями тепло- и электропроводности.
Химические свойства
Поскольку он находится в четвертой группе главной подгруппе таблицы Менделеева, то может проявлять как окислительные, так и восстановительные свойства.
Рассмотрим по отдельности каждый вид реакций.
Восстановительные процессы

С простыми веществами:
Si + 2Br2 = SiBr4,
Со сложными веществами:
3Si + 12HF + 4HNO3 = 3SiF4 + 4NO + 8H2O.
Si + 2NaOH + H2O = Na2SiO3 + 2H2.
Окислительные процессы
Он проявляет при взаимодействии с гидридами, металлами, солями, сильными концентрированными кислотами.
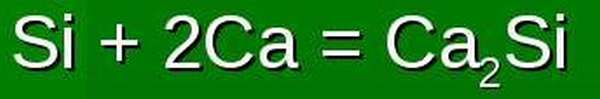
Как правило, в качестве побочных продуктов в таких реакциях выступают окиси неметаллов, сульфаты, нитраты и другие соли, содержащие этот элемент.
Получение кремния
Различают два способа получения кремния: лабораторный и промышленный. Рассмотрим подробно оба.
В лаборатории
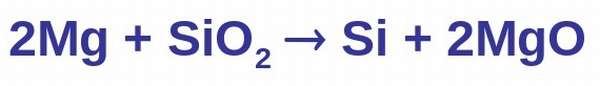
Его восстанавливают с помощью магния или алюминия при нагревании.
В промышленности
Получение этим способом требует больших усилий:
- В печах под действием кокса идет разложение диоксида кремния при температуре свыше 1790 градусов по Цельсию.
- Очищают полученный кремний от примесей. Как правило, получают соль, а затем обрабатывают кислотами.
- Очистку проводят до тех пор, пока массовая доля в образце не будет ниже 95%.
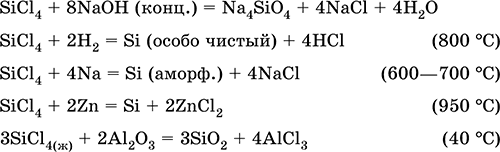
Кроме того, в промышленности в последние годы популярным способом очистки стало хлорирование. Оно используется чаще, поскольку этот метод экономически выгоден и дает большую степень очистки.
В России существует всего два завода по производству технического кремния: Каменск-Уральский и Усолье-Сибирский.
Области применения

Кремний имеет широкую область применения:
- Он является хорошим сырьем для получения его аллотропных модификаций и различных соединений на его основе.
- Это главный компонент при получении различных сплавов. EuroEscortBabes Как правило, в металлургии это главный окислитель и модифицирующий элемент.
- Кремний часто используется для получения стекла и цемента.
- Он является незаменимым компонентом в производстве батарей.
- Кремний чаще всего используется как подручное средство для получения других простых веществ в лаборатории.
Плюсы и минусы кремния
Попробуем разобраться, в чем же заключаются преимущества и недостатки этого элемента? Как он вообще влияет на жизнь различных организмов?

Кремний необходим растениям для питания и роста, некоторым простейшим организмам для правильного протекания процессов жизнедеятельности.
В организмах высших существ он играет важную роль (является одним из незаменимых микроэлементов), но помимо этого может вредить им (вызывать силикоз – отравление солями этого неметалла).
Незаменима его роль в промышленности и технике, металлургии. А вот медицинские показатели еще до конца не изучены, поэтому применять его для лечения различных заболеваний можно с осторожностью и только по рекомендациям врача.
Заключение
Кремний незаменим в химии и физике. Он играет важнейшую роль в биохимических реакциях организма человека. Правда избыток этого элемента может привести к хроническим болезням.
Источник: tvercult.ru