Электронная оболочка атома – это совокупность всех электронов в данном атоме.
Химические свойства элементов определяются строением электронных оболочек их атомов.
В 20-х годах ХХ в. ученые установили, что электрон имеет двойственную природу: он является одновременно частицей и волной (имеет свойства частицы и свойства волны).
Представление о двойственной природе электрона привело к созданию квантово-механической теории строения атома.
Согласно этой теории, электрон (как и другие микрочастицы) не имеет определенной траектории движения. Можно говорить только о вероятности нахождения электрона в разных частях атомного пространства.
Часть атомного пространства, в которой вероятность нахождения данного электрона наибольшая (равна 90%), называется атомной орбиталью.
Каждый электрон в атоме занимает определенную орбиталь и образует электронное облако, которое является совокупностью различных положений быстро движущегося электрона.
Атомная орбиталь и облако электрона, который занимает эту орбиталь, имеют одинаковый размер, одинаковую форму и одинаковое направление в пространстве.
Электронные конфигурации атомов. Химия – просто
Для характеристики орбиталей и электронов используются квантовые числа.
Энергия и размер орбитали и электронного облака характеризуются главным квантовым числом n.
Главное квантовое число принимает значения целых чисел от 1 до ∞(бесконечности): n = 1, 2, 3, 4, 5, 6, 7…∞
Орбитали, которые имеют одинаковое значение n, близки между собой по энергии и по размеру.
Совокупность орбиталей, которые имеют одинаковое значение главного квантового числа, — это энергетический уровень.

Энергетические уровни обозначаются большими буквами латинского алфавита.
Совокупность электронов, которые находятся на одном энергетическом уровне, — это электронный слой.
На одном энергетическом уровне могут находиться орбитали (электронные облака), которые имеют различные геометрические формы.
Форма орбиталей и облаков характеризуется побочным (орбитальным) квантовым числом l.

Для орбиталей данного энергетического уровня побочное (орбитальное) квантовое число принимает значения целых чисел от 0 до n-1.

Орбитали, для которых l = 0, имеют форму шара (сферы) и называются s-opбиталями (условно изображаются в виде окружности):
s –орбитали имеются на всех энергетических уровнях.
На K-уровне (на первом энергетическом уровне) имеется только s-орбиталь.

Орбитали, для которых l=1, имеют форму гантели и называются р-орбиталями:
р-Орбитали имеются на всех энергетических уровнях, кроме первого (K) уровня.
Орбитали с большими значениями l имеют более сложную форму и обозначаются так:
l = 2: d-орбитали;
l = 3: f-орбитали.
d-Орбитали есть на всех энергетических уровнях, кроме первого (K) и второго (L) уровней.
f-Oрбитали есть на всех энергетических уровнях, кроме первого (K), второго (L) и третьего (М) уровней.
Энергия орбиталей (Е), которые находятся на одном энергетическом уровне, но имеют различную форму, неодинакова:
Поэтому энергетические уровни состоят из энергетических подуровней.
Энергетический подуровень — это совокупность орбиталей, которые находятся на одном энергетическом уровне и имеют одинаковую форму.
Значит, орбитали одного подуровня имеют одинаковые значения главного квантового числа (n) и одинаковые значения побочного квантового числа (l).
Энергетический подуровень обозначается так: главное квантовое число записывают арабской цифрой, побочное квантовое число записывают соответствующей латинской буквой (s, р, d,f т. д.). Например: 1s — s-подуровень первого энергетического уровня (n = 1, l = 0); 4d — d-подуровень четвертого энергетического уровня (n = 4, l= 2).
Число значений l для каждого уровня равно главному квантовому числу. Поэтому число подуровней на уровне тоже равно главному квантовому числу.
Сколько орбиталей на различных подуровнях и чем отличаются орбитали одного подуровня?
Орбитали одного подуровня отличаются направлением (ориентацией) в пространстве.
Магнитное квантовое число m1, характеризует направление орбиталей (электронных облаков) в пространстве,
Магнитное квантовое число принимает значения целых чисел от —l через 0 до +l.

Число значений m1 определяет число орбиталей на подуровне; например:
Число орбиталей на подуровне равно: 2l + 1.

Графически любая орбиталь изображается в виде клетки (квантовой ячейки): □

Общее число орбиталей на энергетическом уровне
Nорб.= n 2 .
Итак, каждая орбиталь и электрон, который находится на этой орбитали, характеризуются тремя квантовыми числами: главным n, побочным l и магнитным m1.
Электрон характеризуется еще одним — спиновым квантовым числом (от англ. to spin — кружить, вращать).
Спиновое квантовое число (спин электрона) ms, характеризует вращение электрона вокруг своей оси и принимает только два значения: +1/2 и – 1/2.

Схематично это можно показать так:
Электрон со спином +1/2 — условно изображают так: ↑; со спином —1/2: ↓
Принцип Паули гласит:
В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел.
Поэтому на одной орбитали не может быть больше двух электронов; эти два электрона имеют одинаковый набор трех квантовых чисел (n, l, m1) и должны отличаться спинами (спиновым квантовым числом ms:


Два электрона, которые находятся на одной орбитали, называются спаренными (или неподеленной электронной парой). Спаренные электроны являются электронами с противоположными (антипараллельными) спинами.
Общее число электронов на энергетическом уровне Nэл. = 2n 2 .
Источник: al-himik.ru
Сколько электронных слоев в атоме серебра
Относится к элементам d-семейства. Металл. Обозначение – Ag. Порядковый номер – 47. Относительная атомная масса – 107,868 а.е.м.
Электронное строение атома серебра
Атом серебра состоит из положительно заряженного ядра (+47), внутри которого есть 47 протонов и 61 нейтрон, а вокруг, по пяти орбитам движутся 427 электронов.
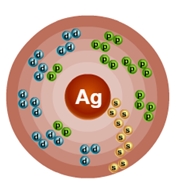
Рис.1. Схематическое строение атома серебра.
Распределение электронов по орбиталям выглядит следующим образом:
Валентными электронами атома серебра считаются электроны, расположенные на 4d— и 5s-орбиталях. Энергетическая диаграмма основного состояния принимает следующий вид:
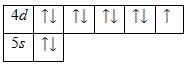
Валентные электроны атома серебра можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
Примеры решения задач
| Задание | Сколько атомных орбиталей d-подуровня заполнено у элемента с порядковым номером 23? Запишите его электронную формулу. |
| Решение | На d-подуровне имеется пять орбиталей, на каждой из которых может одновременно находиться 2 электрона (в сумме 10). Элемент с порядковым номером 23 — это ванадий (V). Запишем электронную конфигурацию его атома в основном состоянии: |
1s 2 2s 2 2p 6 3s 2 3p 6 3 d 3 4 s 2 .
В атоме ванадия заполнены 3 орбитали 3d-подуровня.
| Задание | Почему марганец проявляет металлические свойства, а хлор – неметаллические? Ответ мотивируйте строением атомов этих элементов. Запишите их электронные формулы. |
| Ответ | Запишем электронные конфигурации атомов хлора и марганца в основном состоянии: |
Атому хлора до завершения внешнего энергетического уровня не хватает всего 1-го электрона, поэтому он обладает сильно выраженными неметаллическими свойствами. Марганцу для этих же целей потребуется гораздо больше электронов, поэтому, ему проще отдать свои валентные электроны при химическом взаимодействии, чем принять их – явный признак металлических свойств.
Электронная конфигурация атома серебра (Ag)
Ag (серебро) — элемент с прядковым номером 47 в периодической системе. Находится в V периоде. Температура плавления: 961.9 ℃. Плотность: 10.49 г/см 3 .
Порядок заполнения орбиталей электронами в атоме Ag является исключением из правила Клечковского.
Ожидаемая электронная формула
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 9
Но в реальности происходит проскок одного электрона с орбитали 5s внешнего слоя на орбиталь 4d пред-внешнего слоя:
Электронная формула атома серебра в порядке возрастания энергий орбиталей:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 10
Электронная формула атома серебра в порядке следования уровней:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 1
Сокращенная электронная конфигурация Ag:
[Kr] 4d 10 5s 1
Ниже приведена электронно-графическая схема атома серебра


Валентные электроны серебра
Количество валентных электронов в атоме серебра — 11.
Ниже приведены их квантовые числа (N — главное, L — орбитальное, M — магнитное, S — спин)
| s | 5 | +1/2 | ||
| d | 4 | 2 | -2 | +1/2 |
| d | 4 | 2 | -1 | +1/2 |
| d | 4 | 2 | +1/2 | |
| d | 4 | 2 | 1 | +1/2 |
| d | 4 | 2 | 2 | +1/2 |
| d | 4 | 2 | -2 | -1/2 |
| d | 4 | 2 | -1 | -1/2 |
| d | 4 | 2 | -1/2 | |
| d | 4 | 2 | 1 | -1/2 |
| d | 4 | 2 | 2 | -1/2 |
Степени окисления, которые может проявлять серебро: +1, +2, +3
Электронные формулы других элементов
2020 Ваш онлайн — калькуляторы, таблицы и формулы
Серебро, свойства атома, химические и физические свойства
Серебро, свойства атома, химические и физические свойства.










107,8682(2) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 1
Серебро — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 47. Расположен в 11-й группе (по старой классификации — побочной подгруппе первой группы), пятом периоде периодической системы.
Физические свойства серебра
Атом и молекула серебра. Формула серебра. Строение атома серебра:
Серебро (лат. Argentum) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Ag и атомным номером 47. Расположен в 11-й группе (по старой классификации – побочной подгруппе первой группы), пятом периоде периодической системы.
Серебро – металл. Относится к группе переходных металлов, а также к драгоценным металлам и металлам платиновой группы.
Как простое вещество серебро при нормальных условиях представляет собой ковкий, пластичный металл серебристо-белого цвета.
Молекула серебра одноатомна.
Химическая формула серебра Ag.
Электронная конфигурация атома серебра 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 1 . Потенциал ионизации (первый электрон) атома серебра равен 731 кДж/моль (7,576234(25) эВ).
Строение атома серебра. Атом серебра состоит из положительно заряженного ядра (+47), вокруг которого по пяти оболочкам движутся 47 электронов. При этом 46 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку серебро расположен в пятом периоде, оболочек всего пять. Первая – внутренняя оболочка представлена s-орбиталью.
Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья и четвертая – внутренние оболочки представлены s-, р- и d-орбиталями. Пятая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома серебра на s-орбитали находится один неспаренный электрон. В свою очередь ядро атома серебра состоит из 47 протонов и 61 нейтрона.
Серебро относится к элементам d-семейства.
Радиус атома серебра (вычисленный) составляет 165 пм.
Атомная масса атома серебра составляет 107,8682(2) а. е. м.
Серебро, будучи благородным металлом, отличается относительно низкой реакционной способностью.
Изотопы и модификации серебра:
Свойства серебра (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Серебро |
| 102 | Прежнее название | |
| 103 | Латинское название | Argentum |
| 104 | Английское название | Silver |
| 105 | Символ | Ag |
| 106 | Атомный номер (номер в таблице) | 47 |
| 107 | Тип | Металл |
| 108 | Группа | Драгоценный, переходный металл, металл платиновой группы |
| 109 | Открыт | Известно с древних времен |
| 110 | Год открытия | до 5000 года до н. э. |
| 111 | Внешний вид и пр. | Ковкий, пластичный металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 7,9·10 -6 % |
| 120 | Содержание в морях и океанах (по массе) | 1,0·10 -8 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 6,0·10 -8 % |
| 122 | Содержание в Солнце (по массе) | 1,0·10 -7 % |
| 123 | Содержание в метеоритах (по массе) | 0,000014 % |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 107,8682(2) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 1 |
| 203 | Электронная оболочка | K2 L8 M18 N18 O1 P0 Q0 R0 |
205* Эмпирический радиус атома серебра согласно [1] и [3] составляет 144 пм.
206* Ковалентный радиус серебра согласно [1] и [3] составляет 145±5 пм и 134 пм соответственно.
401* Плотность серебра согласно [3] и [4] составляет 10,5 г/см 3 (при 0 °C/20 °C и иных стандартных условиях , состояние вещества – твердое тело).
402* Температура плавления серебра согласно [3] и [4] составляет 961,95 °С (1235,1 K, 1763,51 °F) и 960,5 °С (1233,65 K, 1760,9 °F) соответственно.
403* Температура кипения серебра согласно [3] и [4] составляет 2211,85 °C (2485 K, 4013,33 °F) и 2167 °С (2440,15 K, 3932,6 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) серебра согласно [3] и [4] составляет 11,95 кДж/моль и 11,3 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) серебра согласно [3] и [4] составляет 254,1 кДж/моль и 251,5 кДж/моль соответственно.
410* Молярная теплоёмкость серебра согласно [3] составляет 25,36 Дж/(K·моль).
Источник: ollimpia.ru
ОГЭ по химии. Строение атома (часть 1)
Буквально через несколько месяцев завершится учебный год, а те, кто заканчивает 9 класс, будут сдавать ОГЭ по химии . Эта серия статей посвящена разбору типовых задач, подобные которым наверняка встретятся на экзамене по химии. Обратите внимание, что это не задачи ОГЭ, это задачи, которые проверяют знания, но на экзамене точно будут похожие.
Фото: dialog-test.ru
Итак, начнём с первой темы « Строение атома ».
Разговаривая о строении атома, нужно всегда опираться на таблицу Менделеева. Эта огромная подсказка есть в каждом классе, не забывайте ею пользоваться. Напомню главное:
— Порядковый номер элемента показывает заряд ядра атома . Число электронов равно заряду ядра атома и, следовательно, порядковому номеру элемента в таблице Менделеева . Например, порядковый номер фтора F равен 9. Это означает, что заряд ядра фтора равен 9 и что в атоме имеется 8 электронов.
— Номер периода (строки в периодической таблице) показывает число электронных слоёв в атоме , на которых находятся электроны. Например, алюминий находится в третьем периоде, следовательно, у него три электронных слоя.
— Номер группы (столбца) показывает, сколько электронов находится на внешнем слое . Например, кислород стоит в шестой группе, поэтому на внешнем слое у него 6 электронов.
Задание 1.
Сколько электронов содержит атом фосфора?
Объяснение: порядковый номер фосфора – 15. Это значит, что у атома фосфора имеется 15 электронов.
Задание 2.
Атомы кислорода и серы имеют:
1. одинаковый заряд ядра
2. одинаковое общее число электронов
3. одинаковое число электронов на внешнем слое
4. одинаковый размер ядра
Объяснение: атомы разных элементов разные, так что они не могут иметь ни одинакового заряда, ни одинакового размера, ни одинакового числа электронов. Зато в таблице Менделеева можно увидеть, что сера и кислород стоят в шестой группе , а это означает, что на внешнем электронном слое у них одинаковое число электронов (6).
Задание 3.
В атоме электроны распределены по слоям следующим образом: 2; 8; 8. Что это за элемент:
Объяснение: давайте узнаем, сколько всего в атоме электронов, сложив указанные числа: 2+8+8=18. 18 – это общее число электронов в атоме и одновременно заряд ядра. А заряд ядра – это порядковый номер элемента в таблице Менделеева. Посмотрев на неё, видим, что элемент с порядковым номером 18 – аргон.
Задание 4.
Одинаковое число электронов на внешнем электронном слое имеется у:
1. лития Li и натрия Na
2. бора В и кремния Si
3. фосфора Р и серы S
4. фтора F и неона Ne
Объяснение: номер группы в таблице Менделеева говорит нам о том, сколько электронов находится на внешнем электронном слое. То есть одинаковое число электронов на внешнем слое есть у элементов, стоящих в одной группе. Это литий и натрий.
Задание 5.
В атоме кальция распределение электронов по электронным слоям соответствует ряду чисел:
Объяснение: кальций находится в четвёртом периоде , значит, у него заполняется четвёртый электронный слой (вариант 1 сразу отбрасываем). Кальций находится во второй группе, значит, у него на внешнем электронном слое 2 электрона, поэтому отбрасываем вариант 2. Согласно таблице Менделеева в первом периоде максимальное число электронов – 2, поэтому вариант 4 тоже не подходит.
Еще больше разборов заданий здесь .
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник: dzen.ru