(изотоп с атомной массой 40), кислорода (изотоп с атомной массой 16), серебра (изотоп с атомной массой 107).
Ответы 1
14 месяцев назад
Номер элемента определяют по таблице Менделеева, электрон(e)=протон(p)=номер элемента(N).
Нейтрон(n) определяется по формуле: Ar-p
Ar — атомная масса
Как добавить хороший ответ?
Что необходимо делать:
- Написать правильный и достоверный ответ;
- Отвечать подробно и ясно, чтобы ответ принес наибольшую пользу;
- Писать грамотно, поскольку ответы без грамматических, орфографических и пунктуационных ошибок лучше воспринимаются.
Что делать не стоит:
- Списывать или копировать что-либо. Высоко ценятся ваши личные, уникальные ответы;
- Писать не по сути. «Я не знаю». «Думай сам». «Это же так просто» — подобные выражения не приносят пользы;
- Писать ответ ПРОПИСНЫМИ БУКВАМИ;
- Материться. Это невежливо и неэтично по отношению к другим пользователям.
Пример вопроса
Русский язык
7 минут назад
Какой синоним к слову «Мореплаватель»?
Пожаловаться
Хороший ответ
Как определить число протонов, нейтронов и электронов? #химия #сотка #егэ
Вася Иванов
Мореплаватель — имя существительное, употребляется в мужском роде. К нему может быть несколько синонимов.
1. Моряк. Старый моряк смотрел вдаль, думая о предстоящем опасном путешествии;
2. Аргонавт. На аргонавте были старые потертые штаны, а его рубашка пропиталась запахом моря и соли;
3. Мореход. Опытный мореход знал, что на этом месте погибло уже много кораблей, ведь под водой скрывались острые скалы;
4. Морской волк. Старый морской волк был рад, ведь ему предстояло отчалить в долгое плавание.
Источник: uchi.ru
ХЕЛП ХИМИЯ 8класс
1.Определите число электронов, протонов и электронов в атомах углерода, меди, бария, серебра
2.Назовите элемент в ядре которого содержится 11 протонов
3.Назовите элемент в атоме которого содержится 26 электронов
4.Назовите элемент,заряд ядра которого +23
5.Сколько электронов и протонов входит в состав атома элемента, который
Находится:
1) В 5 периоде и в побочной подгруппе 6 группы
2) В 4 периоде и в главной подгруппе 3 группы
1. C (Углерод) — кол-во протонов и электронов смотрим по порядковому номеру (у углерода он 6), значит кол-во p (протонов) = кол-ву e (электронов) = 6.
Ba (Барий) — порядковое номер 56, следовательно p=e=56
Ag (Серебро) — порядковый номер 47, следовательно p=e=47.
2.
Элемент в ядре, которого содержиться 11 протонов, является элементом, который имеет порядковый номер 11, и этим элементом является Na (натрий).
3.
Элемент в атоме которого 26 электронов, является элементом, который имеет порядковый номер 26, и этим элементом является Fe (железо)
Химия| Элементарные частицы. Протоны. Нейтроны. Электроны.
4.
Заряд ядра — это кол-во протонов в ядре. Следовательно этот элемент имеет порядковое число — 23, и этим элементом является V (ванадий)
5.
1) Этим элементом является Mo (Молибден), у него порядковый номер — 42. p=e=42.
2) Этим элементом является Ga (Галий), у него порядковый номер — 31. p=e=31.
Источник: sous-otvet.net
Глава 3. Химическая связь
Задача 36. Сколько электронов и протонов содержат следующие молекулы и ионы: а) AlH4 – ; б) NF3?
Решение. а) Число протонов в атоме элемента равно порядковому номеру элемента, поэтому атом алюминия содержит 13 протонов, атом водорода — один протон. Всего в ионе AlH4 – содержится 17 протонов. Заряд иона равен –1, поэтому число электронов на единицу превышает число протонов и равно 18.
б) Атом азота содержит 7 протонов, атом фтора — 9 протонов. Всего в молекуле NF3 содержится 7+39=34 протона. Заряд молекулы равен 0, поэтому число электронов равно числу протонов.
Ответ. а) 17 протонов, 18 электронов; б) 34 протона, 34 электрона.
Задача 37. Дайте определение валентности и степени окисления. Приведите структурные формулы 3-аминобензойной кислоты и гидроксобромида магния. Укажите валентности и степени окисления всех элементов.
Решение. Валентность и степень окисления — суть разные понятия, характеризующие способность элементов образовывать химические соединения.
Валентность — это число связей атома данного элемента с атомами других элементов в данном химическом соединении. Валентность всегда имеет положительное целочисленное значение.
Степень окисления — это формальный заряд, которым обладает атом в данном химическом соединении при условии, что все связи имеют ионный характер. Именно последнее требование обусловливает формальность этого понятия. Степень окисления может быть как положительной, так и отрицательной величиной, как дробной, так и целочисленной.
Структурные формулы показывают последовательность соединения атомов в молекуле с соблюдением валентности элементов.
1) 3-Аминобензойная кислота.
Все связи в молекуле 3-аминобензойной кислоты – ковалентные полярные, кроме связей CC в бензольном кольце, которые являются ковалентными неполярными:
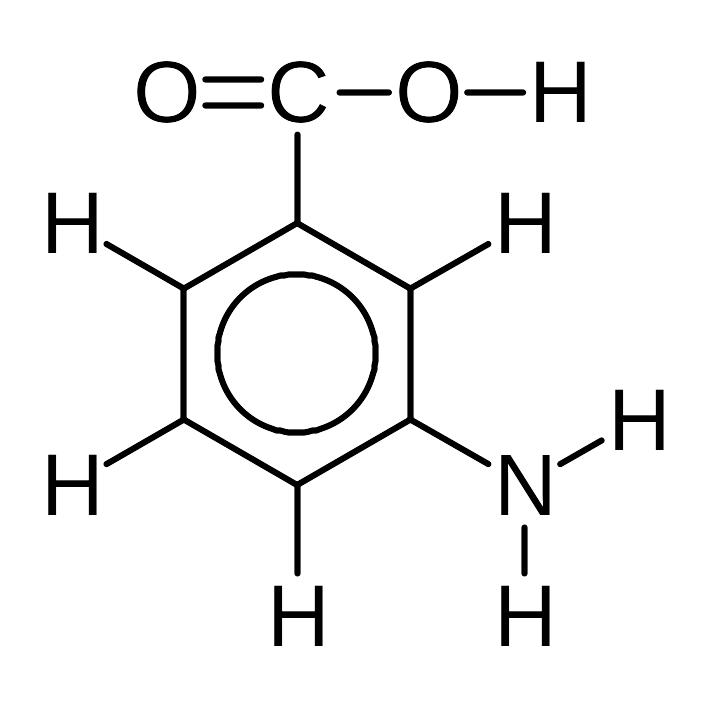
Валентности элементов равны: C – IV, O – II, H – I, N – III. Степени окисления: H +1 , O –2 , N –3 . Степени окисления атомов углерода различны. Атомы C в бензольном кольце при связях CH имеют степень окисления –1 (т.к. углерод – более электроотрицательный элемент, чем водород), атом C при связи CN имеет степень окисления +1 (азот более электроотрицателен, чем углерод), атом C при связи CC — степень окисления 0 (связь между одинаковыми атомами). Наконец, атом C в группе COOH связан тремя связями с более электроотрицательными атомами O и имеет степень окисления +3.
- Гидроксобромид магния Br–Mg–O–H
Задача 38. Каковы валентность и степень окисления азота: а) в азотной кислоте; б) в хлориде аммония?
Решение. а) Структурную формулу азотной кислоты иногда изображают с пятивалентным азотом следующим образом:
В действительности, пятивалентный азот не существует, поскольку для этого атом азота должен иметь пять неспаренных электронов. Распаривание 2s-электронов азота требует очень большой затраты энергии и практически не происходит. Атом азота в азотной кислоте имеет валентность IV. Три ковалентные связи NO образованы за счет неспаренных электронов, и одна — за счет неподеленной пары электронов азота. Структурную формулу азотной кислоты можно писать так:
где стрелочка обозначает донорно-акцепторную связь.
Степень окисления водорода равна +1, кислорода –2, а сумма степеней окисления атомов в молекуле равна 0, поэтому на долю атома азота приходится условный заряд +5.
б) Валентность азота в ионе NH4 + равна IV. Три ковалентные связи NH образованы за счет неспаренных электронов азота, и одна — за счет неподеленной пары электронов.
Степень окисления водорода равна +1, а сумма степеней окисления атомов в ионе равна заряду иона (–1), поэтому на долю атома азота приходится условный заряд –3.
Ответ. а) Валентность IV, степень окисления +5. б) Валентность IV, степень окисления –3.
Решение. Используем следующие правила определения степеней окисления: 1) сумма степеней окисления атомов в молекуле равна 0; 2) степень окисления H равна +1 в соединениях с неметаллами; 3) степень окисления O равна –2, кроме соединений со фтором и перекисных соединений; 4) степень окисления F равна –1; 5) степень окисления металла равна заряду иона металла. Используя эти правила, находим:
1) K2MnO4: K +1 , Mn +6 , O –2 ; 2) Ba(ClO3)2: Ba +2 , Cl +5 , O –2 ; 3) F2O: F –1 , O +2 ; 4) Ca(NO2)2: Ca +2 , N +3 , O –2 ; 5) H2SiF6: H +1 , Si +4 , F –1 ; 6) H2O2: H +1 , O –1 ; 7) Cr2(SO4)3: Cr +3 , S +6 , O –2 .
Задача 40. Опишите пространственную структуру следующих молекул: BF3, ZnCl2, NH3.
Решение. Фторид бора BF3. Пространственная структура этой молекулы определяется тем, что при образовании связей B–F происходит гибридизация одной s- и двух p-орбиталей атома B (sp 2 -гибридизация), при этом образуются три одинаковые sp 2 -гибридные орбитали, расположенные под углом 120 друг к другу. Таким образом, BF3 — плоская молекула с углом 120 между связями.
Хлорид цинка ZnCl2. При образовании молекул типа ZnX2, BeX2 (X — галоген или водород) происходит sp-гибридизация орбиталей центрального атома, и возникают химические связи, направленные под углом 180 друг к другу. Молекулы данного типа линейны.
Аммиак NH3. При образовании связей N–H происходит гибридизация одной s- и трех p-орбиталей атома азота; три sp 3 -гибридные орбитали участвуют в образовании трех связей N–H, а четвертая орбиталь занята неподеленной электронной парой. Молекула имеет форму треугольной пирамиды с атомом азота в вершине. Величина угла между связями N–H несколько отличается от характерного для sp 3 -гибридизации значения 10928′ — она равна 107.
Разобранные примеры показывают, что гибридизация электронных орбиталей характерна не только для соединений углерода, но и для соединений любых элементов, когда химическая связь образуется электронами, принадлежащими к разным, но близким по энергии орбиталям.. Заметим, однако, что структуры молекул типа NH3 и H2O могут быть объяснены и без привлечения модели гибридизации орбиталей.
Задача 41. Для определения структуры молекул в газовой фазе иногда используют метод электронографии, который позволяет найти межъядерные расстояния в молекуле по интенсивности упругого рассеяния электронов. По данным одного из экспериментов межъядерные расстояния в молекуле NCl3 оказались равны: r(NCl) = 0,176 нм, r(ClCl) = 0,283 нм. Установите, какую геометрическую фигуру образуют ядра атомов в этой молекуле. Какой тип гибридизации центрального атома позволяет описать данное строение молекулы?
Решение. Все три связи N–Cl в молекуле NCl3 одинаковы. Молекула может иметь форму правильного треугольника, если атом азота находится в плоскости, образованной тремя атомами хлора:
Если атом азота лежит вне этой плоскости, то молекула имеет форму треугольной пирамиды:
В первом случае угол между связями равен Cl‑N‑Cl = 120, во втором случае ClNCl 120.
Для нахождения этого угла рассмотрим равнобедренный треугольник ClNCl.
По теореме косинусов
r(ClCl) 2 = r(NCl) 2 + r(NCl) 2 – 2r(NCl) 2 cosCl‑N‑Cl,
откуда cosCl‑N‑Cl = 1 – 0,283 2 / (20,176 2 ) = –0,293, Cl‑N‑Cl = 107. Это означает, что молекула представляет собой треугольную пирамиду. Центральный атом азота находится в состоянии sp 3 -гибридизации.
Ответ. Треугольная пирамида. sp 3 -гибридизация.
Задача 42. Рассчитайте объем и радиус атома хрома, исходя из предположения, что атомы имеют форму шара, а объем шаров составляет 68% от общего объема. Плотность хрома равна 7,19 г/см 3 .
Решение. Исходя из определения плотности вещества ( = m / V, где m — масса вещества, V —объем, занимаемый веществом), можно рассчитать объем одного моля хрома (“молярный объем”) VM:
По условию 6,0210 23 атомов хрома занимают объем, равный 7,2320,68 = 4,918 см 3 , следовательно, объем одного атома хрома составит
v = 4,918 см 3 / 6,0210 23 = 8,1710 –24 см 3 = 8,17 Å 3 .
Радиус атома хрома (R) рассчитывается по формуле
Отсюда R(Cr) = = 1,25 Å.
Ответ. v(Cr) = 8,17 Å 3 ; R(Cr) = 1,25 Å.
Задача 43. Как изменяется прочность связи H–Э в ряду H2O–H2S–H2Se–H2Te?
Решение. В указанном ряду размеры валентных электронных облаков элементов (O, S, Se, Te) возрастают, что приводит к уменьшению степени их перекрывания с электронным облаком атома водорода и к возрастающему удалению области перекрывания от ядра атома соответствующего элемента. Это вызывает ослабление притяжения ядер взаимодействующих атомов к области перекрывания электронных облаков, т.е. ослабление связи. К этому же результату приводит возрастающее экранирование ядер рассматриваемых элементов в ряду O–S–Se–Te вследствие увеличения числа промежуточных электронных слоев. Таким образом, при переходе от кислорода к теллуру прочность связи H–Э уменьшается.
Задача 44. Сероводород при обычной температуре — газ , а вода — жидкость. Чем можно объяснить это различие в свойствах?
Решение. Кислород — более электроотрицательный элемент, чем сера. Поэтому между молекулами воды возникают более прочные водородные связи, чем между молекулами сероводорода. Разрыв этих связей, необходимый для перехода воды в газообразное состояние, требует значительной затраты энергии, что и приводит к аномальному повышению температуры кипения воды.
Задача 45. Ниже приведены температуры кипения (в К) благородных газов:
Чем объясняется повышение температуры кипения с возрастанием порядкового номера благородного газа?
Решение. С ростом порядкового номера благородных газов увеличиваются размеры их атомов при сохранении аналогичной структуры внешнего электронного слоя атома. Поэтому поляризуемость атомов возрастает, вследствие чего возрастают и силы ван-дер-ваальсова взаимодействия между ними; отрыв атомов друг от друга, происходящий при переходе вещества из жидкого в газообразное состояние, требует все большей затраты энергии. Это и приводит к повышению температуры кипения.
Задача 46. Дипольный момент молекулы HCl равен 3,510 –30 Клм (или 1,05 Дебая). Рассчитайте длину диполя молекулы хлороводорода.
Решение. Полярность связи количественно оценивается дипольным моментом , который является произведением длины диполя l — расстояния между двумя равными по величине и противоположными по знаку зарядами +q и –q — на абсолютную величину заряда: = lq.
Дипольные моменты молекул обычно выражают либо в Клм, либо в Дебаях.
Абсолютное значение заряда электрона q = 1,610 –19 Кл, поэтому длина диполя молекулы HCl составляет
l = / q = = 2,1910 –11 м = 0,0219 нм.
Ответ: l = 0,0219 нм.
Источник: studfile.net