Сколько граммов Na2SO4 * 10H2O нужно добавить к 600 г 8%-ного раствора сульфата натрия, чтобы получить раствор с массовой долей 15% ?
Ответ: 144,9 г.
Я решала так:
m(Na2SO4 * 10H2O)=x г
М(Na2SO4 * 10H2O)=322 г/моль
кол-во(Na2SO4 * 10H2O)=x/322 моль
значит кол-во(Na2SO4)=x/322 моль
m(Na2SO4)=142x/322 г
m1(Na2SO4)=600 г * 0.08 = 48 г
m(всего раствора) = (x + 600) г
исходя из того, что его массовая долю 0,15, составим уравнение:
0,15=(142х/322)+48 / х+600 = 144,3
С ответом немного не сходится, в ответе 144,9 г. Проверьте, пожалуйста.
Заранее спасибо!
Последний раз редактировалось drkatya Пн июл 02, 2012 10:46 am, всего редактировалось 1 раз.
Re: Задача на растворы
Сообщение Гесс » Пн июл 02, 2012 10:03 am
малая разница с ответом может быть результатом округлений или неучета воды идущей кристаллогидратом, но мне чтото ненравится в решении. Я не вижу где фигурирует 48 грамм сульфата. А они явно входят в 15% раствор. Плюс непонятно концентрация дана в рассчете на безводный или на кристаллогидрат. Я бы решал так:
Задачи по химии. Растворимость 8
х — масса добавляемого безводного сульфата
322/142*х — масса добавляемого кристаллогидрата
0.15 = (48+х)/(600+322/142*х)
600*0.15-48-х+322*0.15*х/142=0
42=х*(1-322*0.15*/142)
х=63.65
кристаллогидрата 144.33
Если брать молекулярки до второго знака, то отет 144.4
Re: Задача на растворы
Сообщение drkatya » Пн июл 02, 2012 10:47 am
Источник: www.chemport.ru
Расчёты с использованием понятия «массовая доля вещества в растворе». Часть 1

В начале страницы вы можете выполнить тест онлайн (после ввода ответа нажимайте кнопку «Проверить решение»: если ответ неверный, то вводите другой ответ, пока не введёте верный или нажмите кнопку «Показать ответ» и у вас появится правильный ответ на это задание и вы сможете перейти к следующему заданию). В середине страницы вы увидите текстовые условия заданий, а текстовые ответы представлены в конце страницы.
Задание 26
Вычислите массовую долю (в %) хлороводорода в растворе, полученном при растворении 11,2 л (н. у.) хлороводорода в 1 л воды. (Запишите число с точностью до десятых.)
К раствору хлорида кальция массой 90 г с массовой долей 5 % добавили 10 г этой же соли. Массовая доля соли в полученном растворе равна _____ % . (Запишите число с точностью до десятых.)
К раствору нитрата кальция массой 80 г с массовой долей 4 % добавили 20 г этой же соли. Вычислите массовую долю соли в полученном растворе. (Запишите число с точностью до десятых.)
Смешали два раствора: один массой 130 г с массовой долей соли 6 %, другой массой 70 г с массовой долей этой же соли 2 %. Массовая доля соли, содержащейся в образовавшемся растворе, равна ____%. (Запишите число с точностью до десятых.)
К 180 г 4%-ного раствора ацетата калия добавили 120 г б%-ного раствора этой же соли. Массовая доля соли в полученном растворе равна ____%. (Запишите число с точностью до десятых.)
Смешали 120 г раствора нитрата калия с массовой долей 15 % и 80 г раствора этой же соли с массовой долей 20 %. Массовая доля соли в полученном растворе равна ____%. (Запишите число с точностью до целых.)
Какое количество (моль) вещества нитрата кальция необходимо для приготовления 820 г раствора с массовой долей 4 %? (Запишите число с точностью до десятых.)
Смешали 300 г раствора с массовой долей соли 20 % и 500 г раствора с массовой долей этой же соли 40 %. Массовая доля соли в полученном растворе равна ____%. (Запишите число с точностью до десятых.)
Смешали два раствора: один массой 120 г с массовой долей соли 15 % , другой массой 125 г с массовой долей этой же соли 10 %. Чему равна масса (г) соли, содержащейся в образовавшемся растворе? (Запишите число с точностью до десятых.)
К 300 г раствора нитрата калия с массовой долей 20 % добавили 40 г той же соли. Чему равна массовая доля (%) нитрата калия в полученном растворе? (Запишите число с точностью до десятых.)
К 110 г раствора с массовой долей хлорида натрия 20% добавили 22 мл воды и 18 г этой же соли. Вычислите массовую долю соли (в процентах) в полученном растворе. (Запишите число с точностью до десятых.)
Вычислите массовую доля серной кислоты (в процентах) в растворе, образующемся при смешивании 120 г 20%-ного и 40 г 50%-ного растворов этой же кислоты. (Запишите число с точностью до десятых.)
Вычислите массу соли (в граммах), которую нужно взять для приготовления 10 кг физиологического раствора с массовой долей хлорида натрия 0,85%. (Запишите число с точностью до целых.)
К 200 г 8%-ного раствора хлорида натрия добавили 80 г воды. Вычислите массовую долю соли (в процентах) в образовавшемся растворе. (Запишите число с точностью до десятых.)
Вычислите массовую долю ацетата натрия (в процентах) в растворе, полученном при добавлении 120 г воды к 200 г раствора с массовой долей соли 8%. (Запишите число с точностью до целых.)
Вычислите массовую долю хлорида аммония (в процентах) в растворе, полученном при добавлении 50 г воды к раствору, состоящему из 70 г воды и 20 г хлорида аммония. (Запишите число с точностью до десятых.)
Вычислите массу нитрата калия (в граммах), которую следует растворить в 150,0 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%. (Запишите число с точностью до десятых.)
К раствору, состоящему из 45 г воды и 15 г соли, добавили 65 г воды и 10 г той же соли. Вычислите массовую долю (%) соли в полученном растворе. (Запишите число с точностью до десятых.)
К 100 г раствора с массовой долей хлорида натрия 15% добавили 35 мл воды и 25 г этой же соли. Вычислите массовую долю (%) соли в полученном растворе. (Запишите число с точностью до целых.)
К 110 г раствора с массовой долей хлорида магния 10% добавили 21 мл воды и 21 г этой же соли. Вычислите массовую долю (%) соли в полученном растворе. (Запишите число с точностью до целых.)
Смешали 70 г раствора с массовой долей нитрата натрия 30% и 130 г раствора этой же соли с массовой долей 20%. Вычислите массовую долю (%) соли в полученном растворе. (Запишите число с точностью до десятых.)
Вычислите массу (г) уксусной кислоты, которую следует растворить в 150 г столового 5%-ного уксуса для получения 10%-ного раствора. (Запишите число с точностью до десятых.)
Смешали 120 г раствора с массовой долей нитрата натрия 25% и 80 г раствора этой же соли с массовой долей 50%. Вычислите массовую долю соли (в процентах) в полученном растворе. (Запишите число с точностью до целых.)
К 70 г раствора с массовой долей хлорида кальция 40% добавили 18 мл воды и 12 г этой же соли. Вычислите массовую долю соли (в процентах) в полученном растворе. (Запишите число с точностью до целых.)
К 115 г раствора с массовой долей хлорида натрия 20% добавили 58 мл воды и 2 г этой же соли. Вычислите массовую долю хлорида натрия (в процентах) в полученном растворе. (Запишите число с точностью до целых.)
К 130 г раствора с массовой долей нитрата магния 10% добавили 17 г этой же соли и выпарили 27 мл воды. Вычислите массовую долю нитрата магния (в процентах) в полученном растворе. (Запишите число с точностью до целых.)
К раствору, состоящему из 70 г воды и 20 г хлорида аммония, добавили 50 г воды. Вычислите массовую долю соли (в процентах) в полученном растворе. (Запишите число с точностью до десятых.)
К 75 г раствора с массовой долей соли 14% добавили 10 г той же соли и 10 мл воды. Вычислите массовую долю (%) соли в полученном растворе. (Запишите число с точностью до десятых.)
Вычислите массу воды (в граммах), которую нужно выпарить из 200 г 12%‐го раствора нитрата натрия, чтобы получить раствор, в котором массовая доля соли равна 20%. Ответ округлите до целых.
Вычислите массу нитрата натрия (в граммах), которую нужно добавить к 500 г 20%‐го раствора нитрата натрия, чтобы получить раствор, в котором массовая доля соли равна 25%. Ответ округлите до десятых.
Ответы:
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
Также:
- Посмотреть реальные, досрочные и пробные варианты ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки для подготовки к ЕГЭ вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ вы можете здесь, нажав на эту строку
Источник: www.yoursystemeducation.com
Задание 26. Расчёты с использованием понятия «массовая доля вещества в растворе». ЕГЭ 2024 по химии

За это задание ты можешь получить 1 балл. На решение дается около 2 минут. Уровень сложности: базовый.
Средний процент выполнения: 58.9%
Ответом к заданию 26 по химии может быть целое число или конечная десятичная дробь.
Разбор сложных заданий в тг-канале
Задачи для практики
Задача 1
Какую массу цинкового купороса $ZnSO_4 · 7H_2O$ необходимо добавить к 100 г раствора сульфата цинка с массовой долей 5 % для получения 10 %-ного раствора соли? (Запишите число с точностью до целых.) Ответ в (г).
Решение
Для начала найдем массу сульфата цинка в растворе:
Найдем массовую долю сульфата цинка в купоросе:
M($ZnSO_4$)/(7*M($H_2O$) + M($ZnSO_4$)) = 161/287 = 0.56
Примем массу купороса за m — тогда масса безводного сульфата цинка будет равна 0.56m
5 + 0.56m = 0.1(m+100)
Округлим до целых чисел – 11 грамм
Ответ: 11
Показать решение
Задача 2
К раствору сульфида калия массой 60 г с массовой долей 4 % добавили 1,6 г этой же соли и выпарили 11,6 г воды. Рассчитайте массовую долю соли в полученном растворе. (Запишите число с точностью до целых.) Ответ в (%).
Решение
m($K_2S$) = 60 x 0.04 = 2.4 г
ω($K_2S$) = (2.4 +1.6) : 50
Ответ: 8
Показать решение
Задача 3
200 мл 36,5 %-ного раствора соляной кислоты (плотностью 1,18 г/мл) оставили в открытой колбе в вытяжном шкафу, в результате концентрация кислоты снизилась до 30 %. Рассчитайте массу улетучившегося хлороводорода (испарением воды пренебречь). (Запишите число с точностью до сотых.) Ответ в (г).
Решение
Найдем массу начального раствора, умножив его объем на плотность:
m(раствор) = 200*1.18 = 236 г.
m(HCl, 1) = 236*0.365 = 86.14 г.
Найдем массу воды в растворе:
m($H_2O$) = 236 – 86.14 = 149.86 г.
X – конечное количество кислоты
Найдем разницу масс кислоты:
∆m(HCl) = 86.14 – 64.23 = 21.91 г.
Ответ: 21.91
Показать решение
Задача 4
Сколько граммов хлорида натрия необходимо растворить в 50 г воды для приготовления раствора с массовой долей соли 20 %? (Запишите число с точностью до десятых.) Ответ в (г).
Решение
Раз соли в растворе 20%, то воды будет 80%
Теперь составим уравнение и решим его:
Ответ: 12.5
Показать решение
Задача 5
Смешали 60 г раствора гидроксида калия с массовой долей 15 % и 140 г раствора этого же вещества с массовой долей 18 %. Вычислите массу щёлочи в полученном растворе. (Запишите число с точностью до десятых.) Ответ в (г).
Решение
Найдем массу гидроксида в первом растворе, умножив массовую долю на массу раствора:
m(KOH, 1 раствор) = 60 * 0.15 = 9 г.
Таким же образом найдем массу вещества во втором растворе:
m(KOH, 2 раствор) = 140 * 0.18 = 25.2 г.
А теперь просто сложим массы и получим общую массу гидроксида калия в конечном растворе:
m(KOH, кон.) = 25.2 + 9 = 34.2 г.
Ответ: 34.2
Показать решение
Задача 6
К 480 г раствора соли с массовой долей 10 % добавили 320 мл воды. Рассчитайте массовую долю соли в полученном растворе. (Запишите число с точностью до целых.) Ответ в (%).
Решение
Массовая доля – отношение массы вещества к массе раствора.
Найдем массу конечного раствора, сложив массу изначального с добавляемым:
$m_к = m_1 + m_2$ = 480 + 320 = 800 г.
Определим массу вещества в исходном растворе:
m (соли) = 480*0.1 = 48 г
Найдем массовую долю соли в конечном растворе:
M = $m_$ / $m_к$ = 48/800 = 0.06 = 6%
Ответ: 6
Показать решение
Задача 7
Смешали 200 г 10 %-ного и 400 г 20 %-ного раствора хлорида натрия, и из раствора выпарили 30 г Н2О. Вычислите массовую долю соли в полученном растворе. (Запишите число с точностью до сотых.) Ответ в (%).
Решение
Массовая доля хлорида натрия в 3-м растворе вычисляется по формуле:
где $m_1(NaCl)$ и $m_2(NaCl)$ — массы NaCl в 1-м и во 2-м растворах,
$m_$ и $m_$ — массы 1-го и 2-го растворов соответственно,
$m(H_2O)$ — масса испарившейся воды.
Массы хлорида натрия в 1-м и 2-м растворах можно найти по формулам:
$m_1(NaCl) = ω_1 · m_(NaCl)$
$m_2(NaCl) = ω_2 · m_(NaCl)$
1) $m_1(NaCl)$ = 0.1 · 200 = 20 г
2) $m_2(NaCl)$ = 0.2 · 400 = 80 г
3) $m_3(NaCl)$ = 20 + 80 = 100 г
4) $m_$ = 200 + 400 – 30 = 570 г
5) $ω_3(NaCl)$ = 100 / 570 ≈ 0.1754, или 17.54 %
Ответ: 17.54
Показать решение
Задача 8
К 200 г 10 %-ного раствора хлорида калия добавили 25 г этой же соли и 15 мл воды. Рассчитайте массовую долю соли в полученном растворе. (Запишите число с точностью до сотых.) Ответ в (%).
Решение
Составим рисунок, схематически отображающий происходящие процессы.
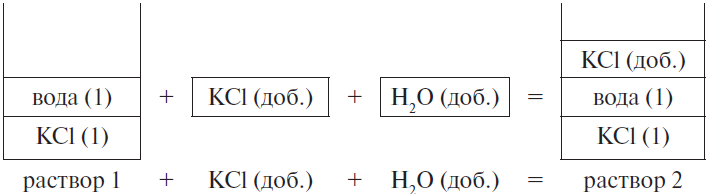
Массовая доля хлорида калия во 2-м растворе вычисляется по формуле:
где $m_2(KCl)$ — масса KCl во 2-м растворе, $m_$ — масса 2-го раствора.
1) масса хлорида калия равна сумме массы хлорида калия в первом растворе и массы добавленной соли, т. е.:
$m_2(KCl) = m_1(KCl) + m(KCl)_$
Массу хлорида калия в 1-м растворе можно найти по формуле:
$m_1(KCl) = ω_1 · m_(KCl)$
2) масса второго раствора равна сумме масс первого раствора, добавленной соли и воды, т. е.:
1) $m_1(KCl)$ = 0.1 · 200 = 20 г
2) $m_2(KCl)$ = 20 + 25 = 45 г
3) $m(H_2O)_$ = 1 ∙ 15 = 15 г
4) $m_$ = 200 + 25 + 15 = 240 г
5) $ω_2(KCl)$ = 45 / 240 = 0.1875, или 18.75 %
Ответ: 18.75
Показать решение
Задача 9
Вычислите массовую долю сульфата натрия в растворе, полученном добавлением 100 мл воды к 250 г 15 %-ного раствора соли. (Запишите число с точностью до сотых.) Ответ в (%).
Решение
Составим рисунок, схематически отображающий происходящие процессы.
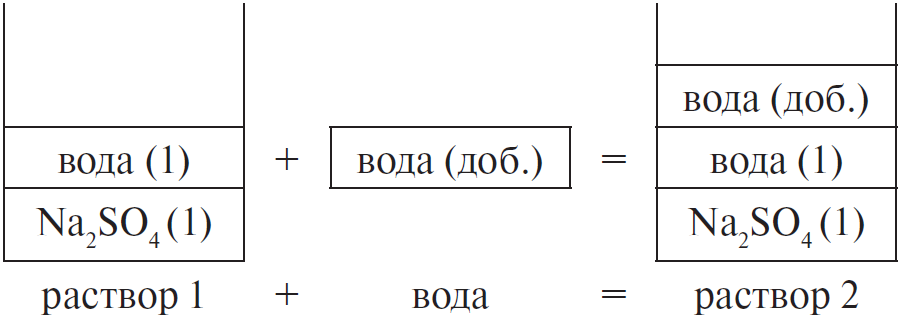
Массовая доля сульфата натрия во 2-м растворе вычисляется по формуле:
где $m_2(Na_2SO_4)$ — масса $Na_2SO_4$ во 2-м растворе,
$m_$ — масса 2-го раствора.
1) масса сульфата натрия не изменяется, т. е. $m_1(Na_2SO_4) =$
$m_2(Na_2SO_4)$. Массу сульфата натрия в 1-м растворе можно найти
$m_1(Na_2SO_4) = ω_1 · m_(Na_2SO_4)$
2) масса второго раствора равна сумме масс первого раствора
и добавленной воды, т. е.:
1) $m_1(Na_2SO_4) = 0.15 · 250 = 37.5$ г
2) $m(H_2O) = ρ · V = 1 · 100 = 100$ г
$m_ = 250 + 100 = 350$ г
3) $ω_2(Na_2SO_4) = 37.5 / 350 ≈ 0.1071$, или $10.71$ %
Ответ: 10.71
Показать решение
Задача 10
Какую массу поваренной соли нужно добавить к 250 г раствора этой же соли с массовой долей 10 % для получения раствора соли с массовой долей 18 %? (Запишите число с точностью до десятых, г.)
Решение
Массовая доля – отношение массы вещества к массе раствора.
Найдем массу исходной соли в растворе:
m (NaCl, исх.) = 250*0.1 = 25 г
Составим уравнение и решим:
Источник: egeturbo.ru